新型多功能化金纳米棒的合成与表征
吴克勤,许海艳,吴远波,彭珊珊,张 鸿,张瑜娟
(1.江西省医学科学院;2a.南昌大学研究生院医学部2019级;2b.南昌大学基础医学院免疫教研室,江西 南昌30063)
引言
恶性肿瘤也称癌症,在全球范围内,癌症是引起人类死亡的三大杀手之一,如何提高癌症的治疗效果,延长患者的生存时间,改善患者的生活质量成为癌症治疗的世界性问题。癌症的治疗主要有手术、放疗和化疗,其中化学药物治疗(化疗)已经成为癌症治疗的首选。然而化疗靶向性差,毒副作用严重,而且长期使用容易产生耐药性,极大地限制了其治疗剂量从而阻碍了药物的使用和疗效。肿瘤靶向药物传递系统可以改善治疗效果和全身毒性问题。因此,通过设计高效的药物靶向输送系统,来改善化疗对癌症的治疗效果[1-3]。
金纳米棒(Gold nanorod,GNR)是尺度从几纳米到几百纳米的棒状金颗粒。GNR具有良好的可控的表面化学性质和可修饰性,通过表面修饰不同的靶向部分和运载各种药物分子(如siRNA等),可以增强肿瘤细胞的摄取从而加强对癌细胞的杀灭效果[4,5]。作为纳米材料,金纳米棒有独特的光学性质、表面多功能修饰性、化学惰性以及良好的生物相容性,已经广泛用于药物载体、细胞成像、肿瘤诊断、光热治疗等研究中[6,7]。
甘露糖受体在部分肿瘤细胞表面高表达,在正常细胞中却较少,因此癌细胞表面高表达的甘露糖受体为抗肿瘤靶向药物提供了新靶点。将甘露糖分子修饰到药物载体表面能够识别癌细胞表面高表达的甘露糖受体从而实现靶向药物输送[8,9]。
1 实验部分
1.1 试剂和仪器
实验中所使用的药品和溶剂均为分析纯级别,无需进一步纯化。十六烷基溴化铵(CTAB),硼氢化钠(NaBH4),氯金酸(HAuCl4·3H2O),聚乙烯亚胺(PEI),巯基十一酸(MUA)和甘露糖均为国药集团上海化学试剂有限公司产品。用四甲基硅烷(TMS)作为内标,重水作为溶剂,使用Bruker AVANCE NEO 500 MHz FT-NMR Spectrometer(500 MHz)光谱仪来进行NMR光谱图的记录。马尔文公司ZETASIZER NANO测量了修饰后金纳米棒表面电位。日本电子公司JEM-210003040700测量金纳米棒尺寸。安捷伦科技有限公司Cary10003040425进行紫外-可见吸收光谱图的记录。
1.2 合成部分
1.2.1 GNR-CTAB的制备
根据经典的金种子溶液生长法,合成研究所需的金纳米棒溶液。种子溶液的制备:取7.5 mL CTAB溶液于瓶中,向其中加入250 μLHAuCl4·3H2O(10 mM),控制体系温度在28 ℃左右。吸取600 μL提前制好、-20 ℃预冷的NaBH4(10 mmol/L)慢慢加入到上述HAuCl4溶液中,溶液逐渐变为茶色,即为种子溶液,将种子溶液放到28 ℃水浴锅中静置2 hrs。生长溶液的制备:取单口圆底烧瓶,加入100 mL CTAB水溶液(100 mmol/L),置于30 ℃水浴锅中,继续加入4.25 mL HAuCl4·3H2O(10 mM)搅拌1 min,后加入0.625 mL AgNO3(10 mmol/L),恒温搅拌5 min,溶液颜色不变。向上述溶液中加入抗坏血酸0.675 mL(100 mmol/L),无颜色变化,呈透明,恒温搅拌5 min。取0.5 mL种子溶液慢慢加入到上述溶液中,溶液由透明渐渐加深至紫黑色,恒温搅拌24 hrs,即得金纳米棒(GNR-CTAB)溶液。
GNR-CTAB的表征:将合成的金纳米棒溶液12000 rpm,10 min,离心2遍,用三蒸水重悬,用于测GNR-CTAB的TEM。
1.2.2 MUA-PEI(水溶液)的制备
称取0.6540 g MUA于30 mL氯仿中搅拌溶解;加入0.5751 g EDC,搅拌15 min,后加入0.3450 g NHS搅拌15 min;加入5.4 g PEI搅拌24 hrs后,向其中加入30 mL三蒸水,搅拌1 hrs,静置萃取上清液。
1.2.3 MUA-MAN(水溶液)的制备
取10 mLMUA-PEI溶液于瓶中,加入3 mL PBS缓冲液(10 mM,pH=7.4)搅拌1 min,然后加入0.1801 g甘露糖,再剧烈揽拌1 min后,该混合溶液在90 ℃下搅拌40 min。最后,通过透析袋(MWCO=1000 Da),将合成的MUA-MAN溶液透析72 hrs后,收集透析袋内的溶液,并在4 ℃条件下保存备用。
1.2.4 GNR-PEI和GNR-MAN的合成
取10 mg冷冻干燥后的GNR-CTAB粉末溶于10 mL水溶性PEI-MUA复合物中,在室温下超声搅拌24 h后,CTAB被更强的Au-S键取代后得到GNR-PEI;10 mg冷冻干燥后的GNR-CTAB粉末溶于10 mL水溶性MUA-MAN复合物中,在室温下搅拌24 hrs后,CTAB被更强的Au-S键取代后得到GNR-MAN。将上述溶液以12,000 rpm离心15 min后去除多余的上清液,并将沉淀物用蒸馏水洗涤2次。通过冷冻干燥制备GNR-PEI和GNR-MAN粉末,称重并溶解在非核酶水中备用。
GNR-PEI的表征检测:采用zeta电位分析检测GNR-PEI的电荷量。
GNR-MAN的表征检测:采用透射电子显微镜检测GNR-MAN大小和分散性;采用zeta电位分析检测GNR-MAN的电荷量;核磁共振氢谱检测GNR-MAN修饰的官能团。
2 结果与讨论
2.1 GNR-CTAB的TEM图
图1是GNR-CTAB的TEM图,从中看出,GNR-CTAB的长度约为30 nm,直径约为10 nm,分散性较好。

图1 GNR-CTAB的TEM图
2.2 MUA-PEI的核磁共振氢谱
MUA-PEI的核磁共振氢谱如图2所示。在MUA-PEI的核磁共振氢谱中,除了在2.50 ppm处出现PEI的特征峰,还出现了MUA的特征峰,说明MUA-PEI合成成功。
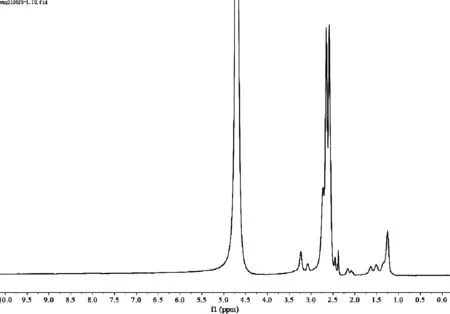
图2 MUA-PEI的核磁共振氢谱
2.3 MUA-MAN的表征
2.3.1 MUA-MAN的UV/Vis吸收光谱表征
MUA-PEI,MAN和MUA-MAN在水溶液中的UV/Vis吸收光谱如图3所示。在300 nm以上,MUA-PEI和甘露糖溶液都没有吸收,但是MUA-MAN溶液在350 nm处有一个新的吸收峰出现,与文献报道相符[10]。
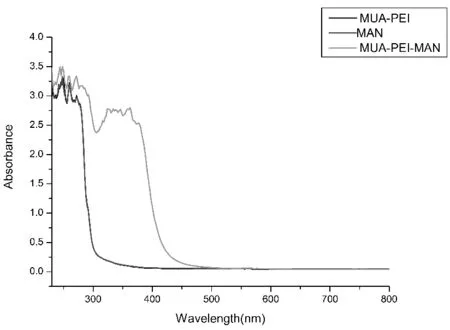
图3 在水溶液中MAN、MUA-PEI和MUA-MAN的UV/Vis吸收光谱
2.3.2 MUA-MAN的核磁共振氢谱表征
MUA-MAN的核磁氢谱如图4所示。MUA-MAN在8.0 ppm处出现的新峰,这是C=N键的特征峰,而MUA-PEI在该位置并没有此峰,MUA-MAN中有席夫碱的形成,与文献报道相符[10]。
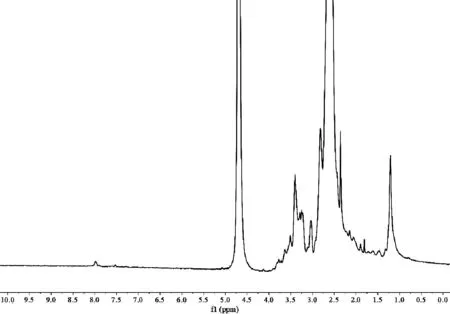
图4 MUA-MAN的核磁共振氢谱
2.4 GNR-MAN的表征
2.4.1 GNR-MAN的TEM
GNR-MAN的TEM如图5所示,其长度约为30 nm,直径约为10 nm,在化学缀合甘露糖后,GNR的尺寸无明显变化,并且仍然具有良好的分散性。

图5 GNR-MAN的TEM图
2.4.2 GNR-MAN的核磁共振氢谱
GNR-MAN的核磁共振氢谱如图6所示。在8.4 ppm处出现了C=N键的特征峰,说明巯基(-SH)和金原子之间有很强的亲和力,带巯基的化合物可以与晶种生长法所合成的GNR表面的CTAB进行相对直接的置换,MUA-MAN取代了CTAB,从而达到修饰GNR的目的。
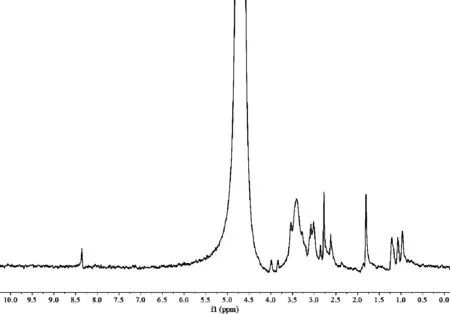
图6 GNR-MAN的核磁共振氢谱
2.4.3 GNR-MAN的zeta电位分析
GNR-MAN的zeta电位分析如图7所示。zeta电位分析表明,当分别用MUA-PEI或MUA-MAN修饰GNR时,GNR的表面电荷从35.6 mV增加到42.7 mV或41.3 mV,表明GNR-MAN具有很强的结合自身带负电荷的siRNA的能力。
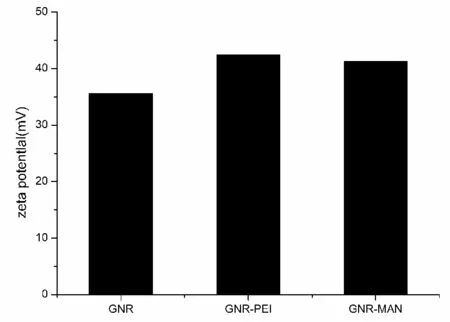
图7 GNR-MAN的zeta电位分析
3 结论
本项目建立新型的基于纳米材料GNR的新型多功能纳米载药系统(GNR-Man),其长度约为30 nm,直径约为10 nm,在化学缀合甘露糖后,GNR的尺寸无明显变化,并且仍然具有良好的分散性。GNR-MAN表面电荷为41.3 mV,具有很强的结合siRNA的能力,该系统能在体内携带siRNA靶向肿瘤组织,从而增强抗肿瘤的治疗效果,为基于金纳米棒的靶向载药提供理论和实验依据。

