固相萃取净化-离子色谱法测定甲壳类水产品中草酸的残留
黄嘉乐,党华,吴滋灵,岑建斌,黄嘉瑜,陈伟萍
(广州检验检测认证集团有限公司,广东广州 511447)
《中国水产》发布的《2019 年全国渔业经济统计公报》[1]显示,2019 年甲壳类水产咸(淡)水养殖产 量高达5.67×106t,产量及消费量巨大,且呈增长的趋势。不法商贩为了让小龙虾看上去干净透亮、节省清洗时间,常常会使用“洗虾粉”对甲壳类水产进行清洗。该物质为白色粉末且具有刺激性气味,使用操作简便,对甲壳类水产的清洁快速高效,能在较短时间内洗净污物[2],且甲壳类水产外表色泽鲜亮、易于出售。
研究表明,“洗虾粉”主要成分为柠檬酸、亚硫酸盐和草酸[3-4],其中草酸作为一种化工生产原料,根据我国GB 2760-2014《食品添加剂使用标准》规定不允许用于食品中。此外草酸也可作为水体污染物迁移到甲壳类水产品。消费者进食大量经草酸处理的甲壳类水产品时,容易出现高草酸血症,心肌或传导系统会受到体内草酸过多的影响,并诱发心力衰竭和致命性心律失常[5]。
国内外关于草酸含量测定的方法主要集中在色谱分析方法[6-8]、光谱分析方法[9]及酶联免疫定性法[10-11]。其中分光光度法(光谱法)主要通过化学反应,根据吸光度变化对草酸进行检测,相对色谱法便宜,但灵敏度不足。显色法和酶联免疫法则一般只适用于定性分析,无法对草酸进行有效的定量。鉴于色谱分析方法特异性强、灵敏度高的优点,适用于甲壳类水产品草酸残留量的检测。已有报道的离子色谱法,其研究对象均为小龙虾,缺少对其他甲壳类水产品草酸残留的研究,且只对小龙虾体表的草酸进行测定,没有对样品整体进行更深入的研究。
由于国内甲壳类水产品中草酸含量的测定无相关检验标准及判定标准,国内外对草酸分析方法的研究,主要集中在环境检测及植物源性草酸测定,对甲壳类水产品中草酸含量的测定研究较少。而“洗虾粉”导致的甲壳类水产品草酸超量引起中毒的现象,经媒体报道后,立即成为群众关心的热点问题。这些问题受到了监管部门的重视,目前,关于甲壳类水产品草酸含量的测定研究较少,监管部门缺乏标准及技术支持,对监管造成困难。因此,加强对甲壳类水产品中草酸含量的检测技术研究,可有效保障人民生命财产的安全。
本文根据草酸水溶性强、在碱性条件下呈阴离子状态稳定存在的特点,建立了一个基于阴离子交换色谱分离,洗脱液背景抑制,电导检测的分析方法,测定甲壳类水产品中草酸的残留量。该方法无需衍生,具有抗非离子物质干扰能力,灵敏度高,准确性好,能满足甲壳类水产品的检测需求,具有良好应用前景。
1 材料与方法
1.1 仪器与试剂
Dionex ICS-3000 双系统离子色谱仪,美国赛默飞世尔科技公司;EG 淋洗液自动发生器、AS-AP 自动进样器、DP 四元梯度泵、DC 控制单元、Chromeleon7.0色谱工作站(变色龙工作站),美国赛默飞世尔科技公司;KDC-1044 低速离心机,安徽中科中佳科学仪器有限公司;Milli-Q 超纯水系统,美国Merk 密理博公司;MS3 basic 漩涡混合器,德国艾卡公司;KQ-250DV数控超声波清洗仪,昆山市舒美牌超声仪器有限公司;BrandTransferpette 移液枪(100~1000 μL、0.5~5 mL),德国BRAND 公司;固相萃取装置,美国沃特世公司;5 mL 一次性注射器,湖南平安医械科技有限公司;有机相针筒式滤膜过滤器(13 mm×0.22 μm),天津市津腾实验设备有限公司;Dionex OnGuardⅡRP2.5 mL 过滤柱,美国赛默飞世尔科技公司;Dionex OnGuard ⅡAg/H2.5 mL 过滤柱,美国赛默飞世尔科技公司;50 mL 高速离心管,美国Corning 公司;乙腈(色谱纯),德国Merck 公司;草酸标准品(粉剂,纯度97%),德国Dr.Ehrenstorfer 公司;超纯水(18.2 MΩ),实验室自制。
根据实际需求称取适量草酸标准物质,用纯水溶解配成草酸标准储备液,放置于4 ℃冰箱保存,临用前用超纯水稀释成所需浓度的工作液。
分析样品:淡水小龙虾、淡水河蟹、海水青蟹和海水明虾样品均购于本地不同市场。
1.2 样品的提取与净化
提取:取约50 g 甲壳类水产样品,带壳放入料理机粉碎机均质(蟹类锤碎后整体粉碎),充分混匀。称取均质后的试样5.00 g(精确至0.01 g)置于50 mL带螺纹盖的聚丙烯尖底离心管中,加入超纯水10.0 mL,涡旋振荡3 min,超声提取30 min,以4000 r/min速率低温冷冻离心3 min,去除脂肪,移取所有提取液至10 mL 容量瓶中并用超纯水定容。
活化:OnGuard II RP 柱用10 mL 甲醇、10 mL 超纯水活化,OnGuard II Ag/H 柱用10 mL 超纯水活化,活化后的按照RP-Ag/H 的顺序进行串联,柱后接上滤膜。
净化:准确移取容量瓶中样品提取液1.00 mL 至10 mL 容量瓶中,加入1.00 mL 乙腈涡旋1 min,沉淀蛋白质及其他杂质。静置分层后,再准确移取1.00 mL样品上清液至15 mL 带螺纹盖的聚丙烯尖底离心管中,加入4.00 mL 超纯水,振荡1 min 混匀后,经过串联固相萃取柱进化。净化时,先用3 mL 混合液润洗柱子,弃去,收集后续滤液,供离子色谱分析。
加标样品的制备:在50 mL 聚丙烯尖底离心管中,准确称取5.00 g(精确至0.01 g)均质后的阴性甲壳类水产试样并加入适量草酸标准溶液,4 ℃冰箱冷藏放置12 h。
1.3 仪器条件
Dionex IonPac AS11-HC 分析柱(250 mm×4 mm)及IonPac AG-11 保护柱(50 mm×4 mm);Dionex ADRS-600(4 mm)电解再生抑制器,抑制电流124 mA,外加水模式;AS-AP 自动进样,定量环100 μL,满环进样;柱温箱温度30 ℃;电导检测,电导池温度35 ℃;在线电解生成淋洗液,流速1.0 mL/min,淋洗程序见表l。
1.4 数据处理
样品通过离子色谱分离电导测定,得到具有导电性化合物的离子色谱图。使用Chromeleon 7.0 色谱工作站采集处理数据,使用色谱峰的保留时间定性,色谱峰面积定量。图表采用Microsoft Excel 2016 软件进行绘制。
2 结果与讨论
2.1 离子色谱柱的选择及色谱条件的确立
为了提高目标离子的电导响应强度,进样量需达到100 μL,同时天然食品中高浓度的阴离子(如Cl-,SO42-等)会造成过载现象,因此,需要使用高柱容量(250 mm×4 mm)、氢氧根体系的阴离子色谱分析柱:AS11-HC、AS16-HC、AS18-HC、AS19-HC[12-13]。由于AS19-HC 适用于检测样品中的卤氧化合物,AS18-HC 常用于无机阴离子的快速分离,AS16-HC主要用于分析样品中的易极化阴离子,AS11-HC 适用于分离复杂基质中的大量无机阴离子和有机酸阴离子,并具有改善一价羧酸的分离效果。
草酸易溶于水和碱性水溶液,不溶于有机溶剂,且在碱性水溶液中以二价草酸根阴离子状态存在,适用于离子色谱体系分离检测。根据离子交换色谱的特点,为了将痕量被测离子与基体中其它阴离子有效分离,本文选用高容量羟基选择性阴离子交换色谱柱AS11-HC 作为分离色谱柱,可在分离复杂基质中的有机、无机阴离子时,获得最佳色谱分析速度和分离度。
草酸在KOH 淋洗液中以草酸根形式存在,草酸根在阴离子交换柱(AS11-HC)上是强保留离子,难以洗脱,为了使草酸和其它阴离子能够完全分离,采用KOH 淋洗液梯度淋洗分离,梯度淋洗条件见表1。在上述色谱条件下,草酸出峰时间为11.7 min(图1),峰形良好。

表1 甲壳类水产品中草酸分离的氢氧化钾梯度淋洗程序Table 1 Gradient of potassium hydroxide eluent for separation of oxalic acid in crustacean aquatic products

图1 草酸标准溶液(1.00 mg/L)的离子色谱图Fig.1 Ion chromatogram of oxalic acid standard solution (1.00 mg/L)
2.2 提取条件的选择
为了优化草酸的提取,实验分别研究了超纯水、50%乙腈水溶液、50%甲醇水溶液、1.00%甲酸水溶液、0.50% KOH水溶液对添加2.00 mg/kg草酸的甲壳类水产加标样品(小龙虾、河蟹、青蟹、明虾)提取效果,实验结果见图2。数据显示,当使用50%乙腈水溶液和50%甲醇水溶液提取时,所有样品草酸回收率均低于60%。甲壳类水产品中蛋白、脂肪含量较高,乙腈水溶液和甲醇水溶液均会将样品中脂溶性物质提取到提取液中,且草酸易溶于水,不溶于有机溶剂,导致这两种溶剂对草酸的提取效率不理想。由于甲壳类水产样品基质较为复杂,在酸或碱溶液中会使样品中部分物质转变成离子状态进入提取液中[14-15],其特有的甲壳素类物质,在碱性条件下会水解产生氨基葡萄糖,对提取液中草酸的离子色谱出峰造成严重干扰,无法进行准确定量。而采用超纯水提取,草酸回收率大于85%,且不会增加其他离子干扰,因此本文采用超纯水作为提取溶剂。

图2 5 种提取液对甲壳类水产品中草酸回收率的影响Fig.2 Effect of five kinds extracting solution on the recoveries of oxalic acid in crustacean aquatic products (n=6)
此外,甲壳类水产品由于生长及蜕壳需要,一般生活在含有钙,镁,铁等离子的养殖水中[16],甲壳类水产品的饲料亦含有大量钙元素[17]。本文测定10 个销售摊点养殖水的钙含量,发现Ca2+含量均大于25.0 mg/L。草酸钙在25 ℃水中溶解度为:6.70 mg/L,养殖水存在的草酸根,会与钙离子形成不溶于水的草酸钙晶体,无法进入甲壳类水产品体内。由于草酸钙晶体不溶于水,当用超纯水提取样品时,草酸盐不会对草酸检测结果造成影响。
超纯水提取甲壳类水产品时,水产样品中的大量水溶性蛋白、氨基酸、糖类物质等会同时进入提取液中。根据离子交换特性及相关研究[18-22],我们通过乙腈沉淀法去除蛋白质、糖类等杂质。提取液加入乙腈后,乙腈打破了原有提取液中的电解质平衡,在离子效应、共沉效应、电解质作用等共同作用下,蛋白质、氨基酸、糖类等凝结成大分子物质沉淀出来[23],使样品溶液更加清澈透明,提高了净化效果。
2.3 固相萃取条件的优化
样品提取溶液经过乙腈沉淀去除杂质后,溶液中仍然存在低极性化合物与离子态干扰物,影响甲壳类水产品草酸残留量的准确测定。因此,需要对初步除杂后的样品提取液进行固相萃取净化,以免干扰物质对草酸的峰形及草酸的定性、定量产生影响。本文分别研究了四种固相萃取柱的净化效果,包括反相吸附的C18(6 mL,500 mg)固相萃取柱,亲水-亲脂平衡吸附Oasis HLB(6 mL,500 mg)柱固相萃取柱,大孔树脂填料的Dionex OnGuard Ⅱ RP(2.5 mL)串联Ag/H(2.5 mL)固相萃取柱和富集净化的弱阴离子交换柱(Oasis WAX,6 mL,500 mg)的净化效果,结果见图3、图4。从离子色谱图上发现,C18柱固相萃取净化后,草酸回收率较好,但是谱图上仍然存在干扰峰。HLB 柱可以去除甲壳类水产品提取液中的脂肪和极性物质,但是作为极性物质的草酸也会被吸附,回收率不理想。使用弱阴离子交换柱(Oasis WAX)净化富集时,由于甲壳类水产样品中含有大量有机酸、脂肪酸、虾青素、氨基酸和Cl-等阴离子类杂质,与草酸产生相应的竞争吸附,因此目标化合物的回收率较低。
使用OnGuard Ⅱ RP 串联Ag/H 固相萃取柱净化时,不同基质样品回收率均达到70%以上。样液先通过填料为大孔二乙烯基苯树脂的OnGuard Ⅱ RP 柱去除甲壳类水产品基质中的亲脂型疏水物质,且对亲水性的草酸几乎没保留。然后通过填料为包含Ag+与H+的高容量强酸型聚苯乙烯型阳离子交换树脂的OnGuard Ⅱ Ag/H 柱去除提取液中的Cl-及微量重金属。最后,使用0.22 μm 的有机针式过滤膜进行过滤,不仅达到理想的净化效果,还降低了提取液中固体悬浮颗粒对色谱系统的损害[24](见图3、图4)。

图3 不同固相萃取条件下添加20.00 mg/kg 草酸的小龙虾样品的离子色谱图Fig.3 Ion chromatograms of the crustacean aquatic products of 20.00 mg/kg oxalic acid under different solid phase extraction conditions

图4 4 种类型固相萃取条件对甲壳类水产品中草酸回收率的影响Fig.4 Effect on the recoveries of oxalic acid in crustacean aquatic products purified by four types of solid phase extraction conditions (n=6)
实验数据显示,RP 串联Ag/H 固相萃取柱的除杂效果明显,洗脱溶液较透明干净,目标物回收率达到77%,净化效果理想。综上所述,选择将甲壳类水产品提取液分别过经活化的OnGuard Ⅱ RP 柱和OnGuard Ⅱ Ag/H 柱及有机相针式滤器的方式进行净化。
2.4 线性范围与检出限
在优化条件下,分析草酸质量浓度为0.050、0.10、0.50、1.00、2.00、5.00、10.00 mg/L 的标准溶液,以草酸的质量浓度x(mg/L)对峰面积y建立标准工作曲线,得到草酸线性方程为y=0.4550x+0.0281,相关系数r2=0.9998。
以样品进样量100 μL,将产生3 倍于噪音水平的信号所代表的待测组分的最小浓度来计算检出限,将产生10 倍于噪音水平的信号所代表的待测组分的最小浓度来计算定量限。根据本文研究,草酸的检出限分别为小龙虾0.037 mg/kg、河蟹0.038 mg/kg、青蟹0.041 mg/kg、明虾0.033 mg/kg;草酸的定量限分别为小龙虾0.12 mg/kg、河蟹0.13 mg/kg、青蟹0.14 mg/kg、明虾0.11 mg/kg。实验数据表明,检验方法准确灵敏,符合检测要求。
2.5 方法回收率与精密度
为验证方法的准确度,按本文方法对甲壳类水产样品(小龙虾、河蟹、青蟹、明虾)和超纯水进行了1.00、10.00、25.00 mg/kg,3 个水平的加标回收实验(n=6);采用中间添加水平(10.0 mg/kg)的样品连续测定5 d,考察方法的日间精密度,扣除相应本底值后,实验结果见表2,甲壳类水产样品基质中草酸的平均回收率为75.71%~88.85%,日内相对标准偏差(RSD,n=6)在1.74%~3.61%之间,日间精密度在2.11%~2.75%之间。超纯水的平均回收率为96.35%~98.02%,日内相对标准偏差(RSD,n=6)在1.73%~2.02%之间,日间精密度为1.83%。方法显示了良好的准确性和重现性,且在前处理过程对草酸含量的损失较低。
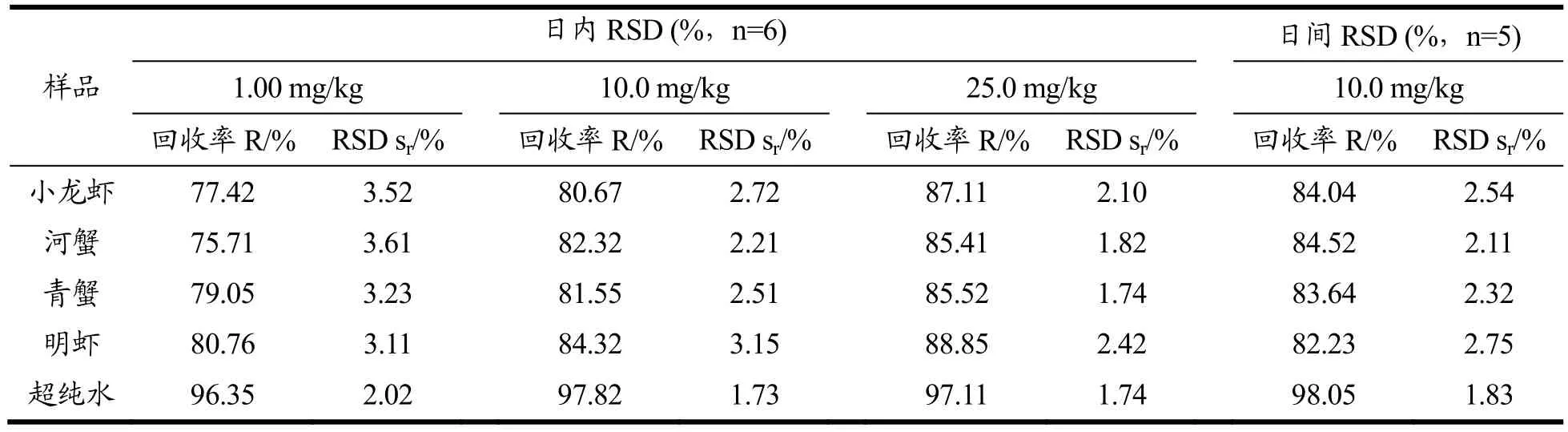
表2 甲壳类水产样品和超纯水中草酸的加标回收率及精密度Table 2 Recoveries and precisions for oxalic acid in crustacean aquatic products and water
2.6 实际样品的测定
随机购买市场上10 个销售摊点的样品,采用本文方法对买回来的甲壳类水产样品:小龙虾、河蟹、青蟹、明虾进行分析,结果显示所有样品均有检出草酸,结果见表3,其中甲壳类海水产样品含量较低,青蟹分布在5.97~32.02 mg/kg 之间;明虾分布在4.05~28.01 mg/kg 之间。甲壳类淡水产样品含量较高,小龙虾分布在40.86~88.73 mg/kg 之间;河蟹分布在28.90~57.85 mg/kg 之间。图5 为其中一个阳性小龙虾样品的离子色谱图,检出草酸含量为45.66 mg/kg。
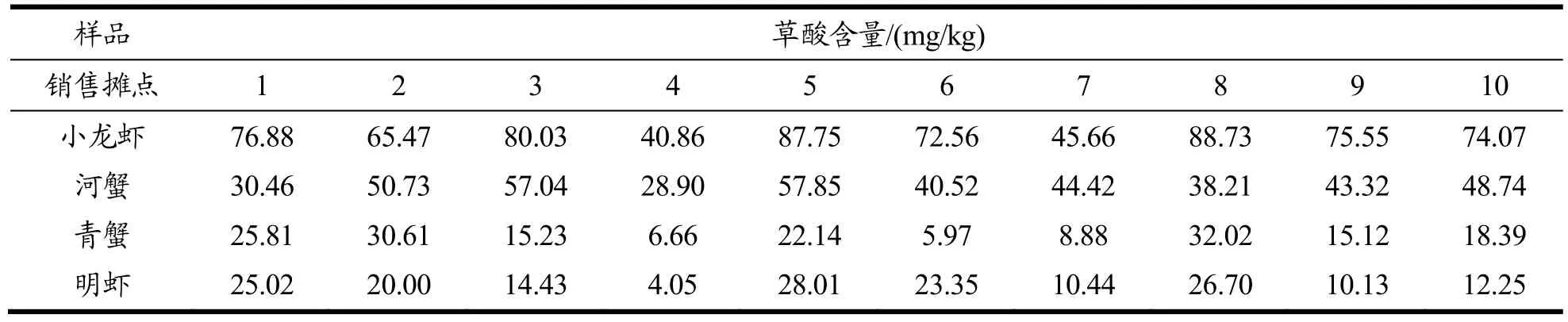
表3 甲壳类水产样品中草酸的含量范围Table 3 Content range of oxalic acid in crustacean aquatic products
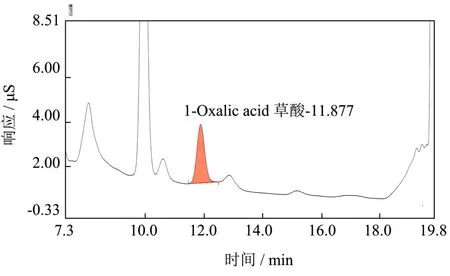
图5 小龙虾草酸阳性样品的离子色谱图Fig.5 Ion chromatogram of a oxalic acid positive crayfish sample
2.7 甲壳类水产品中草酸的来源分析
本文将部分小龙虾、河蟹、青蟹、明虾用超纯水洗刷5 次,浸泡超声10 min 并更换超纯水5 次,然后按照2.2 步骤进行制样和处理,测定水洗前后甲壳类水产品草酸的含量变化,结果见表3。从表3 的结果数据可见,用纯水清洗后甲壳类水产品草酸残留量明显降低,这说明有一部分草酸残留在甲壳类水产品的体表。
为了进一步了解草酸在甲壳类水产样品不同部位的残留情况,本文将甲壳类水产样品按照肌肉、内脏、外壳分别放入料理机粉碎机均质,充分混匀,按照优化后的提取净化步骤进行前处理,检测甲壳类水产样品不同部位草酸的残留量范围,结果见表4。从表4的结果数据可知,在甲壳类水产样品各个部位中,内脏草酸含量最高,外壳次之,肌肉最低。

表4 水洗前后及不同部位甲壳类水产样品中草酸的含量范围Table 4 Content range of oxalic acid in crustacean aquatic products before and after washing and products from different parts
根据相关文献研究可知[25-26],甲壳类水产样品体内的草酸可分为外源性草酸和内源性草酸[27],无论是外源性草酸还是内源性草酸,最终均会富集在其内脏中,所以其内脏的草酸残留最高。王阳葆经过研究[28]发现,甲壳质对阴离子具有吸附作用,因此甲壳类水产样品外壳的草酸残留量高于其肌肉部分。
商贩使用“洗虾粉”对甲壳类水产品进行清洗时,因其见效快,一般浸泡时间较短,草酸来不及进入甲壳类水产样品体内,因此,认为来源于“洗虾粉”的草酸主要附着在甲壳类水产品表面。此外,甲壳类水产品中体表残留的草酸还有可能来自养殖土壤[29]、水体[30]、外部大气环境中的污染物[31-32]等。本文购买样品时已确认,所有样品均未使用“洗虾粉”进行清洗,根据表3 实验结果可知,甲壳类水产样品体表来源于土壤、水体、大气污染的草酸含量为5.20~8.65 mg/kg。
3 结论
3.1 本文建立了一种快速提取、固相萃取净化结合离子色谱测定的甲壳类水产品中草酸残留量分析方法。样品经超纯水提取、乙腈沉淀杂质、固相萃取柱柱净化,样液中的草酸通过AS11-HC 色谱柱分离,电导检测器检测。与已有离子色谱法相比,本文研究了更多类型甲壳类水产品的草酸残留情况,并对样品中草酸的来源进行了分析。检测结果发现,本文购入的甲壳类水产品均检出草酸残留,结果在4.05~88.73 mg/kg之间;水产品各个部位的草酸残留情况为内脏>外壳>肌肉;经过分析认为样品中草酸来源于消化系统的摄入富集和体外环境附着。
3.2 本方法具有良好的净化效果、准确的定性定量以及高效快捷的特点,适用于甲壳类水产品中草酸残留的快速确认和含量分析。本方法的建立和使用为食品安全实施监督管理提供科学依据,相关实验数据对政府部门监管“洗虾粉”滥用及甲壳类水产品的食品质量安全具有重要意义。

