康莱特注射液联合调强适形放疗同步TP 化疗治疗局部晚期非小细胞肺癌临床观察*
杨立鑫,李丹青,乔志安,王晓贞△,郝 倩
(1.河北省邢台市人民医院放疗科,河北 邢台 054000;2.河北省邢台市第二医院结核二科,河北 邢台 054000)
非小细胞肺癌(NSCLC)主要包括鳞状细胞癌(简称 鳞癌)、腺癌和大细胞癌,约占全部肺癌的85%,在就诊时已达Ⅲ期(局部晚期)NSCLC 患者约占所有NSCLC 患者的30%,其中绝大部分错过了最佳手术时机,根治性同步放射治疗、化学治疗(简称放化疗)是其标准治疗模式。调强适形放射治疗(IMRT,简称调强放疗),可减少毒性、提高疗效,是局部晚期NSCLC(LA-NSCLC)放疗的首选疗法[1-2]。LA-NSCLC 同步放化疗中常用化疗方案以紫杉醇联合顺铂(TP)等含铂类方案为主[3],同步放化疗虽能提高疗效,但毒副作用也较大,可导致患者的耐受性下降,故筛选增效减毒的同步放化疗联合用药十分重要。有研究显示,中医药联合同步放化疗在发挥良好协同抗肿瘤效应的同时,能减轻放化疗毒副反应[4]。康莱特注射液有益气养阴、消散结之功效,适用于不宜手术的原发性NSCLC 所致气阴两虚、脾虚湿困证。康莱特注射液对肺癌模型小鼠肿瘤生长有一定抑制作用,对顺铂、5-氟尿嘧啶等化疗药物引起的白细胞减少和肝肾功能损伤亦有抑制作用,还能提高自然杀伤细胞的活性,诱导脾淋巴细胞增殖,增强巨噬细胞吞噬功能,且具有镇痛效果[5]。康莱特注射液作为国家二类抗癌新药,其配合放化疗具有增效减毒作用[6-8]。本研究中观察了康莱特注射液联合调强放疗同步TP 化疗治疗LA-NSCLC 的临床疗效。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:满足《中国原发性肺癌诊疗规范(2015 年版)》LA-NSCLC 的西医诊断标准[9],临床TNM 分期(第8 版)为ⅢA期、ⅢB期,ⅢC期[9],同时符合LA-NSCLC气阴两虚证、脾虚湿困证的中医诊断标准[10];年龄18~75 岁;美国东部肿瘤协作组体力状况评分为0~2 分。本研究经医院医学伦理委员会批准,患者签署知情同意书。
排除标准:合并重要脏器功能障碍、活动性感染或周围神经系统疾病(肿瘤侵犯除外);预计生存时间短于3 个月;既往有胸部放射治疗史;正参加其他临床试验;有其他恶性肿瘤病史。
病例选择与分组:选取邢台市人民医院2017 年10 月至2019 年10 月收治的LA-NSCLC 患者90 例,采用随机数字表法分为观察组和对照组,各45 例。两组患者一般资料比较,差异无统计学意义(P >0.05),具有可比性。详见表1。
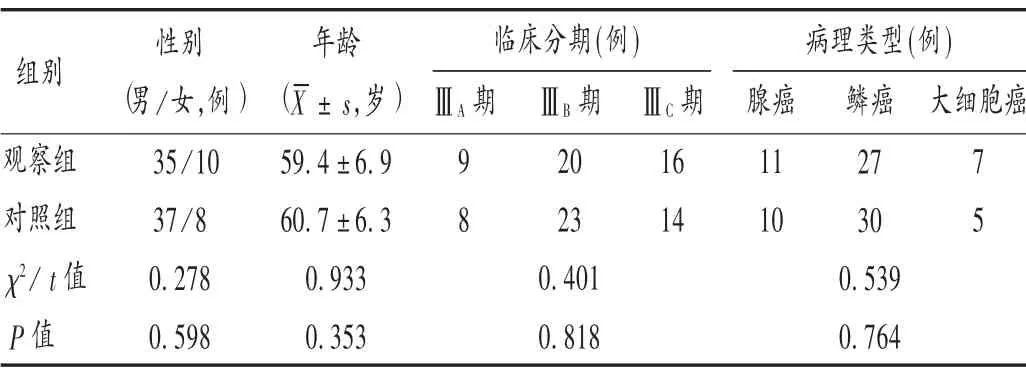
表1 两组患者一般资料比较(n =45)Tab.1 Comparison of the patients′ general data between the two groups(n =45)
1.2 方法
两组患者均予常规治疗和IMRT 同步TP 方案化疗。对患者行CT 增强扫描,所获图像信息进行三维重建;根据CT 图像勾画出大体肿瘤靶区(GTV)和转移淋巴 结、临 床 靶 区(CTV)、CTV 外 放5 mm 计 划 靶 区(PTV),食管、正常肺组织、心脏等危及器官组织;设计逆向IMRT 计划,采用6MV X 射线直线加速器进行全程IMRT,处方剂量为60 Gy,常规分割,每次2 Gy,每周5 次,放疗期间复核体位;危及器官剂量限制为食管平均剂量(Dmean)≤34 Gy、最大剂量(Dmax)≤105%处方剂量,平均肺剂量≤18 Gy,双肺V5≤60%、V20≤30%,心脏Dmean≤26 Gy、V40≤80%、V45≤60%,脊髓Dmax≤50 Gy,其中Vx即X Gy 等剂量曲线所包绕的靶区体积。紫杉醇注射液(海口奇力制药股份有限公司,国药准字H20063169,批号分别为20170705,20181103,规格为每瓶5 mL ∶30 mg)45 mg/m2;注射用顺铂(锦州九泰药业有限责任公司,国药准字H21020213,批号分别为20170709,20181004,规格为每支10 mg)25 mg/m2,均于每周第1 天静脉滴注,每周1 次。观察组患者加用康莱特注射液(浙江康莱特药业有限公司,国药准字Z10970091,批号分别为20170803,20180905,规格为每瓶100 mL ∶10 g)静脉滴注,每次100 mL,每天1 次。两组均以3 周为1 个疗程,连续治疗2 个疗程。
1.3 观察指标及疗效判定标准
观察指标:采用电化学发光法检测血清癌胚抗原(CEA)、细胞角蛋白19 片段抗原21-1(CYFRA21-1)和鳞状上皮细胞癌抗原(SCC)水平;采用卡氏功能状态量表(KPS)[11]评估患者的生存质量状况,按治疗前后KPS 评分变化分为提高改善(治疗后KPS 评分增加≥10 分)、稳定(评分增加或减少<10 分)和降低(评分减少≥10 分)3 个等级。采用Epics-XL-Ⅱ型流式细胞仪(美国Beckman Coulter 公司)检测两组患者的外周血T淋巴细胞亚群(CD3+,CD4+,CD8+)水平和CD4+/CD8+。
疗效判定[12]:完全缓解(CR),所有靶病灶消失,全部病理淋巴结短直径须缩短至<10 mm;部分缓解(PR),靶病灶直径之和至少减少30%;疾病进展(PD),靶病灶直径和至少增加20%(或增加5 mm);疾病稳定(SD),靶病灶直径和介于增加20%与减少30%之间。客观缓解(OR)=CR+PR,临床获益(CB)=CR+PR+SD。
安全性[13-14]:观察患者白细胞减少、血小板减少、胃肠道反应、放射性食管炎、放射性肺炎等不良反应发生情况。
1.4 统计学处理
采用SPSS 21.0 统计学软件分析。计数资料以率(%)表示,行χ2检验;等级资料行Wilcoxon 秩和检验;计量资料以± s 表示,两两比较行配对样本(组内)或独立样本(组间)t 检验,多组数据比较行单因素方差分析。P <0.05 为差异有统计学意义。
2 结果
结果见表2 至表6,对照组2 例因4 级白细胞减少而停止治疗。观察组3 级及以上不良反应发生率为13.33%,显著低于对照组的40.00%(P =0.004 <0.05)。
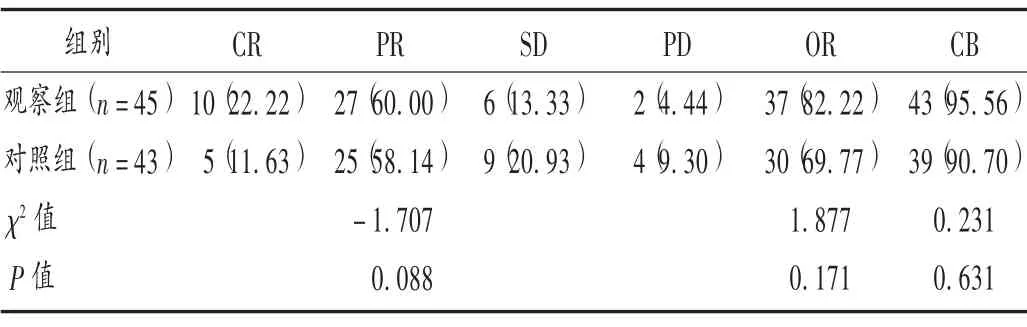
表2 两组患者临床疗效比较[例(%)]Tab.2 Comparison of clinical efficacy between the two groups[case(%)]
表3 两组患者血清肿瘤标志物水平比较(± s,ng/mL)Tab.3 Comparison of serum tumor markers levels between the two groups(± s,ng/mL)

表3 两组患者血清肿瘤标志物水平比较(± s,ng/mL)Tab.3 Comparison of serum tumor markers levels between the two groups(± s,ng/mL)
注:与本组治疗前比较,*P <0.05;表5 同。与对照组治疗后比较,#P <0.05。Note:Compared with those before treatment,* P <0.05,as well as Tab.5.Compared with those in the control group,#P <0.05.

表4 两组患者KPS 评分等级比较[例(%)]Tab.4 Comparison of KPS scores between the two groups[case(%)]
表5 两组患者外周血T 淋巴细胞亚群水平比较(± s)Tab.5 Comparison of peripheral blood T lymphocyte subsets between the two groups(± s)

表5 两组患者外周血T 淋巴细胞亚群水平比较(± s)Tab.5 Comparison of peripheral blood T lymphocyte subsets between the two groups(± s)
注:与本组治疗3 周后比较,△P <0.05。Note:Compared with those after three weeks of treatment,△P <0.05.

表6 两组患者不良反应发生情况比较(例,n =45)Tab.6 Comparison of incidence of adverse reactions between the two groups[case,n =45]
3 讨论
放疗是NSCLC 三大治疗手段之一,临床实践中约70% NSCLC 患者在治疗过程中需要接受放疗。IMRT 是以传统的三维适形放疗(3DCRT)为基础,配合放疗设备和计算机手段产生的放疗技术,能使高能射线束的分布在影像系统引导定位下始终与肿瘤形态在三维方向上几乎保持一致,并能按临床要求调整射野内各点的输出剂量,在最大限度地提高局部肿瘤剂量的前提下,使其周围正常组织器官的耐受剂量控制在可接受的水平内,最终达到提高疗效、减少毒性的目的。CHUN 等[15]的研究表明,采用IMRT 与3DCRT 治疗LA-NSCLC 的总体疗效相当,但前者可明显降低患者高级别放射性肺炎的发生风险及减少心脏 Dmean,推荐将IMRT 作为LA-NSCLC 放疗的常规手段。紫杉醇为周期特异性抗肿瘤药,其作用途径独特,是通过与小管的β 位特异性结合,来抑制微管网正常的动态重组,从而发挥广谱抗肿瘤效应。顺铂为周期非特异性抗肿瘤药物,主要作用于细胞S 期,与紫杉醇联用有协同抗肿瘤作用。同时,紫杉醇还可通过诱导肿瘤细胞凋亡、阻滞细胞于G2/M期、促进乏氧细胞再氧合等途径,发挥放疗增敏作用。
中医药对放化疗具有减毒增效作用,LA-NSCLC属中医学“肺积”“息贲”等范畴[16]。中医认为,气阴两虚、脾虚湿困为LA-NSCLC 的常见病因病机。康莱特注射液系从传统中药薏苡仁中经超临界二氧化碳萃取等现代制药技术精制而成的静脉乳剂,有益气养阴、健脾渗湿、消症散结等功效,正切中LA-NSCLC 气阴两虚、脾虚湿困证之中医病机要点。药理研究表明,康莱特注射液可能通过诱导肿瘤细胞凋亡,下调环氧合酶-2(COX-2)表达,提高肿瘤细胞对放化疗的敏感性,抑制肿瘤新生血管形成和肿瘤生长,增强机体免疫力,良性调控促癌/抑癌生长基因表达等多个途径,发挥广谱抗癌活性[17]。此外,有研究指出,薏苡仁油酯可联合放化疗提高对肺癌的疗效,并能减轻放化疗的毒副作用[18]。
本研究结果显示,对照组患者的客观缓解率(ORR)、临床获益率(CBR)分别为69.77%和90.70%,与王宝强等[19]报道的结果相近。两组患者的CBR 均较高,但组间对比无显著差异,表明采取IMRT 同步TP 化疗能获得较高的CBR,在此基础上加用康莱特注射液治疗对于进一步提高CBR 并无显著帮助。观察组患者的ORR 高于对照组,总体疗效优于对照组,但均无显著差异,这可能与本研究样本量较少有关。文献[20]报道,肿瘤标志物CEA,CYFRA21-1,SCC 可作为LANSCLC 临床疗效评价的可靠指标。本研究中,观察组患者治疗后的血清CEA、CYFRA21-1 和SCC 水平的降低及KPS 评分的改善均更明显,说明在IMRT 同步TP 化疗治疗基础上加用康莱特注射液治疗具有明显的增效作用。究其原因,可能与康莱特注射液具有放化疗增敏效应或和该同步放化疗方案具有协同抗肿瘤作用有关。
本研究中,对照组的不良反应主要分为血液学和非血液学毒性反应两大类,前者以白细胞、血小板减少为主,后者以胃肠道反应、放射性食管炎和肺炎为主,且多为0~2 级,这与李爱科等[21]的研究结果基本一致。同时,本研究中对照组有2 例患者因4 级白细胞减少而停止治疗,观察组未发生此类不良反应,提示加用康莱特注射液治疗可能对于提高LA-NSCLC 患者同期放化疗耐受性有积极作用。另外,本研究结果显示,观察组各项治疗相关毒副作用的严重程度和3 级及以上不良反应的发生率均明显低于对照组,说明LA-NSCLC 患者使用康莱特注射液治疗可有效减轻同步放化疗的毒副反应。
在肿瘤免疫中机体免疫功能起着重要作用,尤其是细胞免疫。T 淋巴细胞是体内细胞免疫的效应细胞,在抗肿瘤免疫应答中发挥着中心调控作用。高斌成[22]研究发现,NSCLC 患者处于免疫抑制状态,T 淋巴细胞亚群紊乱(CD3+和CD4+水平及CD4+/CD8+异常降低,而CD8+水平异常升高)程度与临床分期有一定关系,表现为临床分期越高则细胞免疫功能越低。CD3+水平高低能反映T 淋巴细胞总数的变化,CD4+T 淋巴细胞为辅助性T 细胞,能直接杀伤肿瘤细胞,CD8+T 淋巴细胞为抑制性T 细胞,其水平异常升高则反映机体免疫功能降低,CD4+/CD8+比值异常降低则反映细胞免疫功能减弱。本研究结果显示,对照组外周血T 淋巴细胞亚群的失衡程度随治疗时间的延长而加剧,即细胞免疫功能逐渐降低,这与王瑞珩等[23]的研究结果相近,说明IMRT同步TP 化疗能进一步降低LA-NSCLC 患者的细胞免疫功能。康莱特注射液不仅能杀死癌细胞,还可通过促进淋巴细胞增殖、改善T 淋巴细胞免疫功能等方式,提高机体免疫水平[24]。本研究结果显示,随治疗时间的延长,观察组患者的外周血T 淋巴细胞亚群水平变化不明显,说明康莱特注射液的免疫增强作用能有效减轻IMRT 同步TP 化疗所致免疫抑制。
综上所述,康莱特注射液联合调强放疗同步TP 化疗治疗LA-NSCLC 表现出了良好的减毒增效作用,可改善患者的生存质量,有效避免因同步放化疗所致机体免疫功能降低。

