蛋白组学分析寻常型银屑病患者皮损中的差异表达蛋白
杜军波, 张大雷, 张恒坡, 李静
濮阳市安阳地区医院皮肤科,河南 濮阳 455001
银屑病是一种由遗传、免疫及环境等多种因素共同介导的慢性炎症性皮肤疾病,具体发病机制不清[1]。蛋白质组学是以蛋白质组为研究对象,研究细胞、组织或生物体蛋白质组成及其变化规律的科学,系统探讨蛋白组学的变化能更好地反映复杂疾病的发生机制及其变化规律[2-3]。蛋白质组学近年来在皮肤科领域得到广泛应用[4]。有研究通过蛋白组学技术证实角蛋白类相关蛋白、凝血相关蛋白等多种异常表达蛋白可能与银屑病(血瘀证)的发病机制有关[5]。通过血清蛋白组学技术鉴定出银屑病患者中存在106种差异表达蛋白,涉及血液凝固、炎症、细胞凋亡和血管生成等多种信号通路[6],但关于通过蛋白组学技术对银屑病皮损开展研究的报道较少。因此,本研究通过比较初发型寻常型银屑病患者皮损与正常皮肤组织中的蛋白表达差异,以期为寻常型银屑病的发病机制和靶向治疗提供理论依据。
1 资料与方法
1.1 临床资料
纳入6例于2020年6月—9月在濮阳市安阳地区医院皮肤科就诊的初发寻常型银屑病(psoriasis vulgaris,PV)和6例色素痣患者作为研究对象。PV患者年龄27~33岁,平均(30.29±2.69)岁;PASI评分6~11,平均8.56±1.46;BMI 25~29 kg/m2,平均(27.03±1.52)kg/m2。两组中各4例进行蛋白组学分析(实验组),2例进行验证(验证组)。两组年龄(t=0.543)、BMI(t=0.968)相比较差异无统计学意义(P>0.05)。PV患者纳入标准:①通过组织病理学确诊为PV;②初发型,年龄18岁以上。排除标准:①存在严重肝肾功能不全、血液系统疾病、恶性肿瘤及急慢性感染性疾病等;②合并其他风湿性疾病如系统性红斑狼疮、类风湿性关节炎、白塞病等;③临床资料不完整。色素痣患者纳入标准:①结合病史、皮损特点及术后组织病理学诊断为色素痣;②手术后通过修剪“猫耳朵”等方式获得色素痣皮损周边正常皮肤组织。排除标准:①排除皮脂腺痣、色素性毛表皮痣等;②合并肝肾功能不全、感染性疾病、自身免疫性疾病等。所有研究对象均知情同意且签署知情同意书。研究已通过本院伦理委员会审批。
1.2 方法
1.2.1 生物质谱分析两组蛋白表达差异 活检手术获得PV患者皮损,外科切除后获得色素痣患者周围正常皮肤组织,生理盐水冲洗后置入-80 ℃冰箱中保存待测。取出组织于研磨杯中边加入液氮边研磨成粉末,加入TRIS平衡酚后于离心机下8 000 r/min离心10 min。吸取上清置入新的EP管中并加入0.1 mol/L乙酸铵/甲醇进行沉淀,静置24 h,分别采用甲醇和丙酮进行洗涤1次,采用10 mmol/L的尿素溶液溶解。取各组蛋白溶解液,加入裂解液调整至体积一致,加入二硫苏糖醇调整终浓度为5 mmol/L,再加入碘乙酰胺调整终浓度为11 mmol/L,以1∶50比例加入胰蛋白酶进行胰酶溶解并过夜,再以1∶100比例加入胰蛋白酶,继续酶解4 h。各组胰酶酶解的肽段用Strata X C18(Phenomenex)除盐后真空冷冻干燥,随后以0.5 mol/L TEAB进行溶解肽段,根据串联质谱标签(tandem mass tag,TMT)试剂盒操作说明标记肽段。
各个样品中所获得的肽段用高pH反相HPLC分级,肽段用液相色谱流动相A相(0.1%甲酸和2%乙腈的水溶液)溶解,使用EASY-nLC 1000超高效液相系统中的流动相B(0.1%甲酸和90%乙腈的水溶液)进行分离。肽段分离后被注入NSI离子源中进行电离,采用QE plus质谱进行分析。
1.2.2 生物信息学分析 两组间差异表达蛋白采用费歇尔精确双端检验方法(Fisher’s exact test),以P-value小于0.05且差异倍数为1.3倍为差异具有统计学意义,将蛋白组学中所有的差异蛋白进行GO分类富集及KEGG通路富集分析。
所有差异蛋白通过STRING在线软件进行蛋白互作网络(protein-protein internaction network,PPI)分析,参数最低设置为0.400。
1.2.3 Western blot验证 将PV组织及正常皮肤组织分别置于消毒后的研钵中,边加入液氮边研磨成粉末,收集所有粉末移入EP管,加入500 μL RIPA裂解液,冰上孵育约30 min后离心,吸管吸取上清液于-80 ℃冰箱中保存。取5 μL蛋白样品进行电泳、电转、牛奶封闭,分别加入一抗S100A7(1∶200,上海雅吉生物科技有限公司,中国)、S100A9(1∶400,abcam公司,美国)、cathepsin B(1∶500,abcam公司,美国)、haptoglobin(1∶500,abcam公司,美国)、arginase-1(1∶100,R&D公司,美国)和β-actin(1∶1 000,万类生物科技有限公司,中国)并4 ℃孵育过夜,洗膜后加入二抗(1∶1 000)孵育1 h。每个条带的蛋白灰度值采用Image J软件检测。组织中目标蛋白相对表达水平=目标蛋白的灰度值/β-actin灰度值,重复测量3次,取平均值。
1.3 统计学处理
应用GraphPad Prism 5.0软件进行数据分析,两组间蛋白表达水平的比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 PV患者皮损中的差异表达蛋白
研究中共匹配到的肽段有70 945个,最终匹配到的蛋白有4 990个,进行定量分析的有4 720个(图1)。火山图(图2)显示,相对于正常组织而言,银屑病皮损中发生显著改变的蛋白共有454个,其中上调的蛋白有291个,下调的蛋白有163个。
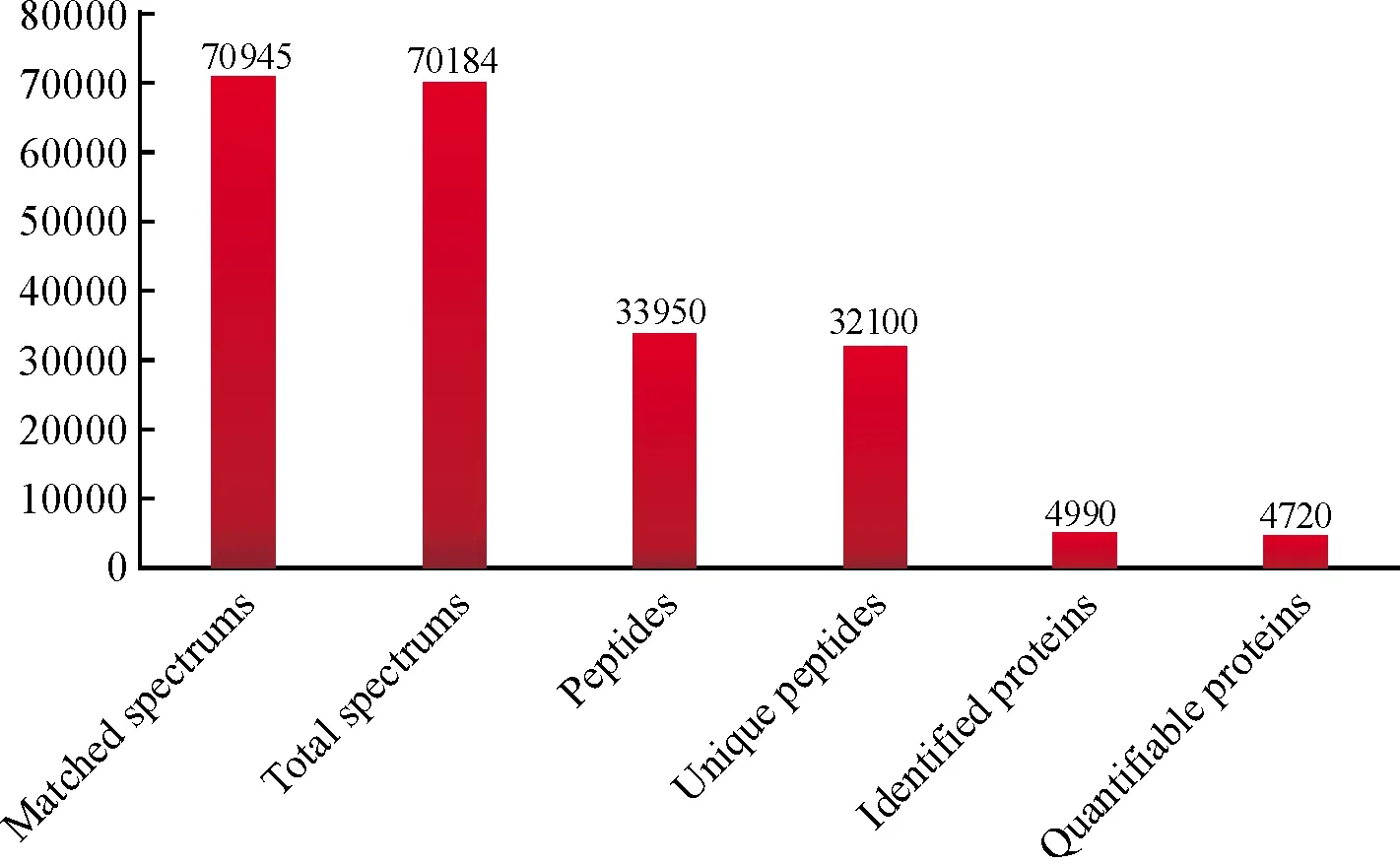
图1 蛋白组学中鉴定到的蛋白基本信息

图2 寻常型银屑病患者皮损中的差异表达蛋白
2.2 GO富集分析和KEGG富集分析
对发生显著改变的454个蛋白进行GO富集分析和KEGG富集分析,结果显示,在GO富集分析中,涉及的生物学过程主要为中性粒细胞活化、中性粒细胞介导的免疫、TNF-α介导的信号通路、B细胞介导的免疫、上皮细胞分化及角质化。KEGG富集分析发现,寻常型银屑病发病机制可能涉及到IL-17信号通路、氧化磷酸化、PPAR信号通路等(图3、图4)。

图3 差异表达蛋白的GO富集分析
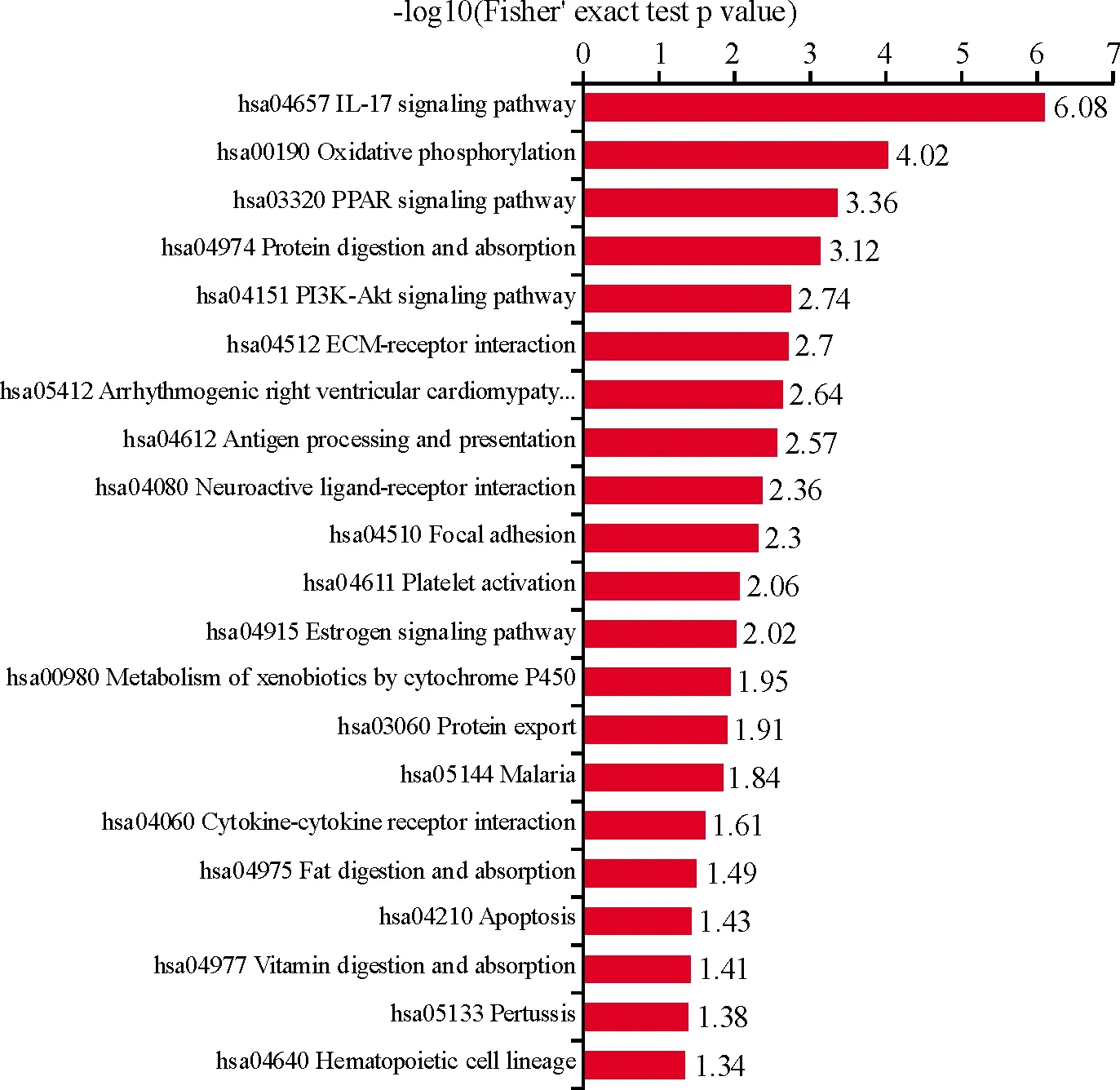
图4 差异表达蛋白的KEGG富集分析
2.3 PPI分析
PPI结果发现,蛋白与蛋白相互作用值超过0.400的差异蛋白共372个,进一步对这些差异蛋白进行GO和KEGG富集分析,结果显示差异蛋白主要涉及的生物学进程及通路主要与炎症、角化过度及IL-17介导的信号通路、表皮细胞分化等有关。差异蛋白分别与图2中GO富集分析中的生物学进程中前3种(中性粒细胞活化、中性粒细胞介导的免疫、TNF-α介导的信号通路)及KEGG信号通路中的前3种(IL-17信号通路、氧化磷酸化、PPAR信号通路)进行匹配分析,共匹配出12个蛋白(表1),提示这12个蛋白可能在寻常型银屑病的发病机制中扮演了重要作用。

表1 12种核心蛋白的基本信息
2.4 Western blot验证
对S100A7、S100A9、cathepsin B、haptoglobin和arginase-1共5个蛋白在初发寻常型银屑病患者皮损中的表达进行Western blot验证,结果显示,银屑病患者皮损中S100A7(t=5.54,P<0.05)、S100A9(t=45.23,P<0.05)、cathepsin B(t=4.23,P<0.05)、haptoglobin(t=4.12,P<0.05)和arginase-1(t=6.65,P<0.05)蛋白表达水平较正常皮肤组织升高(图5)。
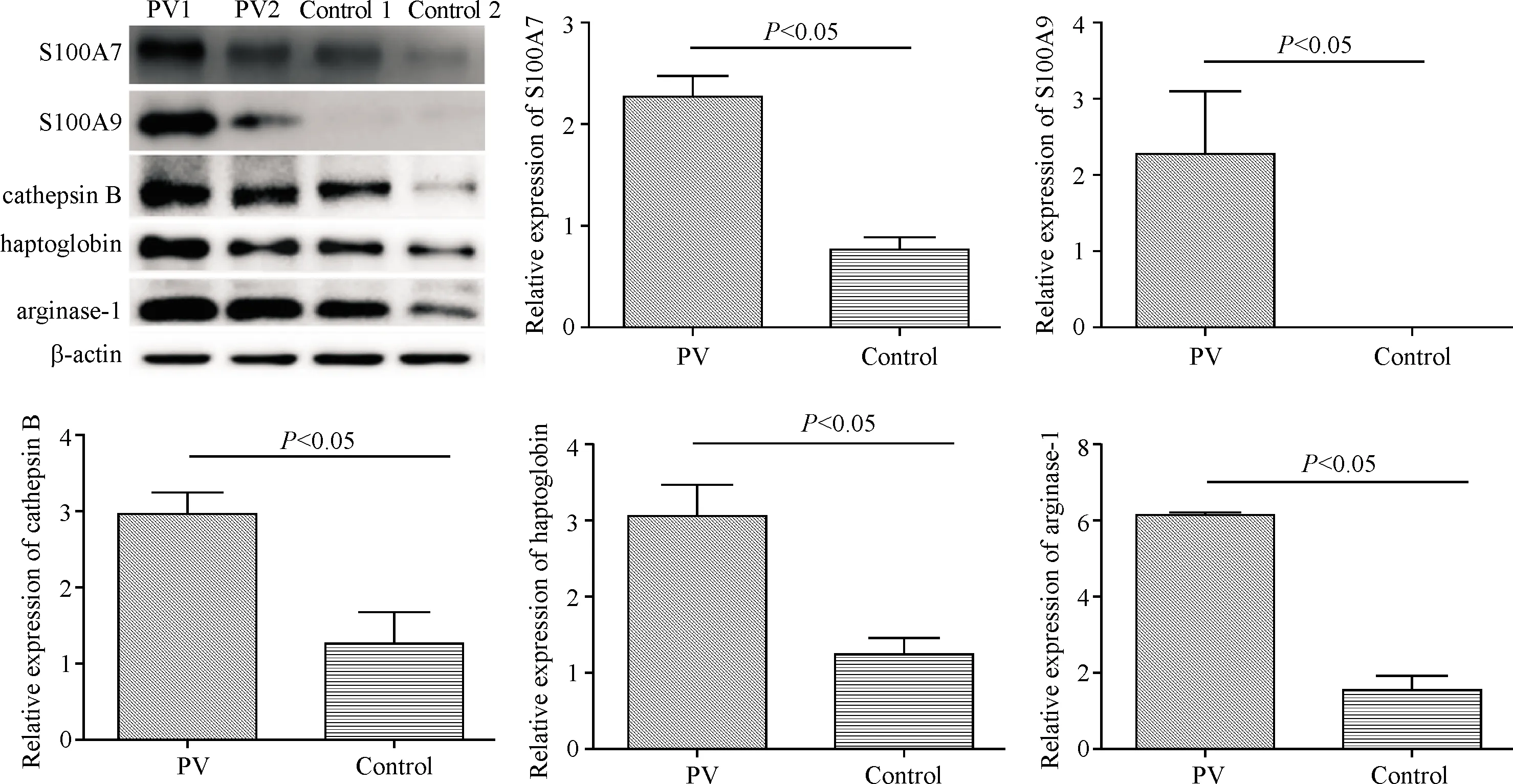
图5 S100A7、S100A9、cathepsin B、haptoglobin和arginase-1蛋白表达水平的Western blot验证
3 讨论
银屑病发病机制复杂,尽管遗传因素在一定程度上解释了某些基因位点易感性与银屑病发病相关[7],但目前大多数研究认为,除了遗传因素外,免疫炎症,尤其是多种信号通路和炎症介质在银屑病的发病机制中扮演了重要作用[8]。TMT是一种多肽体外等重同位素标记的相对与绝对定量技术,采用6、10及16种同位素的标签,通过特异性标记多肽的氨基基团,经高分辨质谱仪串联分析,可同时比较多达16种样品之间的蛋白质表达量,是定量蛋白质组学中经典的高通量筛选技术[9]。
本研究采用TMT标记的蛋白组学技术对银屑病皮损中的差异蛋白进行研究,结果发现,银屑病皮损中上调的蛋白有291个,下调的蛋白有163个。GO富集分析后证实,这些差异蛋白涉及的生物学过程与中性粒细胞活化、中性粒细胞介导的免疫等有关,这可能与银屑病典型的病理特征之一有关,即大量中性粒细胞在表皮聚集所致的Munro微脓肿或Kogoj微脓疡。中性粒细胞也能分泌多种炎症介质(如IL-6、TNF-α等)进一步参与并促进银屑病皮损中的慢性炎症状态[10]。此外,GO富集分析发现生物学过程中还涉及到上皮细胞分化及角质化,可能与银屑病皮损快速增殖及斑块形成这一表型有关。KEGG富集分析发现前三种为IL-17信号通路、氧化磷酸化、PPAR信号通路。IL-17家族因子在银屑病的发病机制中作用较为显著,尤其是IL-23/IL-17轴在银屑病发病过程中起着重要作用,IL-17A属于Th17细胞分泌的主要细胞因子之一,可与TNF-α协同诱导内皮细胞上的粘附分子和趋化因子高表达,促进银屑病的炎症发展[11]。IL-17也可促进角质形成细胞的过度增殖及中性粒细胞、肥大细胞等活化,从而进一步加重局部的炎症反应[12]。蛋白经过修饰后在银屑病发病机制中发挥重要作用,其中磷酸化水平最为常见,部分蛋白如STAT3经过磷酸化修饰后在银屑病皮损中表达上调,而其非磷酸化水平的表达与正常皮肤组织无差异,通过抑制STAT3的磷酸化修饰后可降低银屑病样皮损的严重程度[13]。Tyr705和Ser727是STAT3两个磷酸化位点,当被激活后可促进STAT3的表达升高[14]。PPAR是调节脂质、葡萄糖和氨基酸代谢的核受体超家族的成员,PPAR和相应的配体在皮肤和其他器官中具有重要的细胞调节功能,包括细胞增殖和分化以及炎症反应[15]。
GO和KEGG富集分析结果显示多种信号通路均参与了银屑病的免疫学发病机制及病理生理过程,PPI分析后显示372个差异蛋白可能是银屑病发病机制的重要蛋白,结合GO富集分析及KEGG富集分析结果,筛选出17种核心蛋白,涉及IL-17信号通路、中性粒细胞活化、氧化磷酸化、PPAR信号通路、中性粒细胞介导的免疫、PPAR信号通路、TNF-α介导的信号通路等,提示这些通路可能与银屑病的发病机制密切相关。
对其中S100A7、S100A9、cathepsin B、haptoglobin和arginase-1 5种蛋白进行验证,结果显示,银屑病患者皮损中该5种蛋白表达水平均升高。S100A7和S100A9均属于S100家族中的主要成员,参与银屑病的炎症反应、角质形成细胞过度增殖等过程[16],其中S100A9属于银屑病的一种标志蛋白[17]。cathepsin B也称之为组织蛋白酶 B,目前研究最为广泛的属于cathepsin G。cathepsin G可活化多种炎症因子如IL-33、IL-1α、IL-36等促炎因子参与银屑病的炎症反应[15],而cathepsin B失活后可减轻IL-17A诱导的角质形成细胞过度增殖、炎症反应现象,同时也可减轻角质形成细胞的分化[18]。haptoglobin属于一种急性蛋白,主要由肝脏合成,也可由角质形成细胞合成,在银屑病患者皮损中haptoglobin表达水平升高[19]。arginase-1是鸟氨酸循环代谢的关键酶,在银屑病皮损中同样高表达[20],但目前尚缺少有关两种蛋白对银屑病发生发展影响机制的研究。本研究结果显示haptoglobin和arginase-1两种蛋白可能与中性粒细胞介导的免疫有关,为下一步对这两种蛋白进行研究提供了思路。
综上所述,银屑病发病机制较为复杂。本研究采用蛋白组学技术证实多种免疫信号通路及差异表达蛋白可能在银屑病的发病机制中扮演了重要作用,为下一步研究提供了新思路。然而,本研究纳入样本量较少,未对核心蛋白进行功能学分析,需在日后进一步研究。

