影响核桃粕蛋白溶出率的提取条件
刘猛,李祥,樊凤娇
1. 吕梁学院生命科学系(吕梁 033000);2. 山西省特色植物功能成分工程研究中心(吕梁 033000);3. 南京财经大学食品科学与工程学院(南京 210023)
现代科学研究表明,核桃对人的颅脑神经具有很好的保健功能。一直以来,人们由于只重视其健康价值和核桃油方面的研究,而忽略在脱脂核桃蛋白的利用率等方面的研究[1]。由于核桃富含多种矿物质元素,具有丰富的营养价值,可以起到增强大脑记忆力的作用[2]。我国核桃产量最近几年也一直呈线性增长趋势,关于核桃产品的研发与利用逐渐成为市场和企业热点[3]。珠娜等[4]、余永婷等[5]、刘刚等[6]对于核桃蛋白以及相关蛋白开展深入研究;在国内关于核桃蛋白质研究方面的报道比较少,尤其是对核桃蛋白功能研究方面更是罕见[7]。Gu等[8]、Xu等[9]对核桃蛋白肽对于人和动物生命活动开展深入研究。核桃蛋白中有大量的谷蛋白,脱脂核桃粉可用于啤酒酵母发酵[10],溶解性极差,一般采用高速剪切进行处理核桃[11],因此很难将核桃相关产品应用于在乳饮料中[12]。核桃蛋白功能特性方面的研究,在对蛋白质溶解度的探究方面相对集中[13]。由此,试验探究不同加工条件下核桃蛋白质溶出率变化,对核桃蛋白的加工与应用提供技术支撑[14]。核桃乳饮料[15]中含有适量维生素、蛋白质、烟酸和其他微量元素,并且含有核桃独有的产品风味[16]。经常食用核桃相关产品,可以增强体魄、滋补颅脑神经、提高免疫能力[17]。与其他饮料相比,对铁、钙吸收较差的人群有较理想的改善效果[18]。
这几年,关于核桃分离蛋白特性的研究较多,核桃浓缩蛋白和分离蛋白产品没有产业化、模式化,核桃蛋白分离纯化,通常使用酸沉碱提法或者联用一些辅助设备进行蛋白提取[19]。由于一些壳和皮没有被去除干净,因此榨取核桃油时,使获得的核桃粕中带有杂质,从而影响到蛋白质的结构及一些功能特性,而且提取率偏低,有比较严重的蛋白损失和浪费[20]。然而,有尚未应用于核桃蛋白的制备方法如基于乙醇浸渍法浓缩的蛋白质[21],其未使用的主要原因是核桃油和蛋白质的利用率不能形成产业链,导致一定杂物残留,乙醇浸渍法的应用因核桃皮被限制[22]。核桃蛋白作为一种优质的植物蛋白资源,使核桃蛋白在工业生产和新产品的研发中,为社会创造更多的价值[23]。
试验为探究核桃蛋白质溶出率的影响因素,设置不同加工条件,采用单因素试验法,结合正交试验分析,得出酸沉碱提法分离蛋白的最佳加工条件,为扩大核桃分离蛋白在食品行业的应用,支撑核桃饮料及其核桃功能产品研发。
1 材料与方法
1.1 试验材料及试剂
核桃饼粕;石油醚(分析纯,北京宏宇化学试剂公司);硫酸铜、硫酸钾、硼酸溶液、甲基红-亚甲基蓝指示剂(均为分析纯,上海鸥科蜜化学试剂有限公司);BCA试剂盒(生化试剂,上海碧云天生物科技有限公司)。
1.2 试验仪器与设备
PHBJ-260 pH计(上海东方科学仪器股份有限公司);DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);SC-04离心机(安徽中科中佳科学仪器有限公司);SP21-318C酶标仪(北京中西远大科技有限公司)。
1.3 试验方法
1.3.1 核桃粕的预处理
使用粉碎机把核桃饼粕粉碎至粉末状。
1.3.2 核桃蛋白的分离纯化
采用酸沉碱提法分离纯化核桃蛋白质。工艺流程:称取适量核桃饼粕,以一定比例将其与蒸馏水进行混合,用氢氧化钠溶液进行样品pH调节,设置3 000 r/min离心机转速,进行10 min的离心操作,为调节pH至等电点将上层清液进行加酸操作,再次进行离心,核桃蛋白经沉淀干燥后在下层。
1.3.3 蛋白质含量的测定
通过凯氏定氮法进行核桃总蛋白质含量的测定,蛋白质含量按式(1)计算。
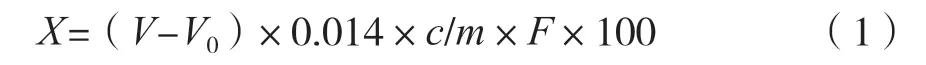
式中:X为食品中蛋白质的含量,g/100 g;V为滴定试样每消耗0.1 mol/L盐酸标准滴定溶液的体积,mL;V0为空白试验时每消耗0.1 mol/L盐酸标准滴定溶液的体积,mL;c为盐酸标准滴定溶液的物质量浓度,mol/L;0.014为1 mL物质的量为1 mol/L盐酸标准滴定溶液等价于氮的质量,g;m为试样的质量,g;F为氮换算为蛋白质的系数,一般为6.25。
1.3.4 二喹啉甲酸(bicinchoninic acid,BCA)测蛋白质浓度[24]
利用BCA蛋白浓度测定试剂盒测定蛋白浓度。
1.4 单因素试验
1.4.1 不同pH条件处理
碱液浸提核桃蛋白过程,通过调节核桃蛋白样品的pH控制体系变量。准确称取2 g核桃饼粕,与蒸馏水以料液比1∶15(g/mL)混合,室温下充分混匀搅拌。调节溶液的pH分别为7.0,8.0,9.0,10.0和11.0,进行60 min的搅拌,进行时长30 min、温度60℃的热处理,以室温为标准冷却,进行提取核桃饼粕蛋白的操作,研究pH对核桃蛋白溶出率的影响。
1.4.2 不同浸提时间处理
碱液浸提核桃蛋白过程中,通过控制核桃蛋白样品的时间控制体系变量。准确称取2 g核桃饼粕,与蒸馏水以料液比1∶15(g/mL)混合,室温下充分混匀搅拌。调节溶液的pH为7.0,分别浸提30,45,60,75和90 min,在60 ℃的温度下进行30 min预处理,以室温为标准进行冷却,提取核桃饼粕蛋白,研究浸提时间对核桃饼粕蛋白溶出率影响情况。
1.4.3 不同浸提温度处理
碱液浸提核桃蛋白过程中,通过控制碱液浸提的温度,来控制体系变量。准确称取2 g核桃饼粕,与蒸馏水以料液比1∶15(g/mL)混合,室温下充分混匀搅拌。调节溶液的pH 7.0为搅拌,搅拌60 min。分别在温度20,40,60,80和100 ℃下热处理30 min,冷却至室温,进行提取核桃饼粕蛋白的操作,研究浸提温度对核桃饼粕蛋白溶出率影响情况。
1.4.4 不同料液比处理
碱液浸提核桃蛋白过程中,改变样品与蒸馏水比例控制体系条件的改变。准确称取2 g核桃饼粕,体系的温度控制在60 ℃,确保浸提时间60 min,pH 7.0,设置5个料液比水平(1∶10,1∶15,1∶20,1∶25和1∶30 g/mL),进行提取核桃饼粕蛋白的操作,研究料液比对核桃饼粕蛋白溶出率的影响情况。
1.4.5 正交试验设计
在单因素试验基础上,以pH、料液比、温度和时间为因素进行四因素三水平正交试验设计,以核桃蛋白质溶出率为指标,对结果进行分析处理。
1.4.6 核桃蛋白质溶出率的计算
将经过不同条件处理的核桃饼粕样品,经过酸沉碱提工艺处理后,将上层清液取出,通过酶标仪法测定可溶性蛋白质的含量,蛋白质溶出率按式(2)计算。

2 结果与分析
2.1 蛋白质总含量的测定
通过凯氏定氮法测定蛋白质的总蛋白质含量,核桃粕中蛋白质含量为70%,与相关文献中所得出的蛋白质含量对比可得出,试验所使用的核桃粕有较高的蛋白质含量
2.2 蛋白质标准曲线
蛋白质标准曲线如图1所示。通过BCA法测定得到的蛋白质浓度标准曲线为y=0.897 37x+0.078 46(R2=0.996 78),蛋白质浓度由回归方程计算。
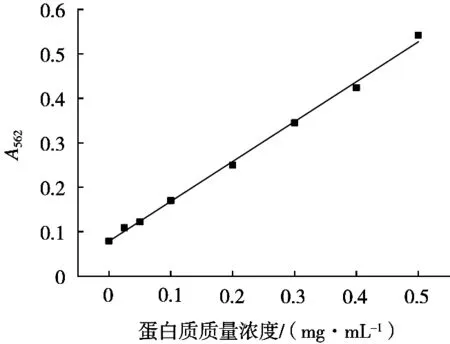
图1 蛋白质标准曲线
2.3 单因素试验结果分析
2.3.1 pH对核桃蛋白质溶出率的影响
由图2可知:随着pH变大,核桃蛋白质溶出率呈现先上升后下降趋势,核桃蛋白质溶出率达到峰值72.25%,此时的pH为10.0;pH 11时,其溶出率为70.12%。因此,选取pH 9.0,10.0和11.0进行正交试验。
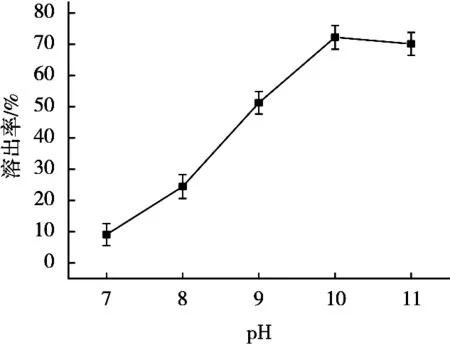
图2 pH对溶出率的影响
2.3.2 浸提时间对核桃蛋白质溶出率的影响
浸提时间对核桃蛋白质溶出率结果的影响曲线图如图3所示。不同时间时,其核桃蛋白质溶出率分别为8.56%,9.08%,9.13%,9.12%和9.11%。随着浸提时间的增加,核桃蛋白溶出率逐渐增加,达到60 min时,增加趋于平缓。所以,选取浸提时间45,60和75 min进行正交试验。
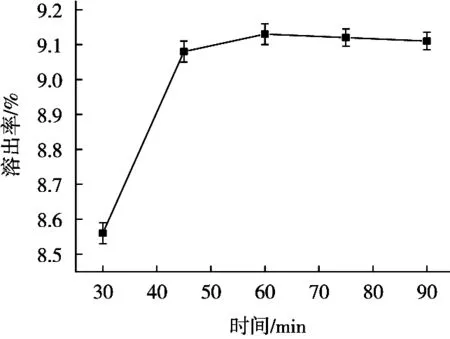
图3 时间对溶出率的影响
2.3.3 温度对核桃蛋白质溶出率的影响
浸提温度对核桃蛋白质溶出率的影响结果曲线图如图4所示。核桃蛋白质在取不同温度时的溶出率分别为6.05%,7.95%,9.08%,8.76%和8.56%。浸提温度达到60 ℃时,核桃蛋白溶出率最高,且随着温度的升高,变化趋于平缓。因此,选取温度40,60和80 ℃进行正交试验。
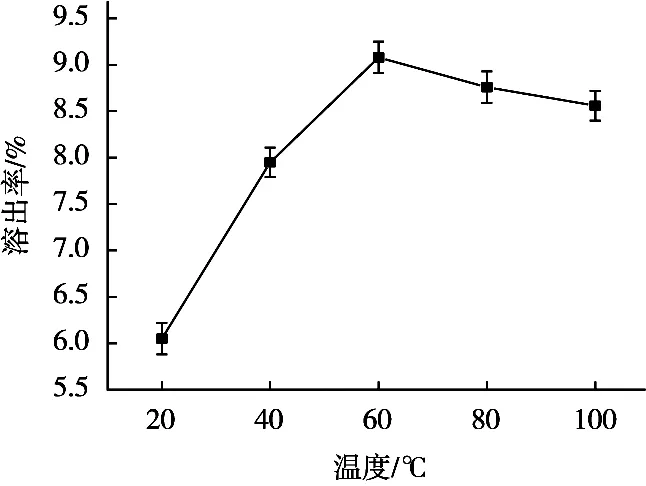
图4 温度对溶出率的影响
2.3.4 料液比对核桃蛋白质溶出率的影响
料液比对核桃蛋白质溶出率的影响结果曲线图如图5所示。核桃蛋白质在取不同料液比时的溶出率分别为8.96%,9.11%,9.08%,9.07%和9.07%。当料液比达到1∶15(g/mL)时,核桃蛋白溶出率达到最大,且随着料液比的继续增加,核桃蛋白溶出率有所下降且趋于平缓。因此在选择正交试验因素水平时,选取的水平为1∶10,1∶15和1∶20(g/mL)。
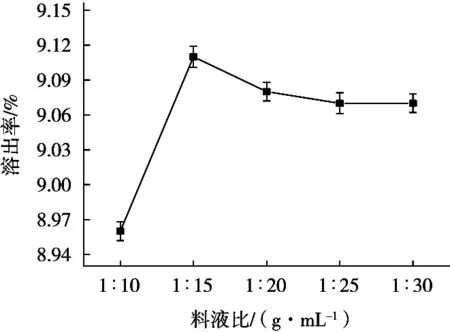
图5 料液比对溶出率的影响
2.4 正交试验结果
通过单因素试验筛选出对核桃蛋白质溶出率的影响较大的4个因素:pH、温度、时间、料液比(分别以A、B、C、D表示)。选取这4个因素为自变量,以蛋白质溶出率为指标,进行四因素三水平正交试验,每个试验因素选取水平见表1,通过试验所得正交试验结果见表2。
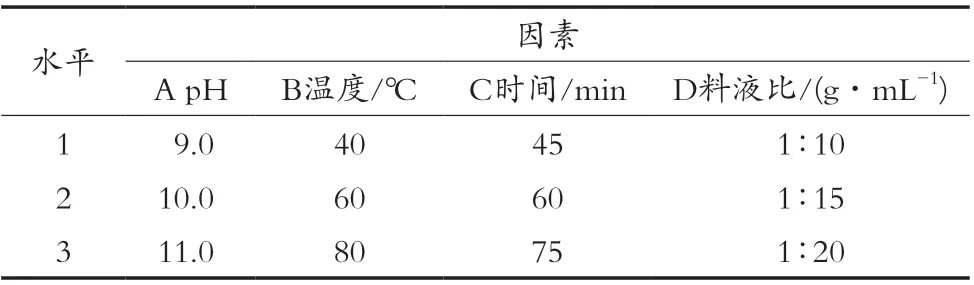
表1 因素与水平表
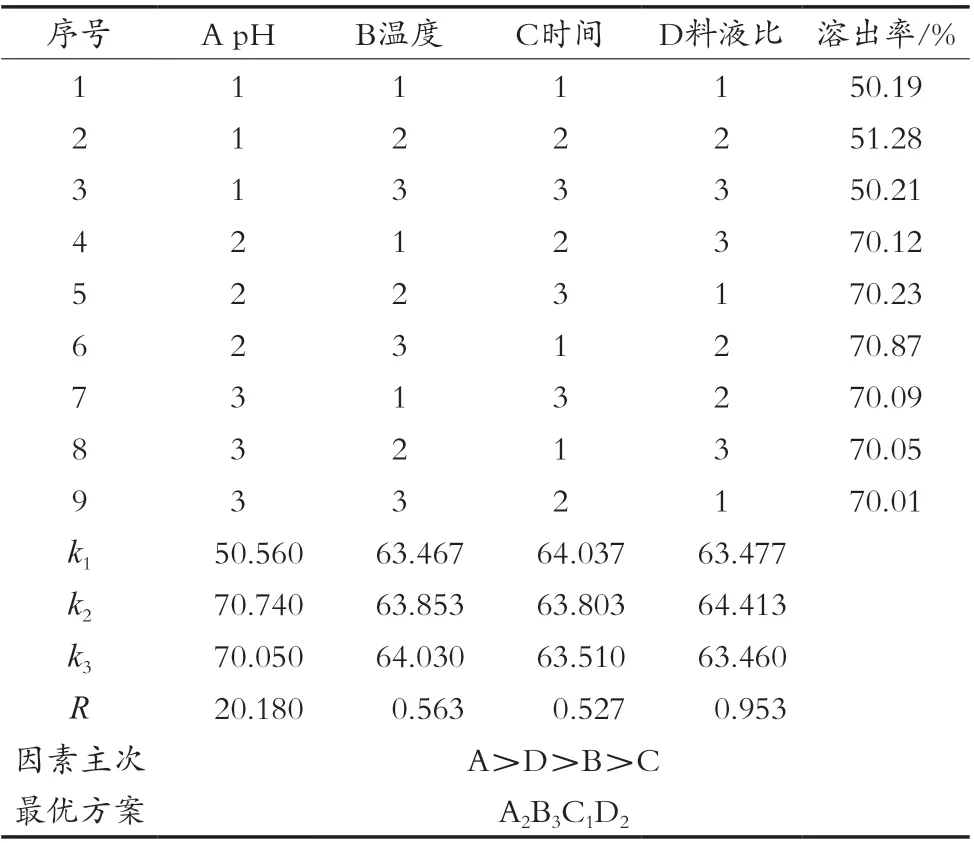
表2 L9(34)方案及结果分析
从极差分析结果可以看出,RA>RD>RB>RC,即对核桃蛋白质溶出率的影响因素主次所产生影响的顺序为pH>料液比>温度>时间。通过比较得到最优方案为A2B3C1D2,即pH 10.0、温度80 ℃、时间45 min、料液比1∶15(g/mL),经过试验得到该条件下核桃蛋白质的溶出率为70.87%。
3 结论
以核桃饼粕为原料,采用酸沉浸提法分离核桃蛋白,通过单因素试验,研究不同pH、温度、时间、料液比水平大小对核桃蛋白质溶出率的影响情况,根据正交试验结果,探究核桃蛋白提取的最佳工艺条件。酸沉碱提工艺在通过正交试验后确定的最优条件为pH 10.0、温度80 ℃、时间45 min、料液比1∶15(g/mL),在该工艺下的核桃蛋白质溶出率最高,溶出率为70.87%。

