右美托咪定通过抑制NLRP3炎症小体活化减轻脓毒症大鼠急性肾损伤*
周文杰, 杨海荣, 张 楠, 刘勤富, 马希刚△
(1宁夏医科大学总医院重症医学科,宁夏银川750004;2宁夏医科大学附属自治区人民医院,宁夏银川750021;3宁夏医科大学总医院手术室,宁夏银川750004)
脓毒症定义为机体对感染的反应失调,大量炎症介质级联释放,从而引起的致命的器官损伤和功能障碍,目前死亡率仍居高不下[1]。脓毒症急性肾损伤(acute kidney injury,AKI)约占所有病因引起AKI 发生的50%左右,其具有高发病率和高病死率的特点,有报道称其病死率高达70%,另外还会增加发展至慢性肾脏病及终末期肾病的风险,目前主要依赖于肾脏替代治疗,缺乏有效的早期治疗药物[2-5]。因此,探讨脓毒症AKI 的发病机理且寻找能早期干预治疗的有效药物尤为重要。肾脏炎症在脓毒症AKI 中起主导作用,而NOD 样受体蛋白 3(NOD-like receptor protein 3,NLRP3)炎症小体的活化对肾脏炎症的发展至关重要。右美托咪定(dexmedetomidine,DEX)具有镇痛镇静作用,且对呼吸功能无抑制并能保持患者的易唤醒状态,在ICU 被广泛使用。有研究显示,DEX 还具有抗炎症反应和器官保护等重要作用[6-7]。本研究通过盲肠结扎穿孔(cecal ligation and puncture,CLP)制备大鼠脓毒症 AKI 模型,探讨DEX对大鼠脓毒症AKI的保护作用及其相关机制。
材料和方法
1 材料
1.1 实验动物 SPF 级雄性 SD 大鼠 60 只,6~8 周,体重(250±20)g,购买并饲养于宁夏医科大学动物实验中心,动物合格证号为SCXK(宁)2015-0001,室温22~25 ℃,相对湿度45%~55%,12 h昼夜交替,自由摄取水和食物。操作符合动物伦理学标准,经宁夏医科大学总医院医学科研伦理审查委员会批准(审批号:2019-228)。
1.2 药物和试剂 右美托咪定注射液(江苏恩华药业股份有限公司);血清中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)和肾损伤分子 1(kidney injury molecule-1,Kim-1)的ELISA 试剂盒(江苏晶美生物科技有限公司);兔抗NLRP3 多克隆抗体和兔抗白细胞介素1β(interleukin-1β,IL-1β)多克隆抗体(Abcam);兔抗caspase-1 多克隆抗体和兔IL-18 多克隆抗体(武汉三鹰生物技术有限公司);兔抗GAPDH 抗体(武汉爱博泰克生物科技有限公司);辣根过氧化物酶标记的Ⅱ抗和封闭用羊血清(北京中杉金桥生物科技有限公司);总RNA 提取试剂盒和反转录试剂盒(北京天根生化科技有限公司)。
2 方法
2.1 模型建立和分组 60 只大鼠随机分为4 组,假手术(Sham)组、Sham+DEX 组、CLP 组及CLP+DEX组,每组各 15 只。采用 CLP 法制备大鼠模型[8]。大鼠用2%戊巴比妥钠(60 mg/kg)充分麻醉,备皮消毒,下腹正中线做长约1.5 cm 切口。打开腹腔,分离并牵出盲肠,在盲肠根部用3-0 丝线结扎。用直径2.6 mm 三棱针穿刺3 孔,挤出少量粪便后将盲肠回纳腹腔,逐层缝合关腹。术毕皮下注射复方氯化钠30 mL/kg 补液。Sham 组和 Sham+DEX 组大鼠仅行开关腹操作。Sham+DEX 组和CLP+DEX 组大鼠术前1 h经尾静脉以5 μg·kg-1·h-1的速率泵入DEX;Sham组和CLP组大鼠以5 μg·kg-1·h-1的速率泵入生理盐水。
2.2 血清生化指标检测 各组分别于术后6、12 和24 h处死5只大鼠,收集血清。采用全自动生化分析仪(HITACHI 7180)检测血清肌酐(serum creatinine,SCr)和血尿素氮(blood urea nitrogen,BUN)水平。
2.3 血清NGAL 和Kim-1 检测 采用ELISA 试剂盒测定,按照说明书,标准孔加标准品50 μL,建立标准曲线。样品孔加样品稀释液40 μL 及待测样品10 μL进行后续操作,在450 nm 波长处测量各孔的吸光度(A)值,最后根据标准曲线确定样品的浓度。
2.4 肾组织病理学检查 取肾脏组织置于4%多聚甲醛中浸泡固定24 h,经脱水、透明、石蜡包埋后切成 4 μm 厚的切片,HE 染色,400 倍光镜下观察病理学改变。参照文献[9]对肾小管损伤进行半定量评分:无损伤为0 分;损伤程度<25%为1 分;25%≤损伤程度<50%为 2 分;50%≤损伤程度<75%为 3 分;≥75%为4分。
2.5 透射电镜检查 将肾组织置于2%戊二醛中前固定2 h,1%饿酸后固定2 h,梯度乙醇依次脱水,环氧丙烷渗透,包埋组织,制作切片,在透射电镜(HITACHI H7650)下观察肾组织超微结构。
2.6 免疫组织化学染色 石蜡切片常规脱蜡复水,3% H2O2阻断内源性过氧化氢酶,山羊血清封闭,滴加 NLRP3 抗体(1∶200)、caspase-1 抗体(1∶200)、IL-1β 抗体(1∶200)和IL-18 抗体(1∶200)4 ℃过夜,次日滴加辣根过氧化物酶标记的Ⅱ抗,滴加3,3′-二氨基联苯胺显色,苏木素复染,脱水透明后封片。光镜下观察肾组织呈棕黄色处为阳性表达。每只大鼠取3张切片,每张切片在阳性表达区选取3 个不重复视野高倍镜下拍照,采用Image-Pro Plus 6.0 软件测定积分吸光度(IA)和阳性表达面积,从而计算平均吸光度(A)值(A=IA/面积)。
2.7 Western blot 检测蛋白水平 取肾组织称重后加蛋白裂解液,提取蛋白,BCA 法测定蛋白浓度。按比例上样,聚丙烯酰胺凝胶电泳分离蛋白,低温下湿转到PVDF 膜上,在含5%脱脂牛奶的封闭液中浸泡1 h,加 NLRP3 抗 体(1∶500)、caspase-1 抗 体(1∶1 000)、IL-1β 抗体(1∶2 000)、IL-18 抗体(1∶2 000)和GAPDH 抗体(1∶2 000)置于4 ℃过夜,次日用Tris 缓冲液冲洗3次,加Ⅱ抗置于水平摇床孵育1 h,洗膜后曝光采图。采用ImageJ软件进行分析。
2.8 RT-qPCR检测mRNA水平 使用RNAsimple总RNA提取试剂盒从肾组织中提取总RNA。实时定量PCR 反应使用 Bestar®SYBR Green qPCR Master Mix在 20 μL 反应体积中使用 1 μL cDNA 进行。选择GAPDH 作为内参照,目的 mRNA 相对水平使用 2-ΔΔCt法计算。GAPDH 上游引物为5′-GACATGCCGCCTGGAGAAAC-3′,下 游 引 物 为 5′-AGCCCAGGATGCCCTTTAGT-3′;NLRP3 上游引物为5′-GCAGCGATCAACAGGCGAGAC-3′,下 游 引 物 为 5′-TCCCAGCAAACCTATCCACTCCTC-3′;caspase-1 上 游 引 物 为5′-AAACACCCACTCGTACACGTCTTG-3′,下 游 引 物为 5′-AGGTCAACATCAGCTCCGACTCTC-3′;IL-1β 上游引物为 5′-CTCACAGCAGCATCTCGACAAGAG-3′,下游引物为5′-TCCACGGGCAAGACATAGGTAGC-3′;IL-18 上 游 引 物 为 5′-CGACCGAACAGCCAACGAATCC-3′,下 游 引 物 为 5′-CACAGATAGGGTCACAGCCAGTC-3′。
3 统计学处理
采用SPSS 20.0 软件进行统计分析。计量资料采用均数±标准差(mean±SD)表示,符合正态分布且方差齐的资料组间比较采用单因素方差分析,两两比较采用LSD 检验。以P<0.05 为差异有统计学意义。
结 果
1 大鼠肾功能指标检测
术后6 h SCr 和BUN 水平无显著差异。与Sham组相比,CLP 组于术后 12 h SCr 和 BUN 水平升高,24 h 显著升高(P<0.01);与 CLP 组相比,CLP+DEX 组12 h 和 24 h 的 SCr 及BUN 水平均下降(P<0.01),见图1A、B。
与Sham 组相比,CLP 组术后各时点血清NGAL和Kim-1水平均升高(P<0.01);给予DEX 预处理后,血清NGAL 和Kim-1 水平均下降(P<0.01)。Sham 组与Sham+DEX 组各时点NGAL 和Kim-1 水平无显著差异(P>0.05),见图1C、D。
2 肾组织病理学检查
使用HE 染色评估肾组织病理学改变如图2A 所示,Sham组和Sham+DEX组各时点肾组织结构完整、清晰,未见明显肾小管损伤的改变。CLP 组在术后6 h可见肾小管上皮细胞空泡变性;术后12 h可见肾小管上皮空泡变性加重,刷状缘脱落;术后24 h肾小管损伤进一步加重,可见肾小管明显扩张,间质散在出血和炎性细胞浸润。CLP+DEX 组各时点肾小管上皮细胞损伤程度均较CLP 组减轻。CLP 组各时点的肾小管损伤评分较Sham 组升高(P<0.01);与CLP 组比较,CLP+DEX 组肾小管损伤评分降低(P<0.01),见图2B。
3 透射电镜检查
Sham组和Sham+DEX组各时点近曲小管结构正常。CLP 组6 h 可见肾小管上皮细胞内小空泡,线粒体肿胀,部分线粒体嵴溶解;12 h 见较多大空泡,线粒体数量减少,嵴溶解加重,微绒毛融合;24 h 见上皮细胞凋亡,线粒体溶解,微绒毛脱落。CLP+DEX组各时点肾小管损伤程度均较CLP组减轻,见图3。
4 免疫组化染色观察
4.1 NLRP3 和caspase-1 免疫组化 结果显示NLRP3 和caspase-1 在肾小管上皮细胞胞质表达。与Sham 组相比,CLP 组各时点 NLRP3 和 caspase-1 阳性表达均升高,且随术后时间延长,表达呈升高趋势(P<0.01)。与CLP 组相比,CLP+DEX 组各时点NLRP3 和 caspase-1 阳性表达均降低(P<0.01)。Sham组和Sham+DEX组NLRP3和caspase-1阳性表达水平无显著差异(P>0.05),见图4。

Figure 1. Effects of DEX on SCr(A),BUN(B),NGAL(C)and Kim-1(D)in serum of the rats. Mean±SD. n=5.**P<0.01 vs Sham group;##P<0.01 vs CLP group.图1 右美托咪定对各组大鼠血清SCr、BUN、NGAL和Kim-1水平的影响
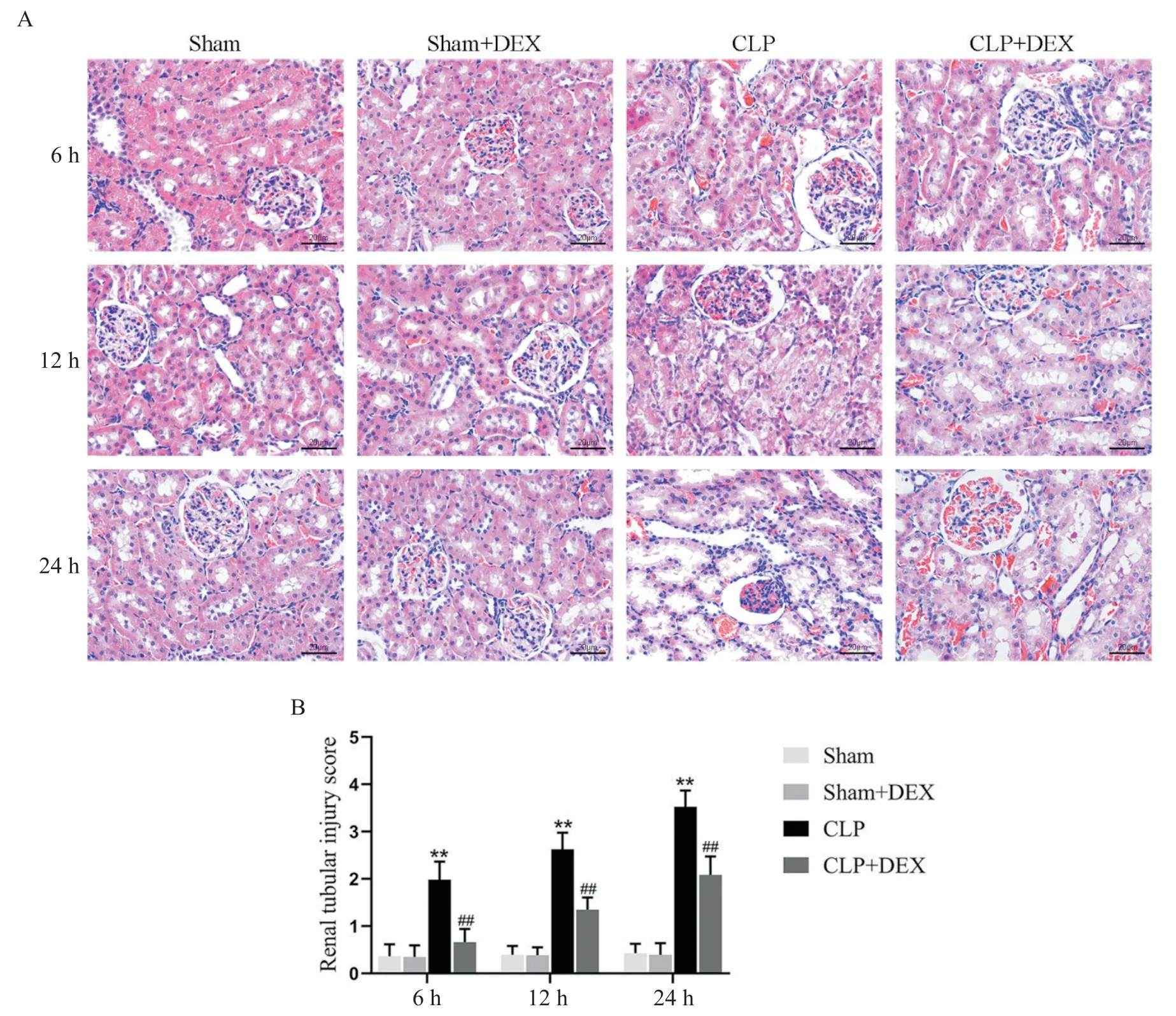
Figure 2. Pathological changes(A)and tubular injury score(B)of renal tissues(HE staining,scale bar=20 μm). Mean±SD. n=5.**P<0.01 vs sham group;##P<0.01 vs CLP group.图2 HE染色观察右美托咪定对各组大鼠肾组织病理学改变和肾小管损伤评分的影响

Figure 3. Observation of ultrastructure changes in kidney tissue by transmission electron microscope(scale bar=2 μm).图3 透射电镜观察右美托咪定对各组大鼠肾组织超微结构改变的影响
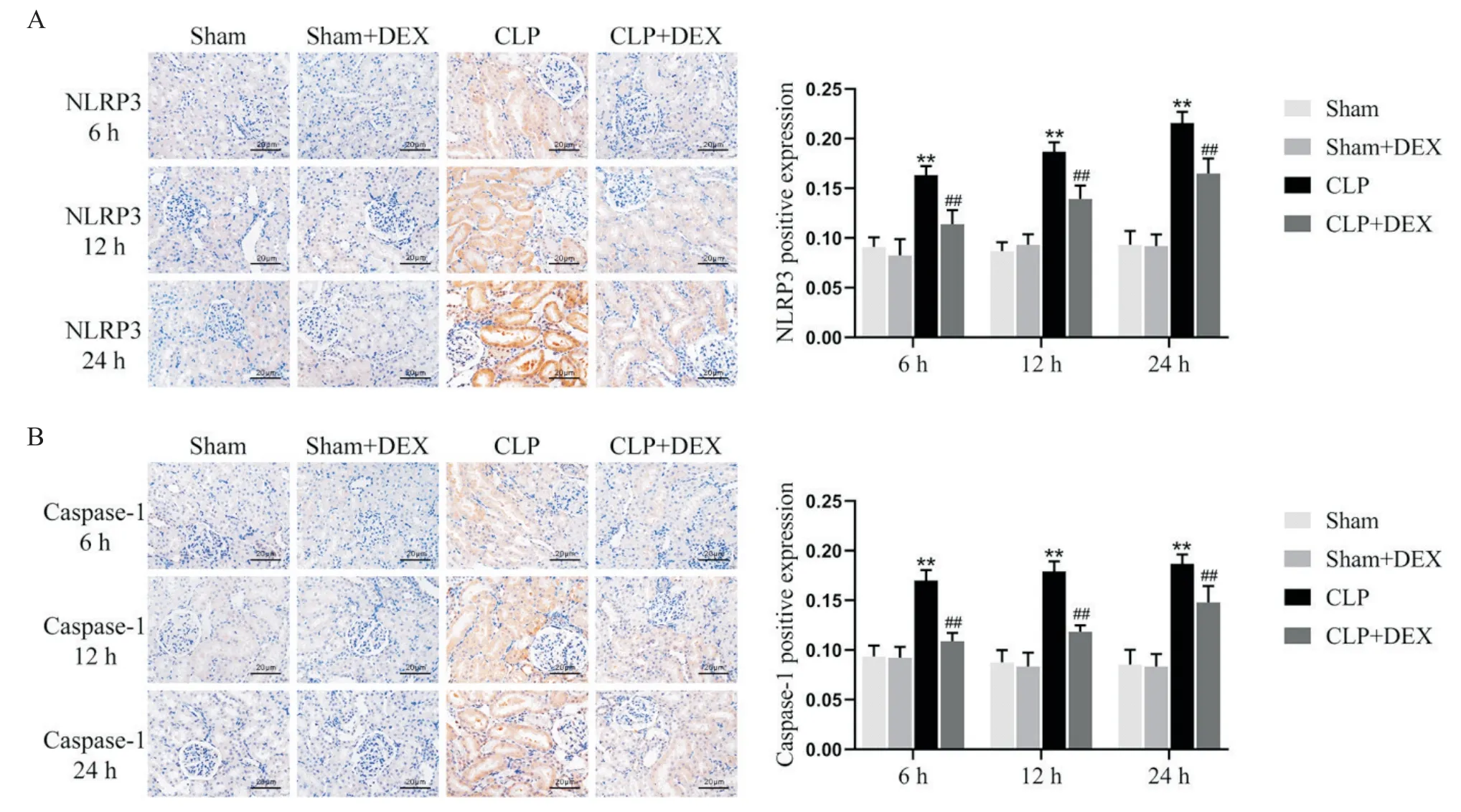
Figure 4. Effects of DEX on expression of NLRP3(A)and caspase-1(B)in the rats of each group(scale bar=20 μm). Mean±SD.n=5.**P<0.01 vs Sham group;##P<0.01 vs CLP group.图4 免疫组化观察右美托咪定对各组大鼠肾组织NLRP3和caspase-1表达的影响
4.2 IL-1β 和 IL-18 免疫组化 结果显示 IL-1β 和IL-18 在肾小管上皮细胞胞质表达,CLP 组各时点肾组织 IL-1β 和 IL-18 阳性表达较 Sham 组均显著升高(P<0.01)。给予DEX预处理后,CLP+DEX 组各时点肾组织IL-1β 和IL-18 阳性表达较CLP 组均降低(P<0.01)。Sham 组和 Sham+DEX 组 IL-1β 和 IL-18 阳性表达水平无显著差异(P>0.05),见图5。
5 Western blot检测结果

Figure 5. Effects of DEX on expression of IL-1β(A)and IL-18(B)in the rats of each group(scale bar=20 μm). Mean±SD. n=5.**P<0.01 vs Sham group;##P<0.01 vs CLP group.图5 免疫组化观察右美托咪定对各组大鼠肾组织IL-1β和IL-18表达的影响
与 Sham 组相比,CLP 组各时点 NLRP3、caspase-1、IL-1β 和 IL-18 的蛋白表达均升高,且表达均随术后时间延长渐行性升高(P<0.01)。给予DEX 预处后,CLP+DEX 组各时点 NLRP3、caspase-1、IL-1β 和IL-18 的蛋白表达较CLP 组相比均显著降低(P<0.01)。NLRP3、caspase-1、IL-1β 和 IL-18 的蛋白表达在Sham 组和Sham+DEX 组无显著差异(P>0.05),见图6。
6 RT-qPCR检测结果
与 Sham 组相比,CLP 组各时点 NLRP3、caspase-1、IL-1β 和 IL-18 的 mRNA 表 达 水 平 均 升 高(P<0.01)。与 CLP 组相比,CLP+DEX 组各时点肾组织NLRP3 和 IL-18 mRNA 表达水平均显著降低(P<0.01),肾组织 caspase-1 和 IL-1β mRNA 表达水平均有所降低(P<0.05)。Sham 组与 Sham+DEX 组 NLRP3、Caspase-1 和 IL-1β 和 IL-18 mRNA 表达无显著差异(P>0.05),见图7。
讨 论
AKI 是脓毒症患者最常见的并发症,与患者的死亡率增加独立相关[10-11]。目前CLP 诱发的脓毒症是应用最广泛的脓毒症动物模型制备方法。本研究中,CLP 诱导的大鼠脓毒症AKI 病理改变主要以肾小管损伤为主,包括小管上皮细胞空泡变性、刷状缘脱落、肾小管扩张、线粒体损伤,甚至上皮细胞凋亡等,这与文献报道一致[12-13],给予 DEX 干预后,肾小管损伤程度减轻,说明DEX 能在一定程度上改善大鼠脓毒症AKI 的肾脏病理损害。SCr 和BUN 作为诊断AKI 的传统指标,主要反应肾小球的滤过功能,而NGAL 和Kim-1 作为诊断早期AKI 的有效标志物,主要在肾小管损伤时显著升高。本实验中,DEX 能降低血清 SCr、BUN、NGAL 和 Kim-1 的水平,说明 DEX能改善脓毒症大鼠肾小球的滤过功能,同时能减轻肾小管的损伤。
脓毒症AKI的致病机理复杂,主要涉及以下3个主要的机制:炎症反应、肾小管微循环改变和肾小管适应性代谢重编程[14-16],其中炎症反应是造成脓毒症AKI 的主要原因。NLRP3 炎症小体被认为是炎症反应的关键环节,在多种炎症性疾病中具有重要意义[17-18]。NLRP3炎症小体的激活有两个阶段,一是通过诱导 Toll 样受体 4(Toll-like receptor-4,TLR4),激活核转录因子信号通路,介导产生IL-1β 和IL-18 前体;二是脂多糖等刺激信号与NLRP3受体结合,促进分泌为成熟的IL-1β 和IL-18,从而发挥免疫炎症效应[19-20]。研究表明,肾小管上皮细胞也表达TLR4 受体,病原体或损伤相关分子模式可与之结合,启动下游的级联信号反应,从而导致大量IL-1β 和IL-18 等促炎因子的合成和释放,造成肾脏炎症环境,炎症介质直接或间接损害肾小管上皮细胞,引起线粒体损伤、能量代谢障碍,甚至细胞凋亡[21]。本研究中,CLP组大鼠肾组织中 NLRP3、caspase-l、IL-1β 和 IL-18 的表达显著升高,且随着术后时间延长呈进行性升高趋势,这与肾脏病理损害程度一致,说明肾脏炎症反应越强,肾脏病理损伤程度越重,肾功能越差,而NLRP3 炎症小体的活化在大鼠脓毒症AKI 的致病过程中起重要作用。

Figure 6. Effects of DEX on protein level of NLRP3(A),caspase-1(B),IL-1β(C)and IL-18(D)in the rats of each group. Mean±SD. n=5.**P<0.01 vs Sham group;##P<0.01 vs CLP group.图6 Western blot检测右美托咪定对各组大鼠肾组织NLRP3、caspase-1、IL-1β和IL-18蛋白水平的影响
DEX 是高选择性α2受体激动剂,具有镇静、镇痛、稳定血流动力学和抗应激反应等作用[22-23]。近年来有越来越多研究显示,DEX 可抑制炎症因子产生,降低炎症反应,抑制细胞凋亡信号通路的激活,对肾脏、肺脏、大脑等重要器官具有保护作用[24-26]。有研究显示,DEX 能降低LPS 诱导的脓毒症小鼠血清和胰腺组织中的 TNF-α、IL-1β 和 IL-6 水平,减轻胰腺炎症反应[27]。DEX 还可以通过抑制 TLR4/MyD88/NF-κB/iNOS 信号通路减轻 LPS 诱导的 AKI[28]。本研究结果显示给予DEX 干预后,大鼠肾组织NLRP3、caspase-l、IL-1β 和 IL-18 的表达水平均显著下降,说明DEX 能通过抑制NLRP3 炎症小体的活化,减少炎症因子释放,从而减轻肾组织炎症反应,改善肾小管病理损伤程度及肾功能。

Figure 7. Effects of DEX on the mRNA level of NLRP3(A),caspase-1(B),IL-1β(C)and IL-18(D)in the rats of each group.Mean±SD. n=5.**P<0.01 vs Sham group;#P<0.05,##P<0.01 vs CLP group.图7 RT-qPCR检测右美托咪定对各组大鼠肾组织NLRP3、caspase-1、IL-1β和IL-18 mRNA水平的影响
综上所述,我们证实了DEX 可一定程度上减轻CLP 诱发的大鼠脓毒症AKI,其机制可能与抑制NLRP3炎症小体的活化有关。

