乙型肝炎病毒促进肝细胞PD-L1 蛋白表达机理
朱海珍,荀圳,邓日林,田仁云,郭萌萌,陈生稳,刘倩,郭艳霞
(1.湖南大学 生物学院,湖南 长沙 410082;2.湖南大学 病原生物学与免疫学研究所,湖南 长沙 410082;3.湖南大学 医学病毒学湖南省重点实验室,湖南 长沙 410082)
乙型肝炎病毒(Hepatitis B virus,HBV)是一种小的嗜肝DNA 病毒,是导致慢性肝病的主要原因,可导致病毒性肝炎、肝硬化和肝细胞癌(Hepatic cell carcinoma,HCC).据统计,全世界约有2.5 亿人长期感染HBV,并有发展为肝硬化甚至肝癌的风险[1].病毒和宿主因素都对慢性HBV 感染的结果有影响,与其他病原体一样,HBV 形成了逃避宿主的免疫防御策略,例如高比率的基因突变率和免疫调节蛋白的表达.
轴抑制蛋白Axin 是Wnt/β-catenin 信号的负调节因子,通过蛋白酶体降解途径调节β-catenin 蛋白水平,进而抑制Wnt/β-catenin 信号转导[2-4].然而,Axin 在HBV 感染过程中的作用尚不清楚.
PD-L1 是一种免疫检查点分子,调节Ⅰ型T 辅助细胞(Th1)免疫反应,介导癌症免疫逃避.它可以在肿瘤细胞(TC)和肿瘤浸润性的免疫细胞(IC)上进行表达[5].近几年,抗PD-L1 治疗手段在人类癌症的免疫治疗中占据了中心地位[6-8].然而,PD-L1 在HBV感染中的作用及其机理仍有待阐明.
泛素蛋白酶体降解途径是目前已知的所有真核生物体内具有高度选择性且最为重要的蛋白质降解途径.真核细胞内泛素化修饰后的靶蛋白能被降解或者被转移到细胞内或细胞外的特定部位.靶蛋白的泛素化修饰需要E3 泛素连接酶的参与,E3 泛素连接酶通过调控调节蛋白的泛素化过程参与细胞内的多种生理过程[9].经研究发现,HBV 感染可对细胞内多种生命活动产生影响,如影响转录因子的表达,促使Caspase 剪切从而促使细胞凋亡等.然而,HBV是否能调节细胞内一些E3 连接酶的表达,进而调节泛素蛋白酶体途径尚不清楚.
本文从转录水平、翻译水平以及翻译后的修饰水平对Axin 和PD-L1 的关系进行了探讨,发现Axin 可能通过调节PD-L1 的E3 连接酶的表达,调控PD-L1 的翻译后修饰;同时,还发现Axin 能够逆转HBV 引起的PD-L1 上调现象.本研究为HBV 免疫逃逸机理提供参考和依据.
1 材料与方法
1.1 细胞系
Huh7 细胞为美国耶鲁大学医学院刘晨教授实验室惠赠;BGC-823 购自Boster 公司;HEK293T 购自美国ATCC;HLCZ01 细胞系由本实验室从临床病人肝组织中分离培养得到[10].
1.2 试 剂
高糖(DMEM)培养基和DMEM/F-12 培养基(Invitrogen 公司),1×PBS(Hyclone 公司),0.25%胰蛋白酶(Invitrogen 公司),细胞RNA 收取Trizol 试剂(Invitrogen 公司),逆转录试剂盒(Accurate Biology 公司),SYBR Green 定量试剂盒(Accurate Biology 公司),蛋白酶抑制剂片剂(Merck 公司),细胞蛋白收取RIPA 裂解液(Thermo 公司),Axin 抗体(CST 公司),PD-L1 抗体(Proteintech 公司),Flag 抗体(Sigma-Aldrich 公司),V5 抗体(Invitrogen 公司),β-actin 抗体(Sigma-Aldrich 公司).
60 mm 的细胞培养皿(Biologix 公司),十二孔细胞培养板(Biologix 公司),10 cm 的细胞培养皿(Biologix 公司),1.5 mL 的离心管(Axygen 公司),200 μL PCR 八联管(Axygen 公司),0.22 μm 和0.45 μm 的PVDF 膜(Merck Millipore 公司).
1.3 仪器设备
4 ℃冰箱(中科美菱公司),-20 ℃冰箱(Haier 公司),-80 ℃超低温冰箱(Thermo 公司),CO2恒温细胞培养箱(Thermo 公司),生物安全柜(Airtech 公司),凝胶核酸成像(上海天能公司),蛋白核酸曝光成像仪器(Bio-rad 公司),细胞计数仪(Beckman 公司),光学显微镜(Olympus 公司),细胞液氮冻存罐(Thermo 公司),分析天平(上海天平仪器厂),Nanodrop2000(Thermo 公司),实时荧光定量PCR 仪(湖南达尔仪器有限公司),普通PCR 仪(Eppendorf 公司),制冷高速离心机(Eppendorf 公司).
1.4 实验方法
1.4.1 HBV 感染方法
用于实验感染细胞的HBV 来自HepG2.2.15 细胞上清(D 型).在培养HepG2.2.15 细胞时,在培养基中加入终质量浓度为500 μg/mL 的新霉素(G418)来维持HBV 基因组的复制水平.当HepG2.2.15 细胞开始产生病毒时,用不加G418 的培养基培养HepG2.2.15 细胞,一边扩大培养细胞一边收集细胞上清,收集的细胞上清用0.45 μm 微孔过滤器过滤,使病毒得以富集,最后测定病毒滴度.HBV 按照MOI为20 接种于HLCZ01 细胞,病毒与细胞孵育过夜后,去除培养上清,用磷酸盐缓冲盐水(Phosphate Buffered Saline,PBS)洗涤3 次,加入新鲜培养基继续培养至对应的时间点.
1.4.2 过表达质粒的构建与鉴定
为了构建Axin、PD-L1、SPOP、Cbl 和HBX 的过表达质粒,首先利用Primer Primer5 设计PCR 引物,然后从Huh7 细胞中提取总RNA,利用其逆转录产物为模板来扩增Axin、PD-L1、SPOP、Cbl 基因;同时从HBV 感染的HLCZ01 细胞内提取细胞总RNA 来扩增HBX 基因.通过胶回收纯化PCR 产物,最后利用TA 克隆方法将扩增得到的DNA 片段连入p3×Flag-CMV 和pCDNA3.1a 载体中,从而得到重组质粒p3×Flag-CMV-Axin、p3×Flag-CMV-PD-L1、p3×Flag-CMV-HBx、pCDNA3.1a-PD-L1、pCDNA3.1a-SPOP、pCDNA3.1a-Cbl,通过测序鉴定目的基因序列是否完全正确.PCR 引物序列如表1 所示.

表1 质粒克隆引物Tab.1 Primers used for plasmid construction
1.4.3 Western blot 实验
用含有蛋白酶抑制剂的RIPA Buffer 裂解液裂解细胞,冰浴30 min,13 200 r/min 离心15 min 后收集蛋白.根据试剂说明书的使用方法,用BCA(Bicinchoninic Acid)试剂法测定蛋白浓度.取20 μg蛋白样品与2×Load Buffer 等体积混合,在100 ℃金属浴中煮沸5 min 之后上样,采用80 V 恒压跑胶,待蛋白Mark 分层后调至120 V 恒压跑胶,根据Mark显示的位置,待目的蛋白到达合适位置后进行转膜.100 V 恒压转膜2 h,转膜成功后,以5%的脱脂牛奶封闭1 h,之后加入对应一抗4 ℃过夜孵育,二抗选用anti-mouse 或anti-rabbit 抗体室温孵育2~4 h.将PVDF 膜置于化学发光信号检测仪上,加入预先配制好的显影液曝光1~5 min,并保存蛋白印迹图片.
1.4.4 Real-time PCR 实验
使用Trizol 试剂裂解细胞,采用氯仿抽提的方法提取细胞内总RNA,通过逆转录获得cDNA,用相对应的定量引物进行实时荧光定量PCR 分析,探究目的基因在RNA 水平的表达情况,所用方法参照试剂盒说明书操作.Real-time PCR 反应所用引物序列如表2 所示.

表2 Real-time PCR 反应所用引物序列Tab.2 Primer sequences used in real-time PCR reactions
1.4.5 统计学分析
所有实验数据均录入Excel 文档中保存,对照组数据和处理组数据之间显著性差异分析采用学生双尾t 值分析方法.用*P<0.05、**P<0.01 和***P<0.001 来表示显著性差异程度,其中P<0.05 被认为具有统计学意义.数据以means±SD 形式在图表中显示.
2 结果与结论
2.1 HBV 感染抑制Axin 的表达和促进PD-L1 的表达
Axin 在WNT 信号通路中起重要的调控作用[11],为了检测Axin 在HBV 调节抗病毒免疫过程中的作用,本文检测了HLCZ01 细胞和HBV 感染的HLCZ01 细胞内Axin 和PD-L1 的表达,以探讨Axin在HBV 感染过程中的潜在作用.利用实时荧光定量(Real-time PCR)方法,以MOI 为20 的HBV 感染HLCZ01 细胞45 d,提取细胞总RNA 和细胞总蛋白.利用Real-time PCR 方法,以未被HBV 感染的HLCZ01 细胞为对照,检测细胞内Axin 和PD-L1 的mRNA 水平,发现HBV 感染后不影响Axin 和PDL1 的转录水平(图1(a)).利用Western Blot 方法,检测细胞内Axin 和PD-L1 的蛋白水平,发现HBV 感染后抑制Axin 蛋白的表达但促进PD-L1 蛋白的表达(图1(b)).为进一步验证这一实验结果,在Huh7细胞中转染表达HBV 的1.3 倍复制子的质粒,24 h以后提取细胞总RNA 和细胞总蛋白.利用Realtime PCR 方法,检测细胞内Axin 和PD-L1 的mRNA水平,发现HBV 的1.3 倍复制子抑制Axin 的转录但不影响PD-L1 的转录(图1(c)).借助Western Blot方法,发现转染了HBV 的1.3 倍复制子质粒的Huh7细胞内的Axin 蛋白水平明显下调,而PD-L1 的蛋白水平明显上调(图1(d)).在Huh7 细胞中转染质粒p3×Flag-CMV-vector 或p3×Flag-CMV-HBx,48 h 后收取细胞总蛋白,利用Western Blot 方法,检测细胞内Axin 和PD-L1 的蛋白水平,发现转染了HBx 质粒的Huh7 细胞内Axin 的蛋白水平下降,而PD-L1的蛋白水平升高(图1(e)).基于上述实验结果,推测HBV 导致Axin 和PD-L1 蛋白水平发生变化可能是通过HBx 实现的.此外,以MOI 为20 的HBV 感染HLCZ01 细胞45 d,然后转染质粒p3×Flag-CMVvector 或p3×Flag-CMV-Axin(1 μg 或2 μg),48 h 后收取细胞总蛋白,利用Western Blot 方法,检测细胞内Axin 过表达情况和PD-L1 蛋白水平,研究发现在HBV 感染的HLCZ01 细胞内过表达Axin 质粒,能够逆转HBV 感染引起的PD-L1 蛋白水平降低现象(图1(f)).由图1 可知,在HBV 感染肝细胞内,Axin蛋白水平与PDL1 蛋白水平呈负相关性.
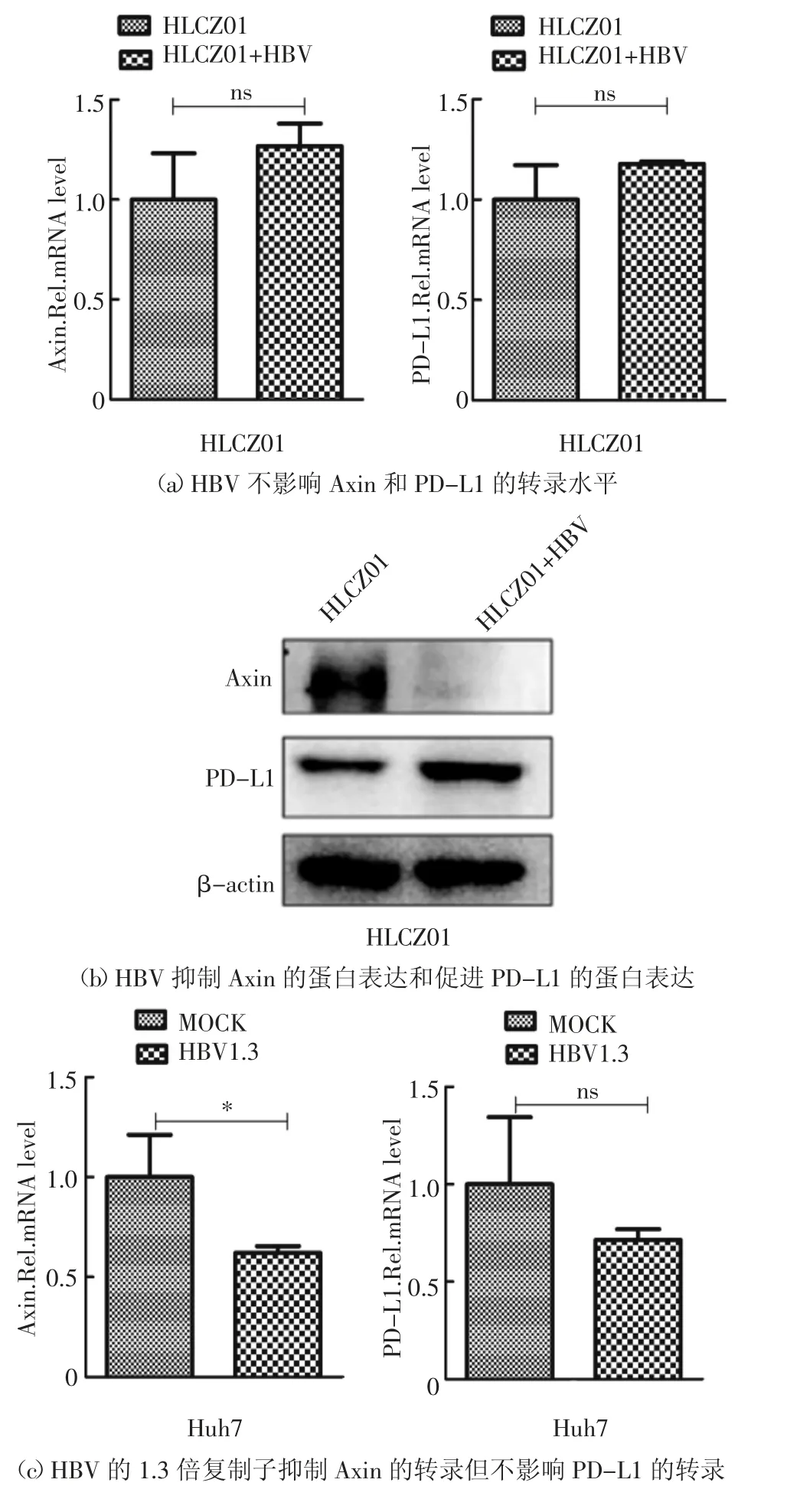
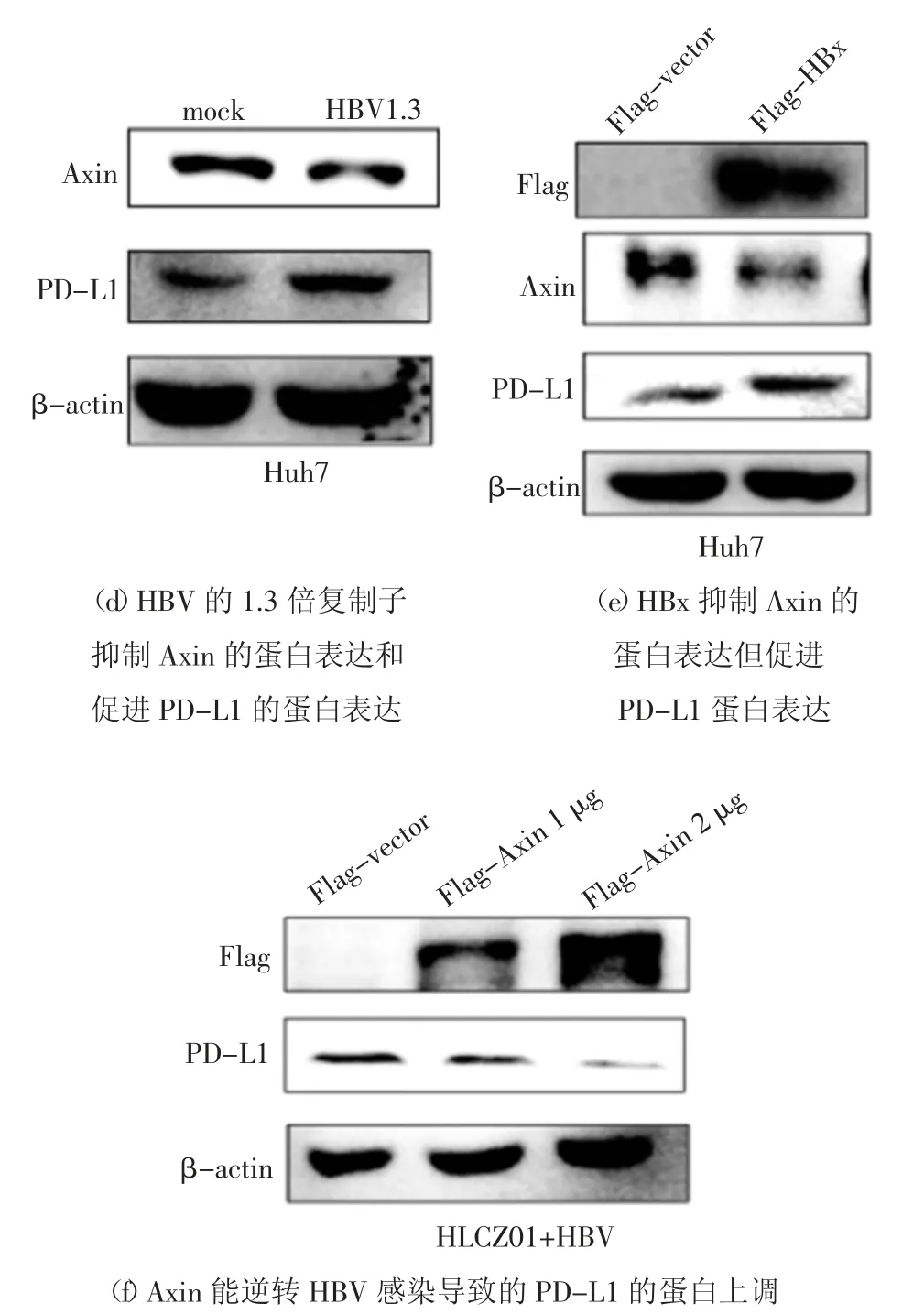
图1 HBV 感染抑制Axin 的表达和促进PD-L1 的表达Fig.1 HBV infection inhibits Axin expression and promotes PD-L1 expression
2.2 Axin 通过泛素化蛋白酶体途径降解PD-L1蛋白
为了进一步明确Axin 与PD-L1 之间的关系,在Huh7 细胞中,转染质粒p3×Flag-CMV-vector 或p3×Flag-CMV-Axin,48 h 后收取细胞总蛋白,利用Western Blot 方法,检测细胞内Axin 和PD-L1 蛋白水平,发现Axin 可降低细胞内PD-L1 蛋白水平(图2(a)).在Huh7 和HEK293T 细胞中,转染质粒p3×Flag-CMV-vector 或p3×Flag-CMV-Axin,48 h 后收取细胞总RNA,利用Real-time PCR 方法,检测细胞内Axin 和PD-L1 的mRNA 水平,发现在Huh7 和293T 细胞中过表达Axin 对PD-L1 的转录水平并无明显影响(图2(b)).利用从湖南省肿瘤医院收集48例肝癌病人癌旁组织样本,提取组织总RNA,利用Real-time PCR 方法,检测组织内Axin 和PD-L1 的mRNA 水平,并通过SPSS 软件分析Axin 与PD-L1之间的相关性,发现它们的mRNA 并无相关性(图2(c)).在Huh7 细胞中,转染质粒p3×Flag-CMVvector 或p3×Flag-CMV-Axin,48 h 后加入放线菌酮素(100 μg/mL CHX 终浓度),15 min 和30 min 后分别收取细胞总蛋白,利用Western Blot 方法,检测细胞内Axin 过表达情况和PD-L1 蛋白水平,发现Axin 对PD-L1 的翻译水平没有影响(图2(d)).最后,对其翻译后修饰水平进行探究.在Huh7 细胞中,转染质粒p3×Flag-CMV-vector 或p3×Flag-CMV-Axin,48 h 后分别加溶酶体降解途径抑制剂(NH4Cl)[12]和蛋白酶降解途径抑制剂(MG132),处理6 h 后收取细胞总蛋白,利用Western Blot 方法,检测细胞内Axin过表达情况和PD-L1 的蛋白水平,发现Axin 可能通过影响PD-L1 的蛋白酶体降解发挥作用(图2(e)).另外,在HEK293T 细胞中,转染质粒p3×Flag-CMVvector 或p3×Flag-CMV-Axin 和pCDNA3.1a-PDL1,48 h 后加蛋白酶降解途径抑制剂(MG132),处理6 h 后收取细胞总蛋白,以V5 抗体进行免疫共沉淀实验,检测细胞内PD-L1 的泛素化水平,发现Axin能促进PD-L1 的泛素化(图2(f)(g)).在Huh7 细胞中,转染质粒p3×Flag-CMV-vector 或p3×Flag-CMV-Axin(1 μg 或者2 μg)48 h 后,在收取蛋白前6 h,加入蛋白酶降解途径抑制剂(MG132)培养细胞,收取的细胞总蛋白以PD-L1 抗体进行免疫共沉淀实验,检测细胞内PD-L1 的泛素化水平,发现Axin 对PD-L1 的泛素化呈剂量依赖性.基于上述实验结果,认为Axin 可能通过蛋白酶体途径降解PD-L1 蛋白.
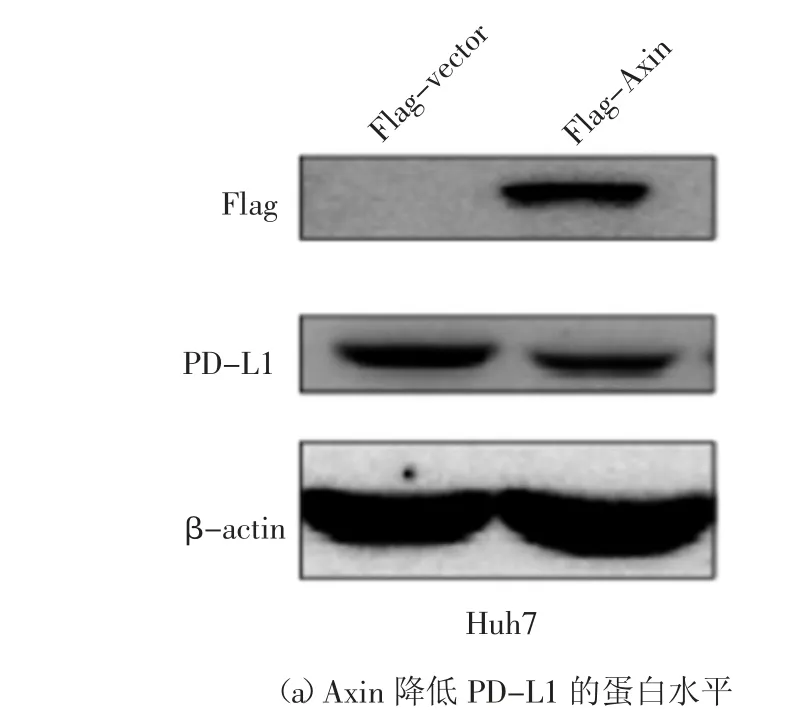
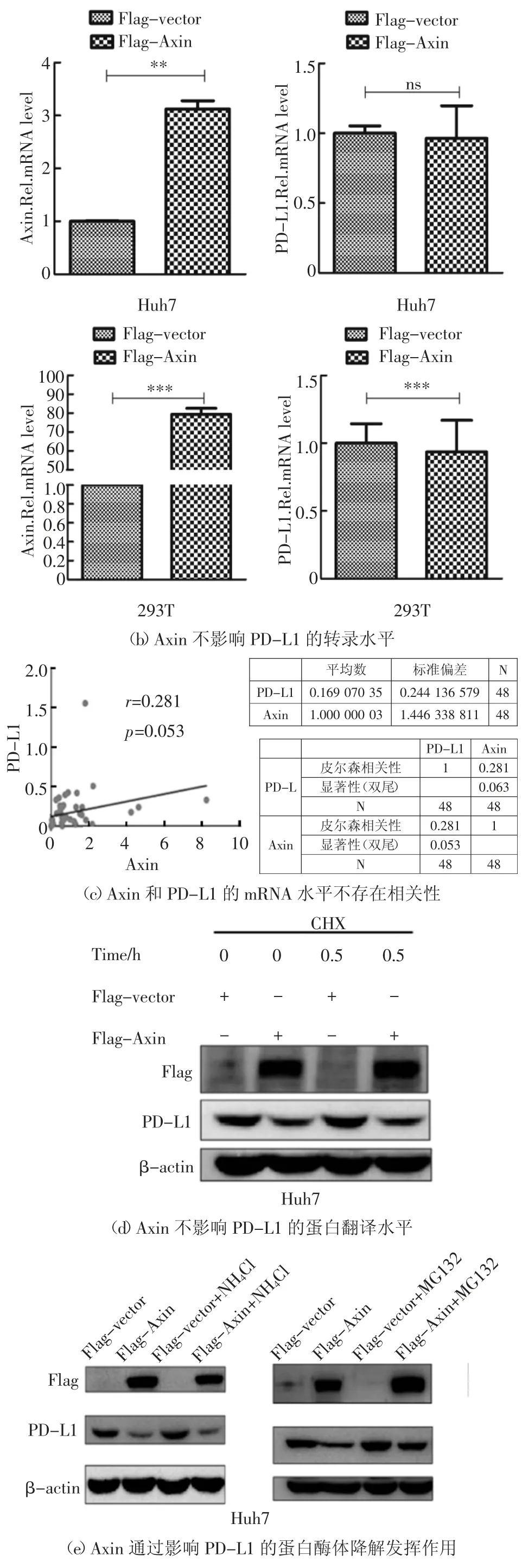

图2 Axin 通过泛素化蛋白酶体途径降解PD-L1 蛋白Fig.2 Axin degrades PD-L1 protein through ubiquitin proteasome pathway
2.3 Axin 通过影响E3 连接酶SPOP 的表达进而调控PD-L1 的蛋白酶体降解
蛋白与蛋白质之间的相互作用可能是通过直接或间接方式进行的.为明确Axin 对PD-L1 蛋白的调控方式,首先,在HEK293T 细胞中共转染带Flag 标签的Axin 和带V5 标签的PD-L1,通过免疫共沉淀实验分析,发现Axin 与PD-L1 不存在直接相互作用(图3(a)).间接调节PD-L1 的泛素化作用可能通过两种方式,一种是调节其去泛素化酶的表达,另外一种是调节其泛素化酶的表达.NF-kb 信号通路活化后,可增强PD-L1 去泛素化酶的表达[13].将质粒p3×Flag-CMV-vector 或p3×Flag-CMV-Axin 转染至Huh7 细胞,48 h 后分别收取细胞总蛋白,利用Western Blot 和实时荧光定量PCR 方法,发现Axin对NF-kb 信号通路的活化无作用(图3(b)).有文献报道E3 连接酶Cbl 和SPOP 可泛素化降解PDL1[14-18].将质粒p3×Flag-CMV-vector 或p3×Flag-CMV-Axin 转染至Huh7 细胞,48 h 后收取细胞总RNA,利用Real-time PCR 方法,检测Axin 对PD-L1的E3 连接酶Cbl 和SPOP 的mRNA 水平的影响,发现Axin 对这两种E3 连接酶的mRNA 水平并无影响(图3(c)).另外,将质粒p3×Flag-CMV-vector 或p3×Flag-CMV-Axin(1 μg 或者2 μg)和pCDNA3.1a-Cbl或者pCDNA3.1a-SPOP 转染至HEK293T 细胞,48 h后收取细胞总蛋白,利用Western Blot 方法,检测Axin 对Cbl 和SPOP 蛋白水平的影响,发现Axin 可增强SPOP 的蛋白表达(图3(d)).有文献报道PDL1 主要通过K48 位和K63 位进行泛素化降解[19-21],将质粒p3×Flag-CMV-vector 或p3×Flag-CMVAxin 和pCDNA3.1a-PD-L1 和野生型、K48 或者K63的HA 质粒转染至HEK293T 细胞,以V5 抗体进行免疫共沉淀实验,检测其对PD-L1 蛋白泛素化的影响,发现Axin 促进K48 依赖的PD-L1 泛素化降解(图3(e)).
综上所述,本文认为HBV 可能通过其HBx 下调Axin 蛋白水平,降低PD-L1 的E3 连接酶SPOP 蛋白水平,进而抑制K48 依赖的PD-L1 泛素化降解,导致HBV 感染肝细胞内PD-L1 蛋白含量增加(图3(f)).
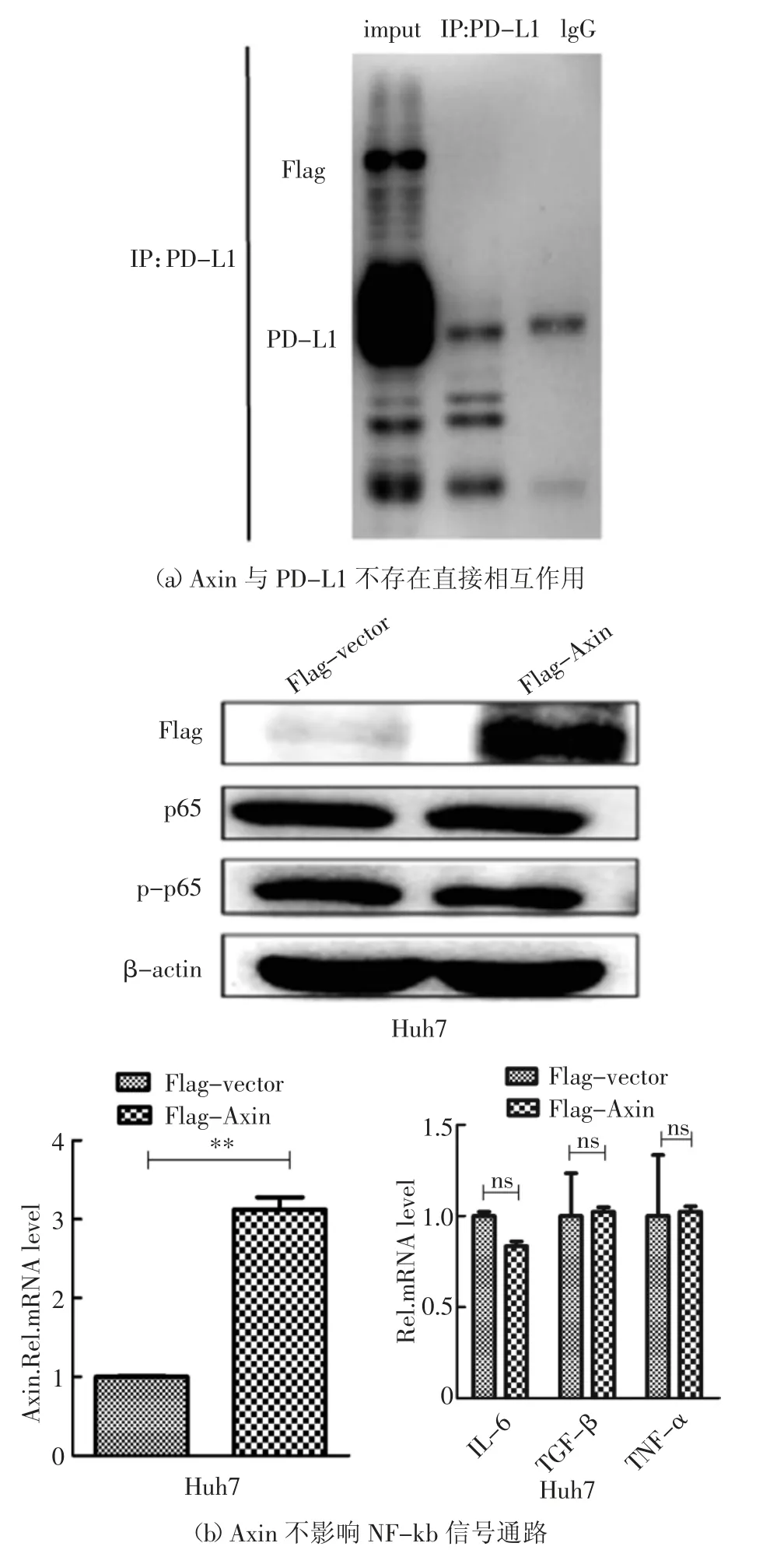
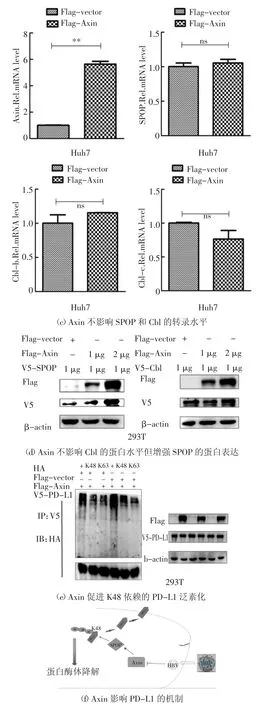
图3 Axin 通过影响E3 连接酶SPOP 的表达进而调控PD-L1 的蛋白酶体降解Fig.3 Axin regulates proteasome degradation of PD-L1 by affecting the expression of E3 ligase SPOP
3 讨论
在HBV 诱导的肝细胞癌中,癌组织中的Axin蛋白水平明显低于其邻近组织,但HBV 下调Axin蛋白表达的机制尚不明确.本文对HBV 抑制Axin蛋白表达的机制进行了研究,发现HBx 可能参与了HBV 对Axin 蛋白水平的下调作用.文献[22-24]研究表明,在乙型肝炎病毒相关性肝癌组织中,CD8+T 细胞功能异常且耗竭,其特征是PD-1 高表达,干扰素-γ 和肿瘤坏死因子分泌减少,但HBV 感染诱导细胞内PD-L1 表达的机制仍不清楚.本文研究发现在HBV 感染的肝细胞内,Axin 蛋白表达明显下调而PD-L1 蛋白表达显著增加.通过相关细胞实验和临床数据统计表明,Axin 不能调节WNT 信号通路下游转录因子的表达进而影响PD-L1 的转录水平.另外,一个蛋白影响另外一个蛋白的表达,也有可能是调节它翻译后的降解水平来实现的.通过添加相关抑制剂,发现Axin 通过影响PD-L1 的蛋白酶体降解途径,降低病毒感染细胞内PD-L1 水平.进一步研究发现Axin 可能通过影响PD-L1 的E3 连接酶SPOP 的表达,进而发挥其促进PD-L1 泛素化降解作用,但Axin 影响SPOP 表达的具体机制仍有待进一步研究.另外,本研究只选择了与PD-L1 相关的两种E3 连接酶进行了研究,Axin 是否对作用于PDL1 的其他E3 连接酶有影响还有待进一步探讨.

