北虫草水提物对小鼠酒精性胃损伤保护作用研究
王千慧 黄竹青 郑剑玲 刘 颖 卜 桐 付赵军 谷思文 张 帆 齐 贺
辽宁省基础医学研究所 辽宁医药职业学院(辽宁 沈阳 110101)
随着经济增长,我国酒精饮品消耗量显著增加,如何消除过度饮酒所带来的健康隐患和相关疾病已成为世界性问题。据统计,酗酒是导致疾病与残疾的第三大危险因素之一,目前已证明有200余种疾病与过度饮酒相关[1]。酒精除了对肝脏、胰腺等造成损伤之外,还对胃肠道粘膜造成直接或间接的损害[2-3]。北虫草(Cordyceps militaris),又称为北冬虫夏草,属于子囊菌类的麦角菌目,麦角菌科,真菌属[4]。北虫草中富含腺苷、虫草素、虫草酸、小分子肽等多种活性物质,具有良好的调节免疫、抗氧化、抗肿瘤、抗感染等药理学作用[5-7]。但其水提物对胃组织酒精损伤的保护作用却鲜有研究,因此本文通过测定小鼠酒精胃损伤后胃组织中SOD,GST,ADH,ALDH活性变化和MDA含量变化,为拓展开发北虫草相关产品提供实验依据。
1 材料与方法
1.1实验动物 50只体重为18~22g昆明小鼠,雌雄各半分笼饲养,购自辽宁长生生物技术股份有限公司,实验动物生产许可证号:SCXK(辽)2015- 0001。
1.2试剂与仪器设备 超氧化物歧化酶(SOD)活性检测试剂盒、丙二醛(MDA)含量检测试剂盒、谷胱甘肽S-转移酶(GST)活性检测试剂盒、乙醇脱氢酶(ADH)活性检测试剂盒、乙醛脱氢酶(ALDH)活性检测试剂盒均购于北京索莱宝生物科技有限公司。
1.3实验方法
1.3.1 北虫草水提物制备方法 本研究采用低、高温提取相结合方法。低温提取温度为45℃,物料比1∶30,提取3h,然后采用4000rpm离心10min,分离得到上清液Ⅰ;对沉淀进行第二次高温提取,设定温度80℃,物料比1∶30,提取3.5h后采用4000rpm离心10min,得上清液Ⅱ,合并两次上清液旋转蒸发进行浓缩,最后将浓缩液冻干得到粉末,置于-20℃冰箱中保存备用。使用时,用纯化水进行溶解,现用现配[8]。
1.3.2 造模及给药方法 50只昆明小鼠,雌雄各半,体重:18~22g,随机分成五组。空白对照组:常规饲料,饮食自由,每日上午用蒸馏水(10ml/kg)灌胃,3h后再次采用蒸馏水(0.1ml)灌胃;病理模型组:常规饲料,饮食自由,参考蔡琦、李杨等人的造模方法和预实验情况,本课题组每日上午采用35%酒精(10ml/kg)灌胃,3h后采用蒸馏水(0.1ml)灌胃[9-10];北虫草低、中、高浓度给药组:常规饲料,饮食自由,每日上午采用35%酒精(10 ml/kg)灌胃,3h后分别采用0.5g/kg、1.0g/kg和2.0g/kg北虫草水提物进行灌胃,饲养14天,末次灌胃后禁食不禁水,24h后处死小鼠并立刻取出小鼠胃组织备用[8]。
1.3.3 指标测定 将各组胃组织按0.1g/1ml(组织/提取液)加入相应提取液,于冰浴下进行匀浆,然后将匀浆液置于超声波细胞粉碎仪中,采用功率200w、超声3s、间隔10s并重复超声30次进行细胞破碎。按各试剂盒说明书要求分别离心获取各组小鼠胃组织上清液,分别测定各组小鼠胃组织上清液中SOD,GST,ADH和ALDH活性及MDA含量。
1.4数据处理 本研究数据均采用SPSS 13.0进行分析,所得数据均用平均值±标准差表示,多样本间均值差异采用t检验,以P<0.05为差异具有统计学意义。
2 结果与分析
2.1肉眼观察对照组、病理模型组和高浓度给药组小鼠胃组织病理变化 通过肉眼观察对照组、病理模型组和高浓度给药组小鼠胃组织可以发现:对照组小鼠胃内组织光滑、完整,褶皱正常,未出现充血点等病理情况,病理模型组小鼠则出现明显的充血点,表明酒精对小鼠胃组织造成损伤,而高剂量给药组小鼠胃组织中充血点明显减少。
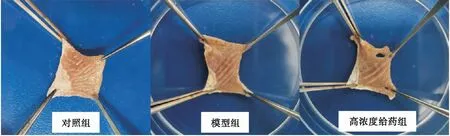
图1 对照组、病理模型组和高浓度给药组小鼠胃组织病理改变
2.2不同浓度北虫草水提物对小鼠胃组织中SOD、MDA的影响 与对照组小鼠相比,病理模型组小鼠胃组织中SOD活性下降(242.61±35.60 vs 171.91±14.81,P<0.05);与病理模型组相比,给药组小鼠胃组织中SOD活性明显增强,且存在浓度依赖性(171.91±14.81 vs 274.01±45.32,P<0.05;171.91±14.81 vs 297.99±44.98,P<0.01;171.91±14.81 vs 301.52±48.58,P<0.05)。与对照组小鼠相比,病理模型组小鼠胃组织中MDA含量明显增高(5.05±0.78 vs 12.01±1.02,P<0.01);北虫草低剂量组小鼠其MDA含量与模型组小鼠相比无明显差异,北虫草中、高剂量组小鼠其MDA含量均明显下降,且呈现浓度依赖性(12.01±1.02 vs 7.75±0.46,P<0.01;12.01±1.02 vs 5.13±0.39,P<0.01)。

图2 各组小鼠胃组织中SOD活性#:与对照组相比,P<0.05;*:与模型组相比,P<0.05;**:与模型组相比,P<0.01

图3 各组小鼠胃组织中MDA含量#:与对照组相比,P<0.05;##:与对照组相比,P<0.01;**:与模型组相比,P<0.01
2.3不同浓度北虫草水提物对小鼠胃组织中GST的影响 GST在机体内能够催化谷胱甘肽与多种有毒物质结合,在人体Ⅱ期解毒过程中发挥发挥着重要应用[11]。与对照组小鼠相比,病理模型组小鼠胃组织中GST活性明显下降(3.52±0.68 vs 0.97±0.22,P<0.01);与病理模型组小鼠相比,北虫草水提物低、中、高剂量均使小鼠胃组织中GST活性升高(0.97±0.22 vs 1.70±0.27,P<0.05;0.97±0.22 vs 2.02±0.16,P<0.01;0.97±0.22 vs 3.42±0.46,P<0.01),且呈现明显的浓度依赖性。

图4 各组小鼠胃组织中GST活性#:与对照组相比,P<0.05;*:与模型组相比,P<0.05;**:与模型组相比,P<0.01
2.4不同浓度北虫草水提物对小鼠胃组织中ADH和ALDH的影响 与对照组小鼠相比,病理模型组小鼠胃组织中ADH与ALDH活性均略有升高(0.44±0.03 vs 0.49±0.01,P<0.05;106.67±13.33 vs 167.33±22.37,P<0.05);与病理模型组小鼠相比,北虫草中、高剂量组小鼠胃组织中ADH活性明显增强(0.49±0.01 vs 0.81±0.09,P<0.01;0.49±0.01 vs 0.74±0.11,P<0.01),低剂量组无明显变化;同时与病理模型组小鼠相比,给药组小鼠胃组织中ALDH活性均升高,且存在浓度依赖性(167.33±22.37 vs 196.33±19.77,P<0.05;167.33±22.37 vs 252.67±41.84,P<0.05;167.33±22.37 vs 262.33±37.85,P<0.01)。

图5 各组小鼠胃组织中ADH活性#:与对照组相比,P<0.05;*:与模型组相比,P<0.05;**:与模型组相比,P<0.01

图6 各组小鼠胃组织中ALDH活性变化#:与对照组相比,P<0.05;*:与模型组相比,P<0.05;**:与模型组相比,P<0.01
3 讨论
SOD是机体抗氧化系统中最重要的酶类之一。生理条件下,胃肠道本身会产生并释放少量氧自由基,上皮细胞中的NADPH等氧化酶也会产生氧自由基和H2O2,此时机体依靠SOD等重要的抗氧化损伤防御系统及时清除体内的氧自由基,防止其达到组织损伤水平,而MDA正是这些自由基脂质过氧化的最终产物,且MDA可导致细胞内蛋白质、核酸等生物学大分子发生交联,产生细胞毒性。因此SOD和MDA被公认为能较好反映机体内自由基变化和氧化损伤的两个重要指标。目前大量meta分析表明酒精可以引起胃黏膜损伤、胃溃疡、胃癌及肝硬化等疾病的发生[12-14],同时最新的研究表明活性氧是乙醇引起黏膜损伤的重要因素之一[13,15-16]。因此,氧化应激损伤是导致以上疾病的关键环节[17]。同时还有研究发现乙醇可以抑制机体抗氧化酶和其他细胞保护蛋白的表达,包括超SOD-1和过氧化还原酶,从而加速ROS的生成[18]。本研究发现给予酒精后小鼠胃组织中SOD活性下降,且MDA含量明显增高,表明酒精对小鼠胃组织已经造成氧化损伤,而北虫草水提物可以提高小鼠酒精损伤后胃组织中SOD活性,并降低MDA含量,且存在明显浓度依赖性,表明北虫草具有良好的抗氧化能力,可以有效降低氧自由基对机体造成的损伤,起到抗氧化损伤作用。
GST是一类具有多种生理功能的蛋白质家族,主要催化各种亲电性化合物与GSH巯基发生共价结合,因此GST在许多外源性、内源性化合物的解毒和代谢中起着重要作用[19-21]。据报道,酒精引起胃组织严重氧化应激过程中,除MDA含量增加外还降低胃谷胱甘肽含量来刺激脂质过氧化[22-24],因此提高GST活性对乙醇导致的胃损伤保护作用至关重要。本研究中发现:与对照组小鼠相比,病理模型组小鼠胃组织中GST活性明显下降,表明短期、高剂量饮酒可使其清除体内有毒物质的能力下降,进而加重胃损伤;而给予北虫草提取物后,其GST活性明显升高,且存在浓度依赖性,表明北虫草可以通过提高GST活性降低乙醇对胃组织的毒性作用。
乙醇脱氢酶(ADH)是机体内乙醇代谢最为重要的酶类之一,可将乙醇氧化成乙醛,主要分布于肝脏组织中。Pestalozzi等人发现ADH也存在于胃肠道中,这表明酒精在进入循环系统前先经过消化系统代谢,此现象被称为乙醇的首过代谢(First pass metabolism,FPM)[25],而Jelski W等人研究发现FPM主要发生在胃组织中[26]。王国祥等人发现长时间摄入乙醇会导致胃肠道组织中ADH 活性下降,因此提高机体胃组织中ADH活性可以减少机体对乙醇的生物利用度,缓解乙醇对肝脏、脑组织等重要组织器官的毒害作用[27]。本研究发现与对照组小鼠相比,病理模型组小鼠其胃组织中ADH活性略有升高,表明短期、高剂量饮酒可以刺激小鼠胃组织,使其ADH活性增强;同时在给予北虫草水提物后,进一步增强给药组小鼠胃组织中ADH活性,表明北虫草水提物可以增强乙醇的代谢,减轻肝脏代谢负荷,降低乙醇对肝、脑等重要组织的损伤。
乙醇经ADH或其他酶类体系氧化成乙醛,乙醛经过乙醛脱氢酶(ALDH)进一步氧化后成乙酸盐,且乙醛已被国际癌症研究机构(IARC)列为人类一类致癌物质,因此,乙醇代谢相关酶类的缺乏或功能失活,尤其是ADH和ALDH,可能会直接影响其致癌作用[28]。国外学者Nagayoshi等人发现,乙醇可以导致ALDH-2基因敲除小鼠胃组织DNA损伤,表明ALDH缺乏可能加速胃癌发生[29]。因此胃组织中ALDH活性对乙醛导致的消化道损伤起到至关重要的作用。本研究发现给予酒精后小鼠胃组织中ALDH 活性增强,且给药组ALDH活性也有所上升,表明北虫草可以提高胃组织中ALDH的活性,加速乙醇代谢中间产物乙醛的代谢,降低乙醇对消化道细胞的毒性损伤作用,减轻胃组织损伤,其作用机制可能与防止DNA损伤及降低炎症反应有关[28]。因此,北虫草提取物可以通过增强胃组织ADH、ALDH 活性,加速乙醇的代谢过程,降低中间代谢产物产生的消化道细胞毒性作用,降低乙醇对肝的毒性作用及负荷。
各组小鼠胃组织病理变化情况发现,高浓度给药组小鼠胃组织损伤情况较模型组小鼠有明显改善;此外实验过程中,病理模型组小鼠在饲养至7~10天时,其进食、进水量明显低于给药组和对照组小鼠,进一步表明北虫草水提物对小鼠胃组织具有一定的保护作用,与上述检测结果相吻合。
综上,北虫草水提物可以提高小鼠酒精性胃损伤模型其胃组织中SOD、GST、ADH、ALDH活性,同时降低MDA含量,且存在一定的浓度依赖性,表明北虫草水提物在降低氧化应激损伤、增强乙醇代谢等方面起到关键作用;同时本研究中采用了宋静静等人的研究成果进行北虫草水提物制备,其水提物中含有丰富的虫草多糖、虫草酸、腺苷和虫草素[8],表明这些活性物质很有可能参与到上述调节机制中,为北虫草活性物质的研究及酒精性胃损伤的预防与治疗提供实验依据,为开发北虫草相关产品奠定基础。

