尖叶石竹蜡质突变体的耐盐生理响应
王金刚,刘建华,王奥夫,龚束芳,乔 坤,周爱民
(东北农业大学园艺园林学院,黑龙江 哈尔滨 150030)
盐和干旱是植物生长发育过程中经常受到的两种环境胁迫,它们均会引起渗透胁迫导致植物失水,从而对植物产生不同程度的危害,严重的渗透胁迫使细胞质中的水分进入细胞外空间引起细胞脱水[6]。表皮蜡质可以在植物表面形成一层疏水蜡被,具有维持水分平衡、防止水分流失的重要功能[1]。研究表明,除气孔外,角质层是控制水分状况的另外一个蒸腾屏障,是水果采收后保持水分含量的一个重要因素[7]。Parsons 等[8]分析了来自世界各地50种辣椒(Capsicum)的果实表皮组成与采后失水率的相关性,结果表明,角质层组成成分的差异导致水分流失的显著差异,并且烷烃的含量和组成是透水性的重要决定因素。表皮蜡质在调节植物非气孔性失水、提高植物的抗旱性方面具有重要作用[9-10]。在遭受干旱胁迫时,拟南芥(Arabidopsis thaliana)叶片蜡质含量显著增加,叶片失水减缓,表明表皮蜡质在介导干旱胁迫中发挥作用[11]。研究表明,盐(NaCl)胁迫处理同样会引起拟南芥叶表皮蜡质的积累[9]。在大麦(Hordeum vulgare)中,蜡质成分作为水分损失的屏障,有助于提高盐胁迫抗性[12]。盐胁迫导致西蒙德木(Simmondsia chinensis)产生生理干旱,表现为水分利用效率和相对含水量的降低,而蜡质沉积增加提高了植物对盐胁迫的耐受性[13]。这些研究说明表皮蜡质在植物应对盐胁迫诱导的渗透胁迫中同样发挥作用。
尖叶石竹(Dianthus spiculifolius)为石竹科石竹属多年生草本植物,具有极强的抗寒和耐旱能力,叶片比较坚韧,耐践踏且成坪致密,栽培养护简单,需水量少,具有较高的观赏和应用价值,是较理想的观赏性草坪草材料。有研究利用甲基磺酸乙酯(ethylmethylsulfone, EMS)对尖叶石竹种子进行了诱变处理[14],经鉴定从诱变后代中获得了一个尖叶石竹高表皮蜡质突变体,并表现出较强的耐旱表型[15]。基于此,本研究对尖叶石竹野生型和蜡质突变体进行耐盐性比较,分析其表皮蜡质与耐盐性的关系,旨在阐明表皮蜡质在植物应答盐胁迫中的重要作用。
1 材料与方法
1.1 试验材料
试验材料为尖叶石竹野生型和蜡质突变体,蜡质突变体的获得和鉴定参阅文献[14-15],两种材料种植于东北农业大学(中国哈尔滨,128.4° E,45° N)校园苗圃内,并于2019 年8 月通过无性扦插方式在园艺温室内培养。
1.2 试验设计
尖叶石竹蜡质突变体和野生型扦插幼苗生长至8~10 cm 时,选取生长健壮、长势一致的幼苗从苗盘移出,用清水洗净根部泥土,置于组培瓶中,用含有不同浓度NaCl 的Hoagland 营养液对幼苗进行盐胁迫处理,NaCl 浓度梯度设置为0、50、100、150、200、250 和300 mmol·L−1,处理时间24 h。另外,用含有200 mmol·L−1NaCl 的Hoagland 营养液分别处理0、3、6、12、24 和48 h。每个处理选取蜡质突变体与野生型幼苗各3 株,处理完成后每株采集3 份中部3~6轮叶片,每份0.1 g,用去离子水冲洗干净,吸干水分,将叶片混合均匀,用液氮冷冻后贮藏于-80 ℃超低温冰箱中待用,对于不能冷冻测量的指标,如光合参数、叶绿素荧光参数,则在处理时间到达后及时测定。
1.3 测定指标及方法
1.3.1 相对含水量、叶片持水力测定
测量方法参考Seo 等[9]。
1.3.2 抗氧化酶活性及渗透调节物质含量测定
丙二醛(malondialdehyde, MDA)含量采用硫代巴比妥酸显色(thiobarbituric acid, TBA)法测定[16],超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxide, POD)、过氧化氢酶(catalase, CAT)活性和可溶性糖含量的测定分别采用SOD、POD、CAT 和植物可溶性糖含量测试试剂盒(苏州科铭生物技术有限公司)测定。可溶性蛋白含量采用考马斯亮蓝G-250 染色法进行测定[17],游离脯氨酸含量采用茚三酮显色法进行测定[18]。
1.3 统计学方法 采用SPSS 20.0软件进行统计分析。计数资料采用率或百分比表示,两组比较用卡方检验。正态分布的计量资料描述采用两组比较采用t检验;非正态分布的计量资料描述用中位数(M)和四分位数间距(P25-P75)表示,组间比较采用秩和检验。多因素分析采用Logistic回归分析,计算其OR值,P<0.05为差异有统计学意义。
1.3.3 光合参数的测定
每个处理选取尖叶石竹蜡质突变体与野生型各3 株,每株选取相同部位、相同大小的3 个叶片,用LI-6400 便携式光合作用测定系统(美国LI-CoR公司),于上午10:00-12:00 测定盐处理后的尖叶石竹蜡质突变体与野生型叶片光合参数,净光合速率(net photosynthetic rate, Pn)、气孔导度(stomatal conductance,Gs)、蒸腾速率(transpiration rate, Tr)、胞间CO2浓度(intercellular CO2concentration, Ci)由仪器自动测得。测定时温度(27 ± 2) ℃,光照强度1 300 μmol·(m2·s)−1,CO2浓度(380 ± 10) mg·L-1,每叶测定3 个值,计算平均值。
1.3.4 叶绿素荧光参数测定
分别取不同时间、不同浓度盐处理后的尖叶石竹扦插幼苗各3 株,暗适应20 min 后,用叶绿素荧光分析仪(IMAGING-PAM,kinetic 模式)测定植株叶绿素荧光参数。先照射检测光[< 0.05 μmol·(m2·s)−1],随后照射饱和脉冲光[8 000 μmol·(m2·s)−1],测定PSⅡ的最大光化学效率(Fv/ Fm),每个处理重复3 次。
1.3.5 脱蜡处理后盐胁迫下相对含水量和持水力测定
将尖叶石竹蜡质突变体与野生型幼苗叶片分别在氯仿(CHCl3)溶液中浸泡30 s 进行脱蜡处理,然后再将脱蜡的幼苗分别在0、50、100、150、200、250和300 mmol·L−1浓度NaCl 溶液中处理24 h,测定脱蜡材料叶片的相对含水量和持水力,测定方法同上。
1.4 数据分析
应用Excel 2010 对数据进行整理,并用Origin 2018 绘图,应用SPSS 19.0 结合Tukey 分析方法,对同一处理下尖叶石竹蜡质突变体与野生型之间的生理指标数值进行差异显著性分析(P< 0.05)。
2 结果与分析
2.1 尖叶石竹野生型和蜡质突变体的耐盐表型和水分含量的比较
利用不同浓度(0~300 mmol·L−1)的NaCl 溶液对野生型和蜡质突变体扦插幼苗进行了处理。随着NaCl 处理时间的延长及处理浓度的升高,相比于野生型,蜡质突变体的叶片萎蔫程度更小,叶片褪绿现象更弱。当NaCl 浓度在200 mmol·L−1时处理12 d后,蜡质突变体与野生型表型差异最为明显,野生型幼苗已出现干枯死亡现象,而蜡质突变体幼苗颜色基本正常(图1A)。水分含量分析显示两种材料叶片的相对含水量随着处理浓度的升高均呈下降趋势,且在NaCl 浓度为200、250 和300 mmol·L−1时蜡质突变体相对含水量显著高于野生型(P< 0.05) (图1B);而两种材料的叶片持水力则随着处理浓度的增加呈现先升高后降低的趋势,当处理浓度达到150 mmol·L−1时两种材料的叶片持水力达到最高(图1C)。

图1 NaCl 胁迫对尖叶石竹野生型和蜡质突变体生长表型、相对含水量和叶片持水力的影响Figure 1 Effects of NaCl stress on growth phenotype, relative water content, and water retention capacity of the wild-type and a waxy mutant of Dianthus spiculifolius
在不同时间(200 mmol·L−1,0~48 h)及不同浓度(0~300 mmol·L−1,24 h)的NaCl 处理下,蜡质突变体叶片的蒸腾速率普遍低于野生型叶片(图2A 和图2B)。表型和水分指标显示蜡质突变体比野生型具有更高的耐盐性,这可能与其更好的水分保持有关。
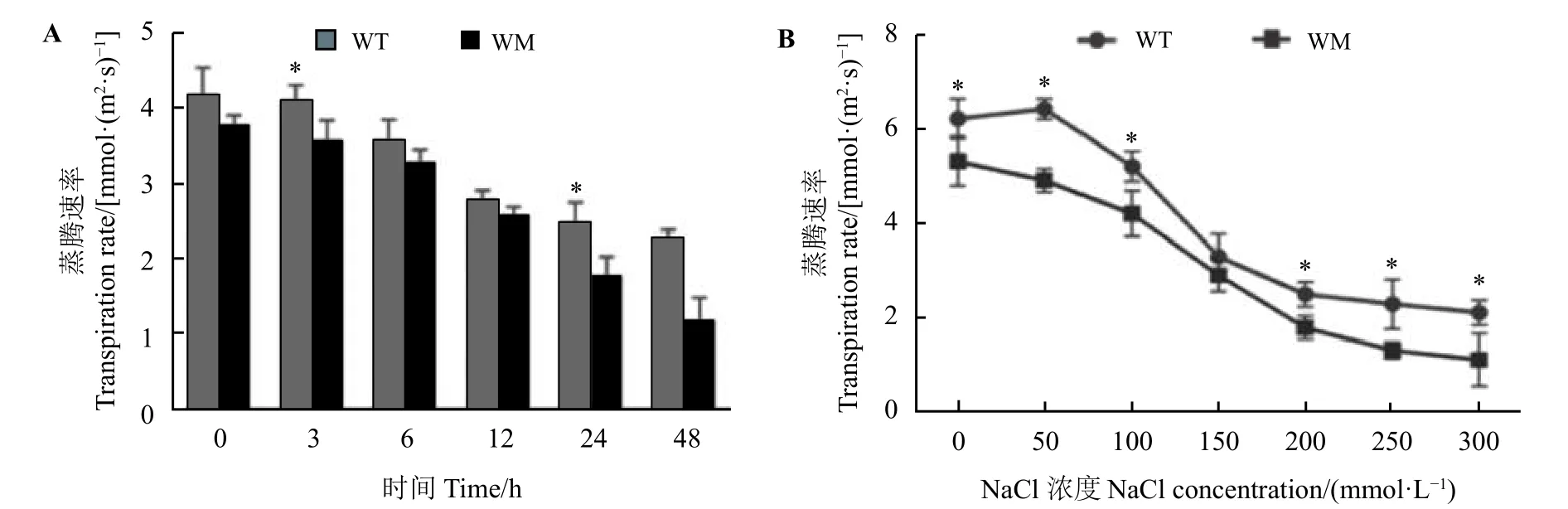
图2 盐胁迫对尖叶石竹野生型和蜡质突变体蒸腾速率的影响Figure 2 Effects of NaCl stress on transpiration rate of the wild-type and a waxy mutant of Dianthus spiculifolius
2.2 尖叶石竹野生型和蜡质突变体叶片的抗氧化酶活性和MDA 含量比较
不同时间NaCl 处理下野生型SOD 活性波动幅度较小,而蜡质突变体中SOD 活性呈缓慢上升趋势。在200 mmol·L−1NaCl 处理0~6 h 内,野生型叶片SOD 活性显著高于蜡质突变体(P< 0.05),而12~48 h 内,两者的SOD 活性无明显差异(图3A)。随NaCl 浓度的升高,两者SOD 活性均呈上升趋势,整体上差异不明显(图3B)。POD 和CAT 活性在不同时间和不同浓度处理下均呈现先上升后下降的趋势,而在不同浓度NaCl 处理下,蜡质突变体叶中两种酶活性普遍高于野生型(图3C−F)。MDA 含量分析显示,在不同时间和不同浓度的NaCl 处理下,蜡质突变体叶中的MDA 含量均显著低于野生型(P<0.05) (图3G 和图3H)。
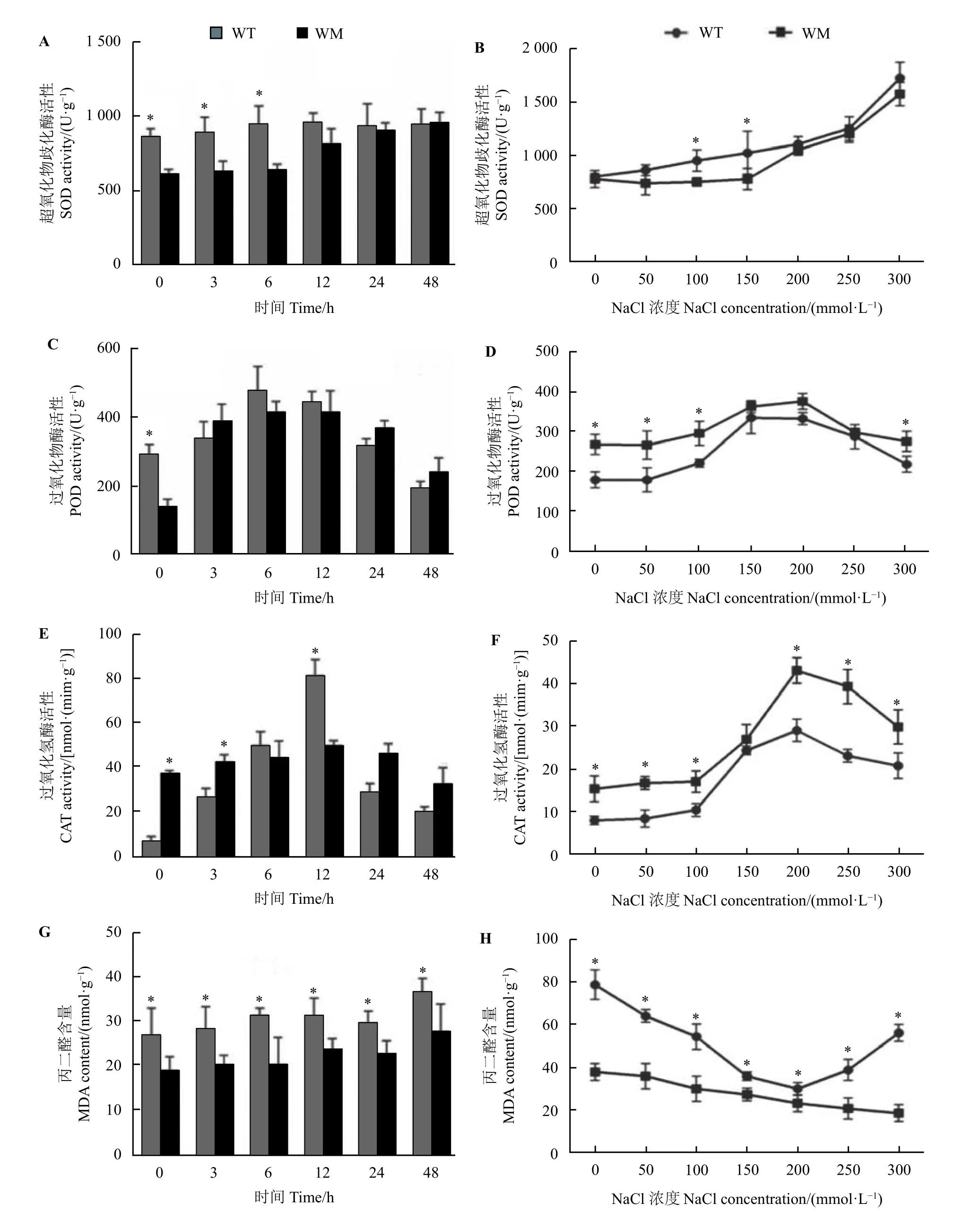
图3 盐胁迫对尖叶石竹野生型和蜡质突变体抗氧化酶活性和丙二醛含量的影响Figure 3 Effects of NaCl stress on the activity of antioxidant enzymes and MDA content of the wild-type and a waxy mutant of Dianthus spiculifolius
2.3 尖叶石竹野生型和蜡质突变体叶片中渗透调节物质含量、光合参数和叶绿素荧光参数比较
在不同时间处理下,两种材料中的可溶性糖和脯氨酸含量随处理时间延长呈先上升后下降趋势,可溶性蛋白含量变化幅度较小,在正常条件和盐处理下蜡质突变体叶中可溶性糖含量均显著高于野生型(P< 0.05) (图4A 和图4B),而在0~300 mmol·L−1NaCl 处理24 h以及200 mmol·L−1NaCl 处理0~24 h下蜡质突变体叶中可溶性蛋白含量则显著低于野生型(P< 0.05) (图4C 和图4D)。在150~300 mmol·L−1NaCl 处理24 h 以及200 mmol·L−1NaCl 处理0~48 h下蜡质突变体叶中脯氨酸含量显著高于野生型(P<0.05) (图4E和图4F)。
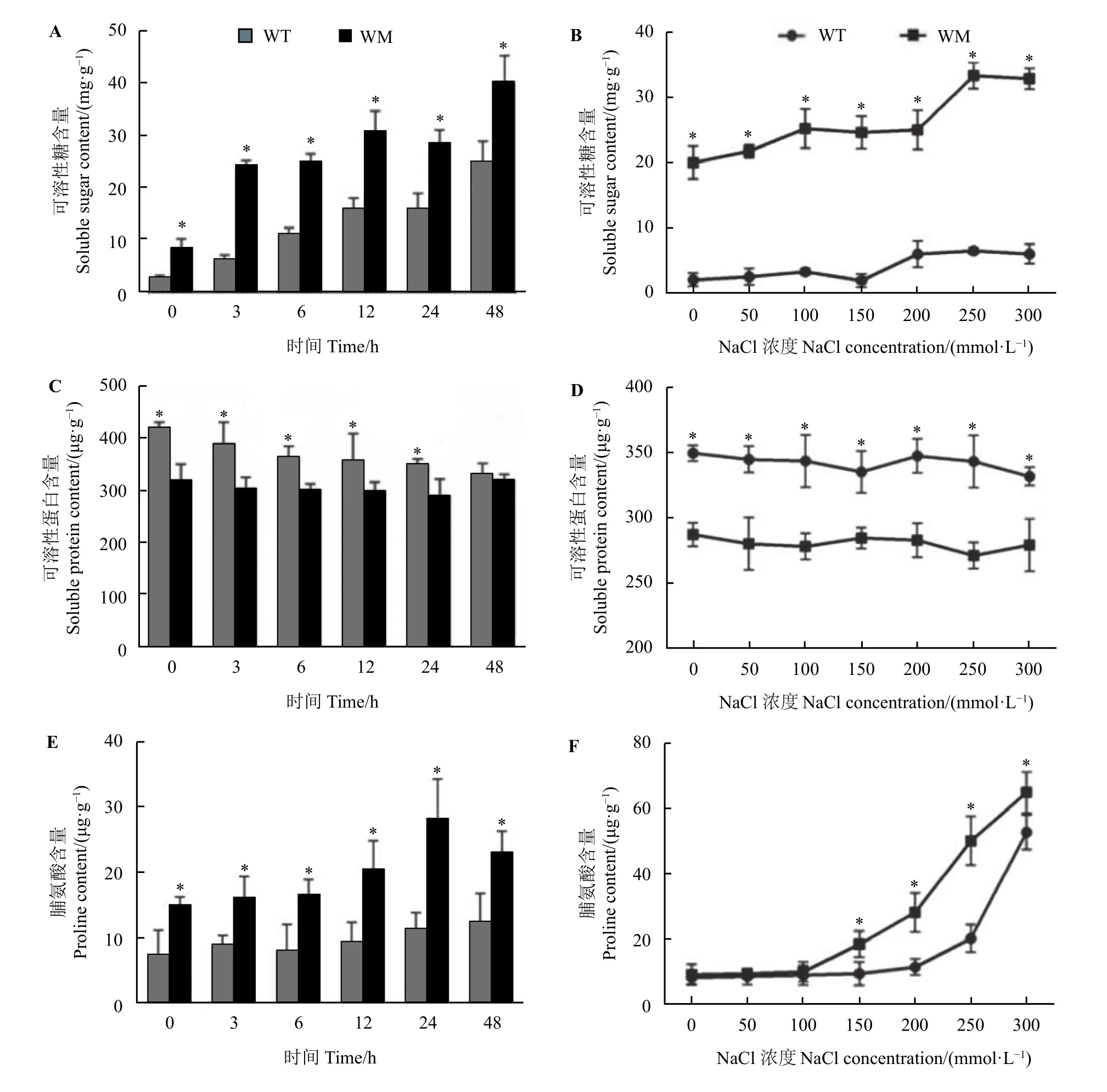
图4 NaCl 胁迫对尖叶石竹野生型和蜡质突变体渗透调节物质含量的影响Figure 4 Effects of NaCl stress on the content of osmotic regulatory substances in the wild-type and a waxy mutant of Dianthus spiculifolius
在50~300 mmol·L−1NaCl 处理24 h 以及200 mmol·L−1NaCl 处理24 和48 h 下蜡质突变体叶中的净光合速率显著高于野生型(P< 0.05) (图5A 和图5B),而在100~300 mmol·L−1NaCl 处理24 h 以及200 mmol·L−1NaCl 处理6~48 h下蜡质突变体叶中胞间CO2浓度显著低于野生型(P< 0.05) (图5E和图5F)。对于气孔导度指标,在不同处理时间(除48 h)上两者无明显差异,而在0~200 mmol·L−1NaCl处理24 h 下野生型的气孔导度下降趋势比蜡质突变体更大,而蜡质突变体叶中气孔导度的下降趋势较缓(图5C 和图5D)。
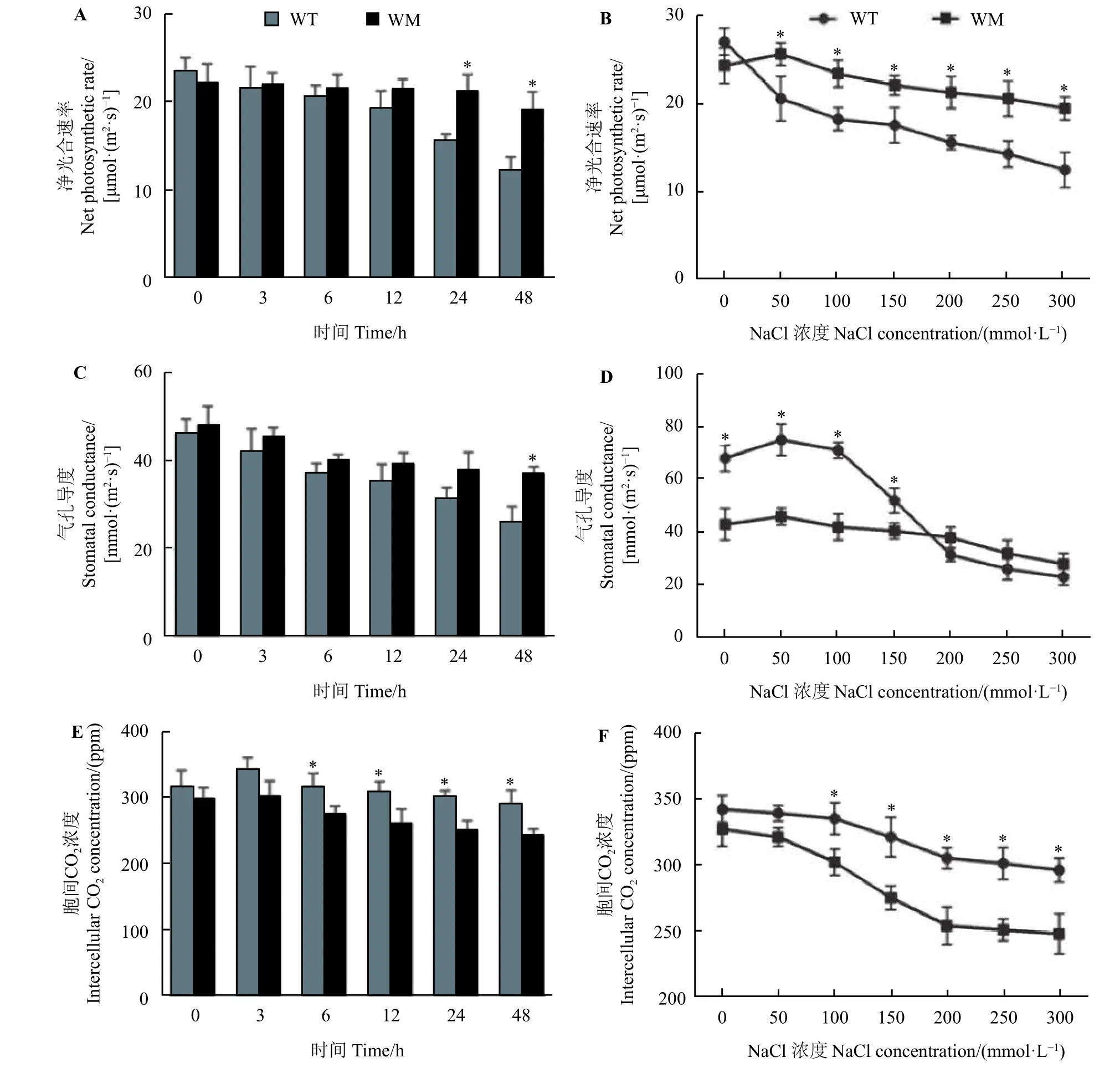
图5 NaCl 胁迫对尖叶石竹野生型和蜡质突变体净光合速率、气孔导度和胞间CO2 浓度的影响Figure 5 Effects of NaCl stress on net photosynthetic rate, stomatal conductance, and intercellular CO2 concentration of the wild-type and a waxy mutant of Dianthus spiculifolius
叶绿素荧光参数Fv/Fm值的变化幅度大小能够反映植物光合作用受抑制程度。NaCl 处理不同时间后,蜡质突变体和野生型叶的Fv/Fm值无明显差异(图6A),而250 和300 mmol·L−1NaCl 处理下,蜡质突变体叶中的Fv/Fm值显著高于野生型(P< 0.05)(图6B),表明在这个处理浓度下,蜡质突变体叶光合能力受盐胁迫抑制的程度更小。

图6 NaCl 胁迫对尖叶石竹野生型和蜡质突变体叶绿素荧光参数的影响Figure 6 Effects of NaCl stress on chlorophyll fluorescence parameters of the wild-type and a waxy mutant of Dianthus spiculifolius
2.4 脱蜡处理后尖叶石竹野生型和蜡质突变体水分含量的比较
为验证表皮蜡质与植物保水能力的关系,对两种材料脱蜡处理,脱蜡后的蜡质突变体与野生型在不同浓度NaCl 胁迫24 h 后,两者叶片相对含水量和叶片持水力变化趋势基本一致,且两者无明显差异(图7A 和图7B),这与脱蜡前两种材料的含水量变化不同,表明表皮蜡质的存在与蜡质突变体叶片保水能力直接相关。
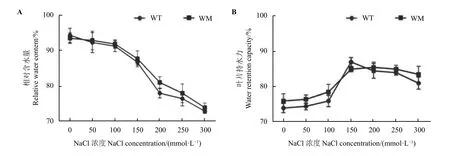
图7 盐胁迫对脱蜡尖叶石竹野生型和蜡质突变体相对含水量和叶片持水力的影响Figure 7 Effects of NaCl stress on relative water content and water retention capacity of the wild-type and a waxy mutant of Dianthus spiculifolius after dewaxing
3 讨论
3.1 植物表皮蜡质与盐胁迫下水分维持的关系
不同环境、不同发育阶段的植物,同时遭受多种生物和非生物胁迫时,表皮蜡质对增强植物在多重胁迫中的耐受性方面有直接作用[1]。盐胁迫可对植物造成生理干旱,而表皮蜡质能够限制水分蒸腾、维持水分含量的稳定。本研究发现在200~300 mmol·L−1NaCl 处理下蜡质突变体的叶片含水量显著高于野生型叶片,而蒸腾速率显著低于野生型叶片。蜡质突变体植株整体上表现出萎蔫程度更小、褪绿程度更弱等表型,说明蜡质突变体叶片在盐胁迫下维持了更低的水分蒸腾而保持了更高的相对含水量,由此表现出更强的耐盐表型。为证明表皮蜡质与水分维持间的直接关系,本研究利用氯仿溶液对野生型和蜡质突变体的叶片进行了脱蜡处理,而处理后的两者叶片在盐胁迫后的相对含水量则无显著差异。这些结果说明蜡质突变体的高表皮蜡质含量是其盐胁迫下维持更高含水量的直接原因。
3.2 植物表皮蜡质对盐胁迫下叶片盐应答生理指标的可能影响
植物通过保护酶系统清除多余的活性氧,尽可能减少由盐胁迫引起的活性氧积累而对其自身的伤害。本研究中,蜡质突变体和野生型叶片在200和250 mmol·L−1NaCl 处理24 h 下的SOD 和POD 活性基本相同,无明显差异,而蜡质突变体叶的CAT 活性在多种浓度的NaCl 处理下均普遍高于野生型叶片。当处理时间过长和盐浓度过高时,POD、CAT 活性则呈现下降趋势,推测可能是由于盐浓度过高,超过植物本身的承受限度,破坏了POD 和CAT 的合成过程或生理活性。MDA 是膜脂过氧化的最终分解产物,其含量可以反映植物遭受胁迫伤害的程度。在野生型中,MDA 含量随着NaCl 处理浓度的增加呈现先降低后升高的趋势,当NaCl 浓度增加到200 mmol·L−1以上时,MDA 含量逐渐升高。这与蜡质突变体则有所不同,其MDA 含量始终维持了相对更低的水平。除保护酶外,渗透调节是植物适应盐胁迫的基本策略之一。可溶性糖、可溶性蛋白和小分子有机化合物作为细胞内的重要组成,具有渗透调节的作用。它们在一定程度上可以维持细胞代谢稳定,保证细胞正常的生命活动。惠红霞等[19]对枸杞(Lycium barbarum)的盐胁迫试验发现,盐胁迫可以抑制光合作用,致使可溶性糖含量上升,这与本研究结果相一致。本研究中,可溶性蛋白和游离脯氨酸含量呈现出不同结果,可溶性蛋白含量随盐浓度升高并无显著变化,说明短时间的盐胁迫不会使尖叶石竹体内的可溶性蛋白发生显著变化,然而叶片游离脯氨酸含量则随着盐浓度升高而升高,这与白榆(Ulmus pumila)[20]、中山杉(Taxodium hybrid)[21]的研究结果一致。然而,并不清楚表皮蜡质含量是如何影响抗氧化酶活性、MDA和渗透调节物含量的,推测其可能受到含水量高低的影响,水分是植物鲜重的重要组分和酶活性及功能的反应介质。
3.3 植物表皮蜡质对盐胁迫下叶片光合参数的可能影响
盐胁迫下,气孔限制和非气孔限制导致植物净光合速率降低。气孔限制是指盐胁迫下植物叶肉细胞光合作用活跃进行,气孔导度和胞间CO2浓度下降,造成细胞净光合速率的下降。非气孔限制是指因叶肉细胞光合能力较弱导致的净光合速率下降,这种情况下气孔导度的下降不会对其造成太大的影响[22]。在暗反应中,酶活性下降导致细胞本身的光合能力下降,这种现象是非气孔限制因素造成的[23]。本研究中,盐胁迫下蜡质突变体叶片的净光合速率显著高于野生型叶片,而且高浓度盐胁迫(250 和300 mmol·L−1NaCl)下蜡质突变体叶片维持了更高的Fv/Fm值,说明蜡质突变体在盐胁迫下维持了更高的光合能力,这可能与其更高的可溶性糖含量直接相关。
4 结论
综上所述,本研究结果显示尖叶石竹蜡质突变体对盐胁迫的抗性强于野生型,这可能与表皮蜡质限制了胁迫过程中水分的损失直接相关,而盐胁迫下更高的水分保持可能又间接影响盐应答生理指标的变化和光合能力。总之,本研究结果对尖叶石竹蜡质突变体在盐胁迫条件下的扩大应用提供了帮助。

