添加不同生物益生菌对木薯块根青贮品质和微生物菌群多样性的影响
潘佳慧,喻 珊,蔡 杰,李开绵,欧文军,王志勇
(1. 热带特色林木花卉遗传与种质创新教育部重点实验室 / 海南大学林学院 热带作物学院,海南 海口 570228;2. 中国热带农业科学院热带作物品种资源研究所,海南 海口 571101)
木薯(Manihot esculenta)为大戟科木薯属植物,其块根富含淀粉且产量较高、价格低廉,可代替玉米(Zea mays)等能量饲料,在我国南方可作为地源性饲料进行综合利用[1]。但鲜木薯块不易保存且含有有害物质氢氰酸,不能直接供动物大量采食。青贮作为一种不消耗能量且能最大限度保存饲料营养的一种低成本处理方法,能够有效去除氢氰酸[2-3],同时青贮可以分解大分子蛋白质及难消化的纤维类物质,提高消化利用率,改善饲料适口性并延长保存时间[4-5],而添加优良的菌种则是提高青贮品质和缩短青贮时间的关键[6-7]。
微生物在青贮过程中发挥了重要作用,其菌群群落构成及丰度变化直接影响到青贮品质,同时青贮品质也受到添加菌剂类型、环境条件等因素的影响[8-9]。因此,研究添加生物益生菌对木薯块根青贮后微生物多样性的影响具有重要意义。目前有关木薯青贮的研究主要集中在木薯茎叶[10-12]、木薯渣[13-15]等木薯副产物的加工利用,缺乏对木薯块根青贮后的微生物变化及其对青贮品质的影响和二者间相关性的分析。市场上微生物菌种及酶发酵剂产品丰富多样,但针对南方地区专用的木薯青贮生物益生菌菌剂种类较少。
因此,本研究以鲜木薯块根为青贮原料,通过添加不同生物益生菌产品和直接青贮的比较试验,利用常规营养分析方法和二代测序法,对木薯块根青贮后的青贮品质和微生物菌群结构及二者间相关性进行分析,筛选适合南方地区鲜木薯块根青贮的添加菌剂以获得高品质木薯青贮饲料,为我国南方地区的无抗饲料生产、健康养殖及木薯综合利用提供实践应用和理论支撑。
1 材料与方法
1.1 试验材料
试验品种选用华南9 号木薯(SC9),2019 年3 月20 日在海南省文昌县田尾基地(110°75′ E,19°61′ N),将长10 cm 左右的木薯种茎下端呈45°~65°斜插种植于垄中5~7 cm,株行距1.0 m × 1.0 m,采取常规田间管理。于2020 年10 月9 日收获木薯块根。将木薯块根(带皮)清洗干净后,用粉碎机(195 汽油机动力)粉碎为1 cm 左右的小块,供青贮后分析使用。青贮材料干物质(dry matter,DM)含量为31.26%,可溶性糖(water soluble carbohydrates,WSC)含量为25.51%,粗蛋白(crude protein,CP)含量为2.33%,中性洗涤纤维(neutral detergent fiber,NDF)含量为14.73%,酸性洗涤纤维(acid detergent fiber,ADF)含量为5.38%。
添加的生物益生菌分别为微生物发酵菌剂(芽孢杆菌、乳酸菌、酵母菌,潍坊生益生物公司)、高效复合菌酶制剂(芽孢杆菌、乳酸菌、酵母菌、酶,中国热带农业科学院生物技术研究所)和生物饲料发酵剂(芽孢杆菌、乳酸杆菌、酵母菌,海南盛旭生物科技有限公司)。
1.2 试验设计
试验以新鲜木薯块根单独青贮作为对照(CK),试验组分别添加微生物发酵菌剂(C1)、高效复合菌酶制剂(C2)和生物饲料发酵剂(C3)共4 个处理,每个处理组3 个重复。严格按照各生物益生菌菌剂的使用方法在样品中加入菌剂,C1在鲜样中的添加量为5 g·kg−1,C2为 1 g·kg−1,C3为 2 g·kg−1,以10 mL·kg−1蒸馏水溶解,CK 组添加等量的蒸馏水。
1.3 青贮饲料制作
以粉碎后1 cm 左右的木薯块根为原料,按处理分组添加不同菌剂后充分混匀,装入30 cm × 20 cm的聚乙烯青贮袋中,每个处理设3 个重复,每袋300 g,用真空打包机抽真空后密封。在室温 (27 ± 3) ℃条件下遮光贮藏。于青贮第30 天后开封进行营养指标、发酵品质及微生物多样性的测定。
1.4 测定指标与方法
1.4.1 青贮饲料营养成分及发酵品质的测定
青贮30 d 后的木薯块根开袋取样,65 ℃烘干48 h,粉碎过0.425 mm 筛,然后进行各指标测定。干物质采用烘干法测定[16];粗蛋白采用凯氏定氮法(海能k1100 全自动凯氏定氮仪)测定[17];可溶性糖采用蒽酮-硫酸法测定[18];中性洗涤纤维和酸性洗涤纤维采用改进后的滤袋分析法用纤维分析仪(SonnenF10 型自动纤维仪)进行测定[19]。
开袋后,将发酵饲料混匀,称取20 g 样品放入250 mL 三角瓶中,加入70 mL 蒸馏水搅拌均匀,在4 ℃恒温冰箱中浸泡 24 h 摇匀后依次用4 层纱布和中速定量滤纸过滤,所得浸提液用pH 计测定发酵饲料的pH[20];氨态氮(ammonia nitrogen, AN)采用苯酚-次氯酸钠比色法测定[21],并计算氨态氮占总氮的比例(ammonia nitrogen/total nitrogen, AN/TN);有机酸采用液相色谱分析仪测定[22],浸提液先后抽滤到10 mL 离心管并使用0.22 μm 尼龙有机滤膜过滤,用岛津LC-20A 液相色谱仪加载Venusil XBP C18 柱(250 mm × 4.6 mm)进行二元梯度洗脱,在15%甲醇与85% NaH2PO4·H2O (pH 2.65,0.1 mol·L−1)中,总流速1 mL·min−1,单次25 min,柱温30 ℃,波长210 nm 下测定乳酸(lactic acid, LA)、乙酸(acetic acid, AA)、丙酸(propionic acid, PA)和丁酸(butyric acid, BA)。
1.4.2 微生物多样性分析
二代测序每组青贮样本按青贮袋充分混合,取3 个重复样品,使用 E.Z.N.ATM Mag-Bind Soil DNA Kit 的试剂盒(OMEGA,美国)提取样品的总DNA,利用前引物341F (ATGCGTAGCCGACCTGAGA)与后引物805R (CGTCAGACTTTCGTCCATTGC)获取细菌 Ⅴ3~Ⅴ4 高变异区16S rRNA 基因。PCR 扩增产物回收纯化利用Qubit3.0 DNA 检测试剂盒对基因组DNA 精确定量,采用Illumina 公司的Tru Seq TM DNA Sample PrepKit 制备测序文库。使用MiSeq测序仪进行2 × 300 bp 的双端测序并对结果进行分析。Illumina HiSeq 测序和结果分析测序及序列物种信息由生工生物工程(上海)股份有限公司协助完成。
1.5 数据处理
使用Excel 2013 进行数据统计及分析,用SPSS软件对所有数据进行单因素方差分析及营养成分和发酵品质指标的显著性检验,用Duncan 法对平均值进行多重比较(P< 0.05)。将各处理组干物质、可溶性糖、粗蛋白、中性洗涤纤维、酸性洗涤纤维、pH、乳酸、乙酸、氨态氮/全氮共9 个指标采用模糊数学的隶属函数理论[23],对其青贮品质进行综合评价。
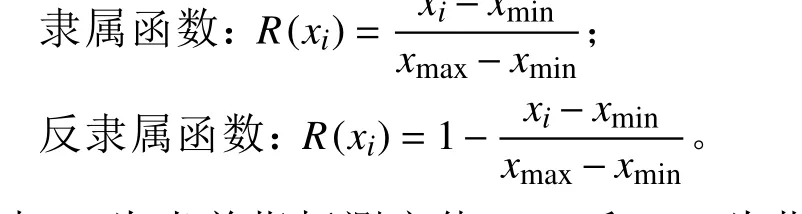
式中:xi为当前指标测定值,xmax和xmin为指标最大值和最小值;其中中性洗涤纤维、酸性洗涤纤维、pH 和氨态氮/全氮为反隶属函数,其他均为正隶属函数。隶属函数均值越大,说明其品质越好。
二代测序得到的PE reads 首先根据overlap 关系进行拼接,区分样本后对序列质量进行质控和过滤,然后进行OTU 聚类(ASV 去噪)分析和物种分类学分析。基于OTU 聚类(ASV 去噪)分析结果,用Usearch、QIIME 以及 Mothur 等软件进行深入的统计学和可视化生物信息学分析,利用R 软件作图。
2 结果与分析
2.1 添加不同生物益生菌对木薯块根青贮营养成分和发酵品质的影响
与CK 组相比,添加菌剂后3 组的干物质均显著提高(P< 0.05) (表1),但3 组间无显著差异(P>0.05);添加菌剂后3 组处理可溶性糖含量与CK 组差异均不显著,但C2和C3组显著高于C1组;C2组粗蛋白显著低于CK 组;中性洗涤纤维各组间差异均不显著;C1和C3组酸性洗涤纤维显著低于CK组,且两组间无显著差异。
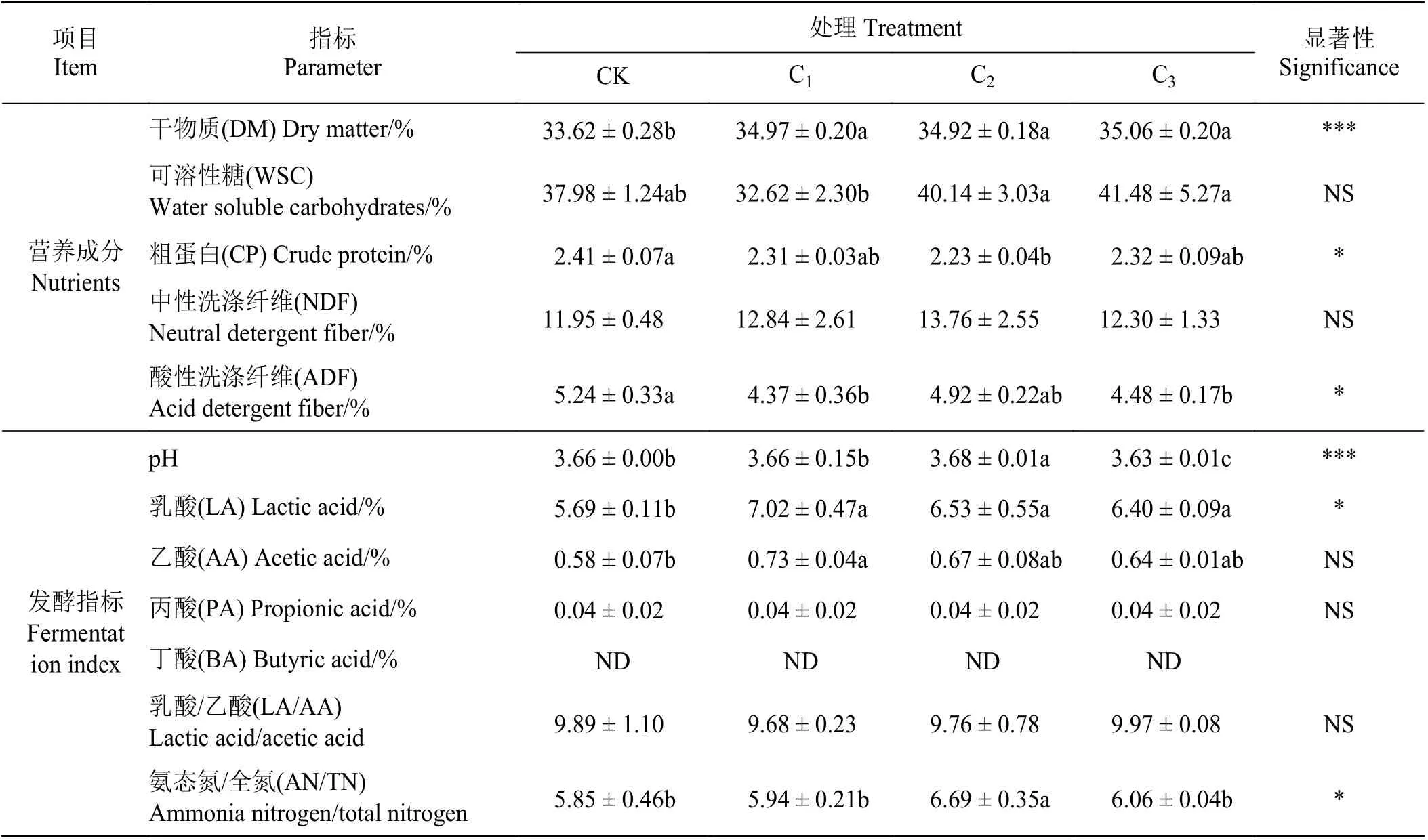
表1 添加不同生物益生菌对木薯块根青贮营养成分和发酵品质的影响Table 1 Effect of adding different biological probiotics on the nutrient composition and fermentation quality of cassava root silage
所有组的pH 均低于4.2,其中C3组显著低于CK 组(P< 0.05),C2显著高于CK 组;添加菌剂的3 组处理乳酸均显著高于CK 组,其中C1组最高,且C1组乙酸显著高于CK 组;乳酸/乙酸各组间无显著差异;所有组均检测到少量丙酸且组间无显著差异(P> 0.05);各组均未检测到丁酸。所有组氨态氮/总氮均小于10%,其中C2组显著高于其余各组。
添加不同生物益生菌后,隶属函数平均值结果(表2)显示,C3理组的综合表现最优,平均值为0.79,C1组表现较优,平均值为0.70,C2组隶属函数值最低,低于CK 组。
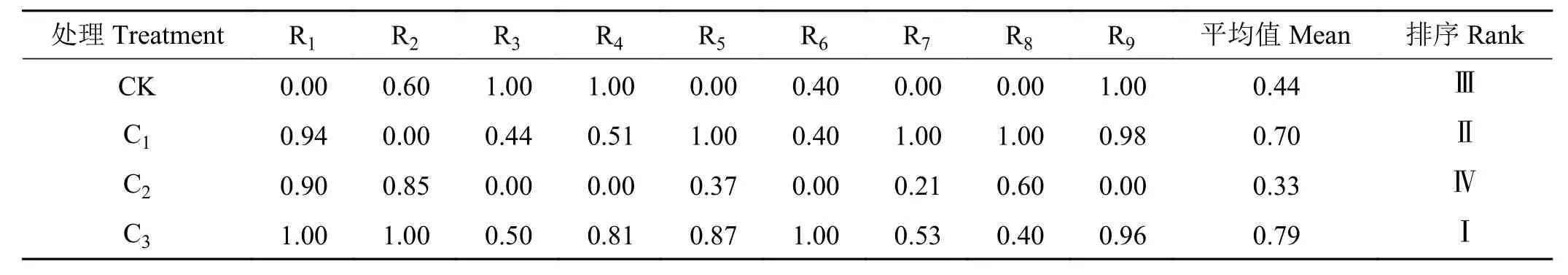
表2 添加不同生物益生菌木薯块根青贮品质的隶属函数值Table 2 Affiliation function values of cassava tuber silage quality under different bio-probiotic treatments
2.2 添加不同菌剂对木薯块根青贮微生物多样性的影响
2.2.1 木薯块根青贮细菌OTUs 基础分析
由木薯块根青贮细菌OTUs 基础分析(图1)可知,4 个处理组共获得174 个OTUs,其中共有的OTUs为146 个,CK 组和C1组独有的均为2 个,C2和C3组均没有独有的,CK、C1、C2和C3组的OTUs 数目分别为165、163、164 和165 个。说明4 组处理间物种分布差异不显著(P> 0.05)。
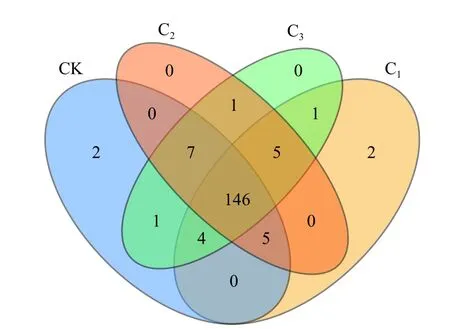
图1 木薯块根青贮物种分布韦恩图Figure 1 Venn diagram of cassava root tuber silage species distribution
2.2.2 Alpha 多样性分析
木薯块根青贮开封后的微生物Alpha 多样性指数(表3)表明,测序样本序列数量较大,且各处理组的覆盖度均大于0.99,说明基本覆盖了样本中所有微生物的核心组成;相较于CK 组,各添加菌剂组的Chao 指数和Ace 指数均有所降低,表明菌群的丰度降低;Shannon 指数的降低和Simpson 指数的增高说明生物菌群多样性降低,其中C3最低;Shannoneven指数的降低说明菌群分配的均匀程度降低。综上可知,添加生物益生菌可以影响木薯块根青贮饲料中微生物群落的多样性。
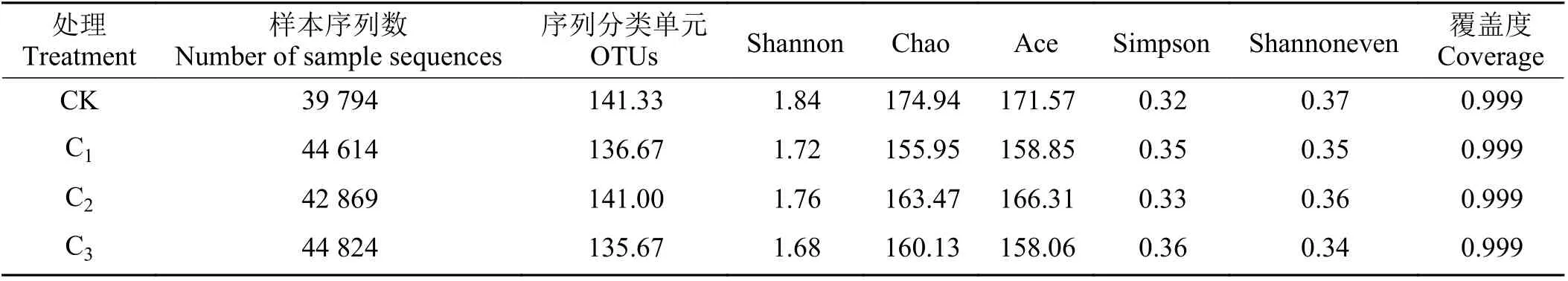
表3 不同样本的Alpha 多样性指数Table 3 Alpha diversity analysis of different samples
2.2.3 木薯块根青贮后基于门水平的微生物群落结构
根据物种注释结果,选取每个样品在门分类水平上丰度大于1%的菌种,分析各青贮样品在门分类水平上相对丰度较高的物种及其比例(表4)。基于门水平的木薯块根青贮微生物群落结构表明,各处理组的优势菌门均为厚壁菌门和变形菌门,这两个在青贮中占主导作用的菌门均占菌群分类的95%以上。除此之外,蓝藻细菌门、未分类细菌及其他细菌有少量存在。C1、C2和C3组厚壁菌门的相对丰度相较于CK 组(76.76%)均显著增加(P< 0.05),分别达到81.20%、79.59%和82.30%,同时变形菌门的相对丰度相较于CK 组(19.12%)分别降低至17.04%、18.63%和15.58%,其中C3组显著降低,且蓝藻细菌门、未分类细菌和其他细菌丰度均显著降低。这说明添加菌剂可提高木薯块根青贮饲料中厚壁菌门所占比例,降低变形菌门所占比例,减少其他细菌产生。
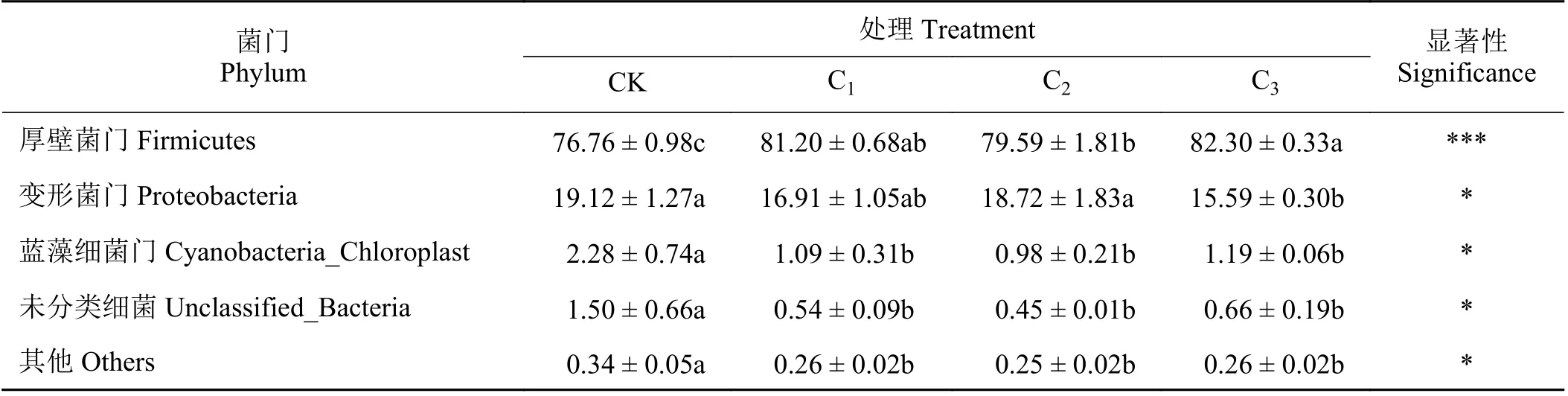
表4 基于门水平的木薯块根青贮微生物群落结构比例Table 4 Microbial community structure of cassava tuber silage based on phylum level
2.2.4 木薯块根青贮后基于属水平的微生物群落结构
根据物种注释结果,选取每个样品在属分类水平上丰度大于1%的菌种,分析各青贮样品在属分类水平上相对丰度较高的物种及其比例(表5)。基于门水平的木薯块根青贮微生物群落结构表明,4 个处理组的优势菌属均为乳杆菌属、乳球菌属、未分类属肠杆菌和沙雷菌属。其中CK 组的4 种菌属相对丰度分别为56.28%、14.10%、10.85%和6.93%;相较于CK 组,各处理组有益菌属表现为乳杆菌属和乳球菌属有所增高,其中C1、C3组乳杆菌属相对丰度显著增高至60.19%、59.33% (P< 0.05);C2、C3组乳球菌属的相对丰度显著增高,分别为16.30%和16.86%;C1组肠球菌属显著降低;链球菌属、明串珠菌属相对丰度各添加菌剂组组均显著降低;魏斯氏菌属相对丰度各间均无显著差异(P> 0.05)。各处理组有害菌属和杂菌表现为:与CK 相比,C3未分类属肠杆菌显著降低,为9.42%;C1、C2和C3组沙雷菌属相对丰度均显著降低,分别为5.45%、6.04%和5.09%;未分类细菌相对丰度均显著降低;不动杆菌属、未分类乳酸杆菌属和其他菌属相对丰度较CK组无显著差异。
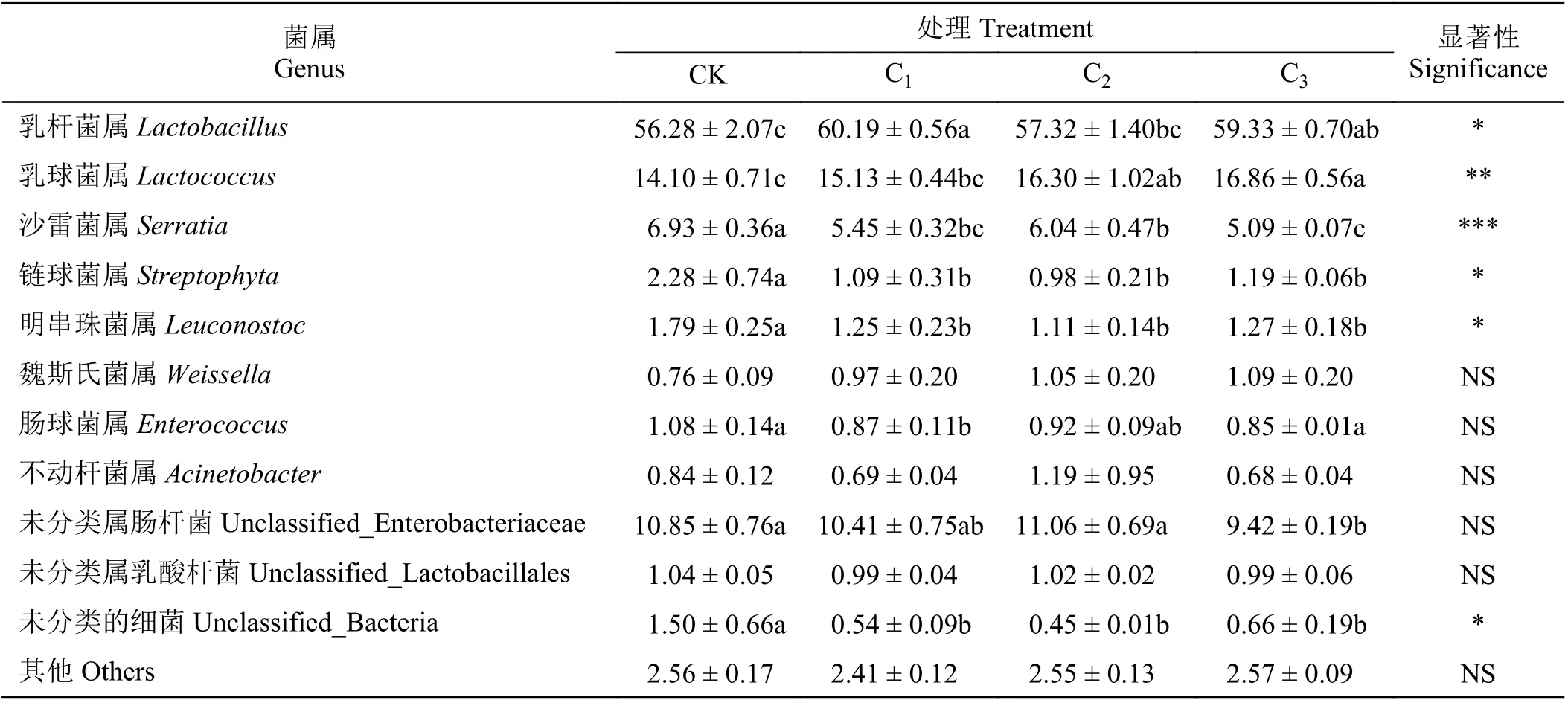
表5 基于属水平的木薯块根青贮微生物群落结构比例Table 5 Microbial community structure of cassava tuber silage based on genus level
2.2.5 微生物多样性与环境相关性
利用Spearman 相关系数研究青贮木薯块根细菌菌群相对丰度与pH、发酵代谢产物之间的相关性,得到两两之间的相关性系数和显著性。基于门水平青贮品质指标与细菌菌群相关性分析热图(图2)表明,厚壁菌门与LA、AA 显著正相关(P< 0.05),与pH、ADF 显著负相关(P< 0.05);变形菌门与pH、ADF 显著正相关(P< 0.05),与LA 显著负相关 (P<0.05);蓝藻细菌门与CP 极显著正相关(P< 0.01)。
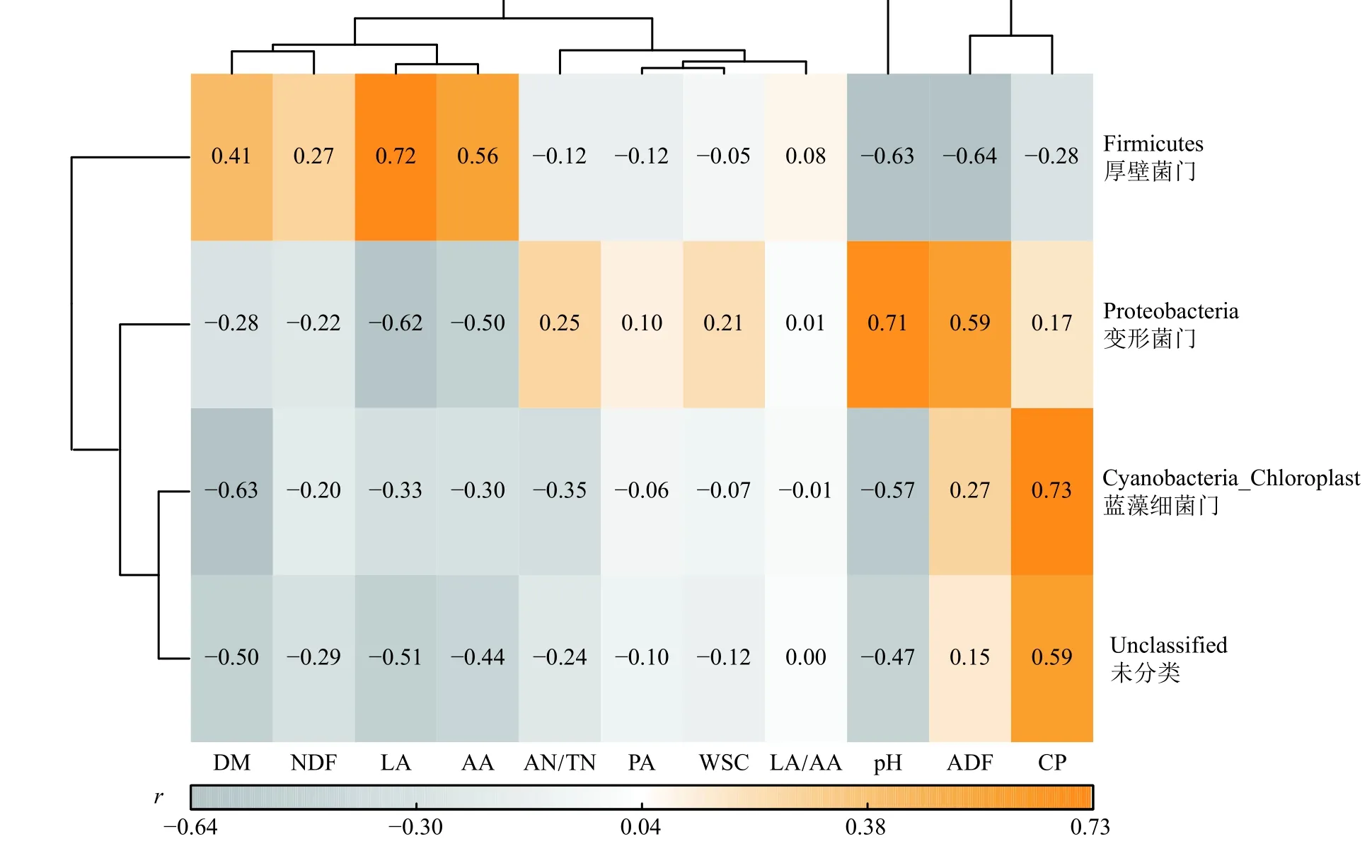
图2 基于门水平青贮品质指标与细菌菌群相关性分析热图Figure 2 Heat map of correlation analysis between silage quality indicators and bacterial flora based on phylum level
基于属水平青贮品质指标与细菌菌群相关性分析热图(图3)表明,乳杆菌属与ADF 极显著负相关(P< 0.01);乳球菌属与环境因子相关性不显著(P>0.05);沙雷菌属与pH 显著正相关(P< 0.05),与ADF极显著正相关(P< 0.01),与LA 极显著负相关(P<0.01);链球菌属与CP 极显著正相关(P< 0.01),与DM 显著负相关(P< 0.05),明串珠菌属与CP 显著正相关(P< 0.05),与DM 显著负相关(P< 0.05);魏斯氏菌属与LA 极显著正相关(P< 0.01),与AA 显著正相关(P< 0.05);肠球菌属与DM 显著负相关(P< 0.05);不动杆菌属与ADF 显著正相关(P< 0.05),与DM 显著负相关(P< 0.05)。
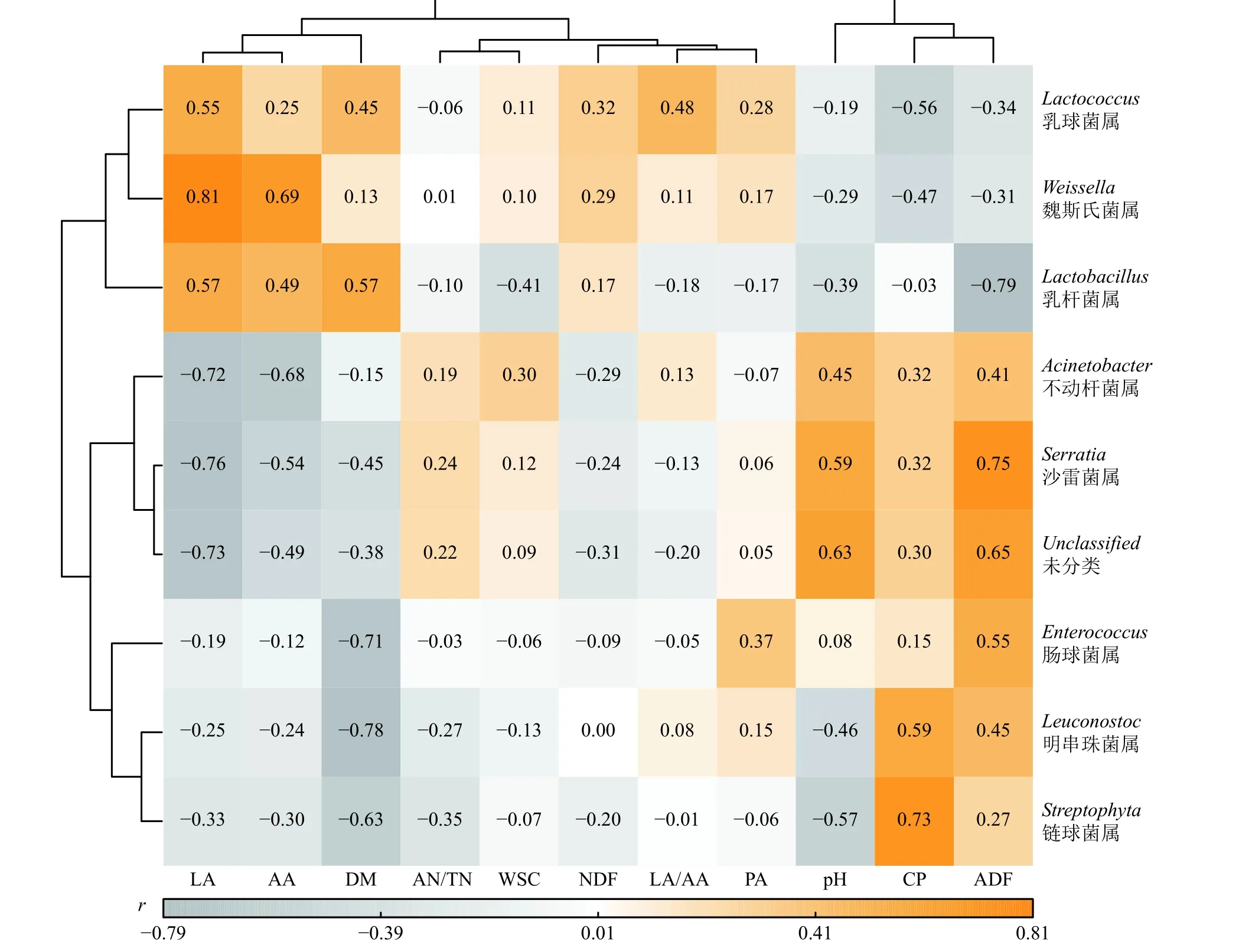
图3 基于属水平青贮品质指标与细菌菌群相关性分析热图Figure 3 Heat map of correlation analysis between silage quality indicators and bacterial flora based on genus level
3 讨论与结论
3.1 添加不同菌剂对木薯块根青贮营养成分和发酵品质的影响
本研究结果显示,添加菌剂对木薯块根的营养品质和发酵效果有着不同程度的影响。与CK 组相比,添加菌剂后3 个处理组的干物质均显著提高(P<0.05),可能是可溶性糖含量较高情况下,添加菌剂加速乳酸产生,减少了有害微生物的含量,从而减少了干物质的损失[24];中性洗涤纤维和可溶性糖含量差异均不显著(P> 0.05),与陆永祥等结果相似[25];C1和C3组酸性洗涤纤维显著低于CK 组(P< 0.05),可能是由于较低pH 构成的酸性环境促进了细胞壁成分的酸解作用[26];粗蛋白的降解会影响饲料的营养价值,C2组粗蛋白含量显著低于CK 组(P< 0.05),可能存在某些降解蛋白的菌促进蛋白的分解[27]。
pH、有机酸是衡量青贮饲料发酵品质的重要指标,品质优良的青贮饲料的pH 在4.2 以下[28]。本研究4 个处理组的pH 均在3.6 左右,发酵效果极好,主要是由于木薯本身干物质、可溶性糖含量较高,添加菌剂后为发酵提供了更多底物,使其迅速发酵产生乳酸降低pH,这与Zhang 等[29]在湿玉米麸皮和玉米秸秆混合饲料中加入乳酸菌菌剂后pH 比不添加任何菌剂的对照组更低的研究结果一致。添加生物益生菌处理组的乳酸相较于CK 组均显著提高(P< 0.05),其中C1组乙酸的含量显著高与CK 组(P<0.05),可能是添加的菌剂主成分均为乳酸菌菌种,提高了产乳酸能力,与王丹丹[30]在玉米(Zea mays)中加入微生物添加剂后乳酸和乙酸有显著增高的研究一致。丁酸是蛋白质和乳酸被腐败菌分解所产生,本研究中各组均未检测出丁酸,只检测到少量丙酸,说明饲料发酵品质较高[31]。乳酸/乙酸始终高于3,说明木薯块根青贮发酵过程主要以同型乳酸发酵为主。本研究中各组氨态氮/总氮均小于10%,达到优质青贮饲料标准,说明氨基酸和蛋白质分解较少[32],而C2组的氨态氮/总氮显著高于CK 组(P<0.05),这主要是由于C2组pH 较CK 组高,导致一些以蛋白质为营养的有害微生物增殖,产生相对较多的氨态氮。
本研究中的4 个处理组青贮品质均达到优质青贮饲料标准,但添加菌剂增加干物质和可溶性糖等发酵底物含量和产酸能力,并降低酸性洗涤纤维等不易被动物吸收的物质含量。将各项营养和发酵指标通过模糊数学隶属函数法进行综合分析,各指标平均隶属函数值越高则代表青贮品质越好,对比可以看出C3组的综合表现最优,其次为C1组,C2组则排在最后,所以在不同生物益生菌处理中的木薯块根青贮品质为C3> C1> C2。
3.2 添加不同菌剂对木薯块根青贮微生物多样性的影响
复杂的微生物在青贮过程中存在共生且有着相互作用的关系,微生物多样性也与青贮品质有着一定的相关性[8]。本研究采用高通量测序技术对添加不同生物益生菌菌剂的木薯块根青贮后微生物菌群群落结构进行分析,从丰度、结构等定义微生物的多样性。从木薯块根青贮细菌OTUs 基础分析结果来看,添加生物益生菌菌剂对物种分布差异影响不大;但由Alpha 多样性分析结果显示,木薯块根青贮后微生物的多样性有一定的影响,相较于CK 组,菌群的丰度、多样性和分配的均匀程度均降低,这种变化可能是受群落里优势菌属的影响,有研究表明优势菌属越丰富,细菌群落的多样性越少[33],Wang 等[34]在辣木(Moringa oleifera)乳酸菌接种青贮饲料中发现乳酸杆菌的高丰度导致细菌多样性低与本研究结果相似。上述结果说明添加生物益生菌菌剂会影响木薯块根青贮饲料微生物群落结构的多样性。
根据高通量测序结果在门水平上分析核心菌群,4 个木薯块根青贮处理组在菌群组成上并无明显差异,各组的优势菌门均为厚壁菌门和变形菌门。其中厚壁菌门与LA、AA 含量显著正相关(P<0.05),与pH、ADF 显著负相关(P< 0.05),是因为厚壁菌门中多是参与乳酸发酵的菌群,其丰度增加提高了产酸能力导致pH 降低,并对酸性洗涤纤维进行进一步分解,从而提高发酵品质[35];本研究中各添加菌剂组的厚壁菌门相对丰度相较于CK 组均显著提高(P< 0.05),其中C3组的相对丰度最高,其次是C1、C2组。变形菌门与pH、ADF 显著正相关(P<0.05),与LA 显著负相关(P< 0.05),是由于变形菌门部分菌属能进行脱氨反应生成氨,使pH 的降低减缓的同时可与乳酸菌竞争可溶性糖的利用,对酸性洗涤纤维的分解和乳酸的产生起到不利的影响,这与闫晶等[36]发现变形菌门与pH 呈正相关关系的研究结果相同;本研究中添加菌剂后变形菌门相对丰度均降低,其中C3相对丰度显著降低,其次是C1、C2组。添加益生菌后蓝藻细菌门和其他菌均显著降低,且蓝藻细菌门与CP 极显著正相关(P< 0.05),说明处理组CP 含量降低可能与此菌门丰度降低有一定关联。综上,添加生物益生菌能增加厚壁菌门所占比例,减少变形菌门和其他菌类占比,与王丽学等[37]在苜蓿(Medicago sativa)中添加乳酸菌改善细菌菌群结构的研究结果基本一致。
在属水平上分析核心菌群,各处理组的优势菌属均为乳杆菌属、乳球菌属,其次为未分类肠杆菌属和沙雷菌属。乳杆菌属是青贮发酵的主要菌属,在pH 较低环境下可以正常生长,是导致本研究中厚壁菌门微生物含量多的直接原因[38],乳球菌属占比相对较少则是因为不如乳杆菌属耐酸[39];魏斯氏菌属为异型发酵乳酸菌,有较强耐酸碱性,与LA、AA 有正相关关系[40];链球菌属和明串珠菌相对丰度在接种生物益生菌后显著减少(P< 0.05),可能是因为生物益生菌的添加导致发酵环境中的酸碱度快速下降,从而降低了这类不耐酸菌属的丰度,这与Yang 等[41]发现低pH 是酸性环境中微生物多样性有限的主要因素和Wang 等[42]在辣木中接种乳酸菌后乳酸杆菌增强,肠杆菌、肠球菌和豌豆球菌的相对丰度则降低等研究结果相似。且CP 含量与其存在正相关关系,DM 与其存在负相关关系,所以C2组的CP 含量降低和3 个处理组的DM 含量增高可能与其丰度降低有关;沙雷菌属及其主要发酵产物与酸化环境有关,或至少在这种条件下维持[43],其与pH 和ADF 正相关,与LA 负相关,是因为沙雷菌属、未分类肠杆菌属和不动杆等菌属等为变形菌门下菌属。正是由于发酵过程中乳杆菌属、乳球菌属、魏斯氏菌属、明串珠菌属、链球菌属、肠球菌属等有益乳酸菌群占据优势主导地位,生成一定量的乳酸使pH 快速下降,才使得上述腐败菌被有效抑制,从而更好地保证饲料的发酵品质。综上,添加生物益生菌菌剂后乳杆菌属、乳球菌属丰度增高,未分类肠杆菌、沙雷菌属丰度的降低,可以说明木薯块根青贮中添加生物益生菌菌剂可以增强产酸能力强的乳酸菌菌种的丰度,且抑制有害菌群的繁殖,从而提高发酵饲料品质。
综上,添加生物益生菌菌剂对木薯块根青贮的营养品质和发酵品质有不同程度的改善,从菌群结构看,添加菌剂能提高木薯块根青贮饲料中厚壁菌门下乳酸菌菌种的丰度,降低变形菌门下沙雷菌属和不动杆菌属等菌属的丰度,减少杂菌产生,且菌群结构的改变与青贮品质指标有一定相关性。其中,厚壁菌门菌群丰度为C3> C1> C2,变形菌门菌群丰度为C3< C1< C2,其各菌门下各菌属菌群丰度与此趋势相同。所以综合各项指标及微生物群落结构的分析判断,木薯块根 青贮效果表现为C3> C1> C2。

