QH菌微生物传感器测试海水BOD的性能
陈 婧,林振景,任汉英
(1.河北环境工程学院,河北 秦皇岛 066102;2.河北农业大学 海洋学院,河北 秦皇岛 066000;3.河北省生态环境监测中心,河北 石家庄 050018)
常用的水质监测指标包括物理性指标、化学性指标和生物性指标三类。生化需氧量是常用的化学性指标之一[1],常用五日生化需氧量表示,简称BOD5[2]。BOD5法耗时较长,操作麻烦[3-4],不适合在线监测。1977年日本科学家Karube.I等[5]首次将微生物用于BOD的测定,开启了BOD快速测定的新领域[6-9]。近30年来,淡水BOD的在线监测和快速测量技术发展迅速,已经有很多的商品化监测仪器。但是由于海水的特殊性,淡水BOD在线监测仪不能适用或者不能直接适用于海水BOD的监测,张悦、李花子[10-11]选用酵母菌制作传感器,测定一个海水样仅需15 min。厦门大学等研制了一种海水BOD光导测定样机,可以快速自动测定海水BOD,但是仪器成本比较高,现在对于海水BOD微生物传感器测定的研究主要是开发新的、更优秀的响应微生物,并提高其性能[12-15]。选择从秦皇岛海水中筛选的QH菌作为响应菌株,组装传感器,研究此传感器是否满足在线监测的需要,并对其性能进行测试。
1 实验准备
1.1 仪器和药品
实验所用仪器设备、药品如表1所示:

表1 实验仪器与药品
1.2 实验试剂配制
① 磷酸盐缓冲溶液:取Na2HP O4·12H2O(m=5.970 0 g)和KH2PO4(m=0.453 9 g),溶于1.2 L水中。配制好的溶液pH值为7.78,含盐度0.234%(w/v)。
② G标液:将葡萄糖和谷氨酸溶液按体积1:1混合均匀,配置G标液。配置好的G标液BOD5恒定,为(198.0±30.5)mg/L。
③ 模拟海水:将上述①溶液加入3% NaCl(w/v),搅拌溶解。
1.3 培养基筛选
牛肉膏0.3 g,蛋白胨1 g,可溶性淀粉0.5 g,琼脂1.5 g,模拟海水100 mL。pH值范围为7.0~7.2。
培养基使用前高温湿热灭菌30 min。
实验室所用试剂均为分析纯(Analytical Reagent,AR)级别以上的试剂,水为石英二次蒸馏水。
1.4 菌源选择
我国海洋面积辽阔,海水质量和环境质量存在一定的差异。为了保证筛选菌株具有一定代表性,实验就近选取了秦皇岛海域海水作为菌株筛选的菌源,进行菌源的筛选。
1.5 初筛方法
按照1.3的方法制备固体培养基,放置在培养皿中,冷却成固体。用稀释接种海水涂布培养皿,在恒温培养箱中30 ℃恒温培养,观察菌落生长情况。
1.6 实验原理
微生物菌液经过多次分离培养后,取定量的湿菌液置于微孔滤膜上,并进行固定。将制备完毕的微生物膜放置于传感器氧电极上,并固定好。以模拟海水为实验底液,恒速鼓入空气进行曝气。向底液中加入一定量的G标液,基于呼吸作用的原理,微生物同化有机物消耗一定量的氧,转化后的电流信号降低。通过比较电流变化的快慢和大小,判定菌种是否可以作为工作菌种。通过测定G标液的量、BOD的浓度和电流的变化值,找到电流和BOD值的线性关系。微生物传感器装置示意图见图1。
1.7 初筛结果
观察从平板上生长出来的菌落,根据菌落的生长状况进行选择。即选择生长在培养基表面的、菌落面积大、生长速度快的好氧菌株为初筛菌。
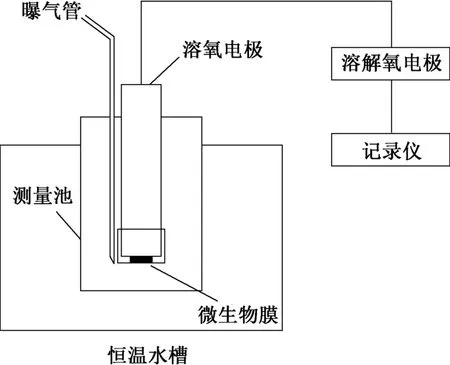
图1 BOD生物传感器装置

表2 初筛结果

图2 QB菌落形态

图3 QH菌落形态
如表2所示,经过初步筛选,选出秦白(QB)、秦红(QH)菌性能菌落面积较大,生长速度达到要求,可以作为下一步性能测试的菌株。将筛得的这2株菌分别进行纯化培养,显微观察确定为纯种后,转接于斜面冰箱内保存。首先选择秦红(QH)菌进行性能测试,以下的研究结果均是针对秦红(QH)菌。
1.8 微生物固定化
QH菌菌悬液离心(转速6 000 r/min,离心5 min)→实验试剂③(配置方法如前所述)洗涤2次 →按比例混合湿菌体与辅料 →置于两个相同的醋酸纤维素膜间,并固定。
1.9 微生物膜的保存
实验用微生物膜可以批量制作,保存方法如下:
短期存放:固定化微生物膜可放实验试剂①中浸泡。
长期存放:置于4 ℃冰箱中,再次使用需要进行微生物复活。
2 实验仪器和方法
2.1 传感器的组装
此传感器的工作系统主要由恒温水浴箱、自制恒温水槽、CX8000曝气装置、测量池(容积为80 mL)、SJG-203A溶解氧分析仪和记录仪组成。将制备好的实验中微生物膜置于氧电极上,并固定完毕。
2.2 实验方法
以实验试剂③为底液(50 mL),恒温,恒速鼓气。待电流稳定后加入实验试剂①,观察电流表的变化及反应的时间。通过ΔI(电流变化量)确定BOD值。
3 实验结果
3.1 实验条件的确定
3.1.1 温度的确定
在27~38 ℃范围内改变测试溶液温度对传感器的响应性能进行了测试,测试曲线如图4所示。由图4可见,温度在32~35 ℃范围内,微生物活性最高,响应信号最大。确定实验的最佳温度是32 ℃。

图4 温度对传感器响应影响曲线
3.1.2 pH值的确定
在pH值为6~10范围内,实验传感器的响应情况,不同pH值对实验的影响曲线见图5。由图5可知,pH值在6.8~9.2范围内对传感器没有任何影响,确定实验pH值为7.2。

图5 pH值对传感器响应影响曲线
3.1.3 盐度的确定
向实验试剂①添加0~6%的NaCl,用来考察盐浓度对QH菌活性的影响程度,结果如图6所示。由图6可知,当NaCl浓度在2%~4%之间时,响应信号减小很多,说明盐度在2%~4%这个范围内对传感器响应影响很大。为了改善盐度对传感器的影响程度,采用1%~5%盐度梯度的培养基逐步驯化烟红菌,其结果如图6所示:
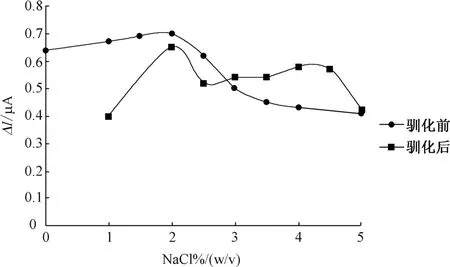
图6 驯化前、后盐度影响曲线
3.2 传感器响应性能测定
3.2.1 平行性实验
在32℃、pH值为7.2的条件下,每次加入等量的GGA溶液(2 mL),连续7次测定传感器的响应情况,实验结果如表3所示,7次实验的相对标准变偏差为4.52%。
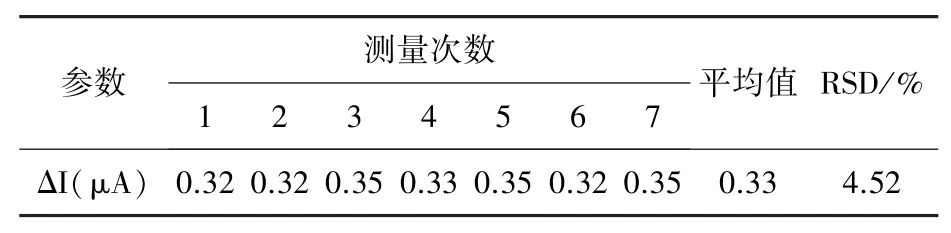
表3 传感器平行实验
3.2.2 响应曲线的测定
在33 ℃下,对传感器的线性进行了测试,结果如图7所示。测量标准曲线线性方程为y=0.061 2x-0.001 3,线性相关系数为0.992,线性响应范围0~42 mg/L。
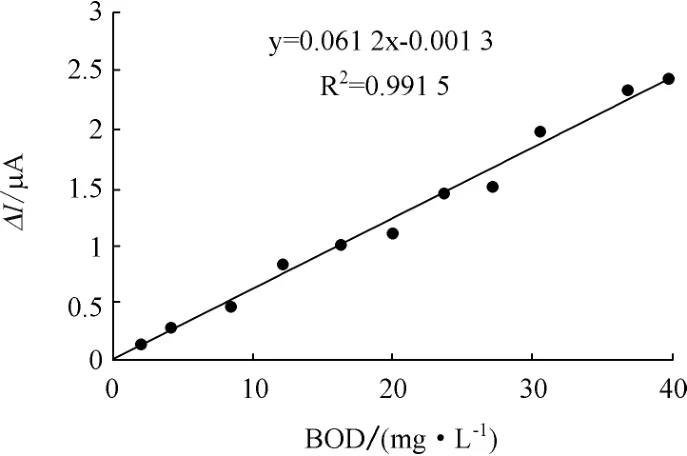
图7 响应线性
3.2.3 重金属离子影响分析
选取Zn2+、Cu2+、Pb2+、Hg2+这4种重金属离子,考察了重金属离子对传感器响应的影响程度。Zn2+、Cu2+、Pb2+、Hg2+这4种重金属离子影响曲线分别见图8、图9、图10、图11。
从图9中可以看出,锌离子浓度在0.8 mg/L以下时,对传感器响应影响较小,浓度在1 mg/L以上时,对响应产生明显抑制作用。从图11可以看出,铅离子从开始加入后即产生明显抑制作用。图10和图12都表明传感器响应信号随着金属离子的浓度增加呈现先增大后逐渐减小的变化趋势。说明这些重金属离子为低浓度时,对微生物的生理代谢有刺激作用,为高浓度时对微生物的生理代谢有抑制作用。

图8 锌离子影响曲线
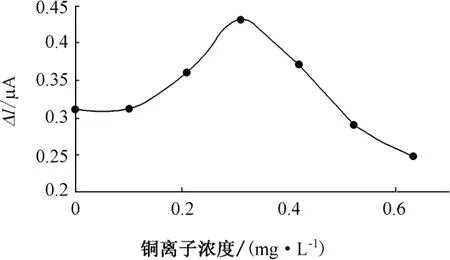
图9 铜离子影响曲线
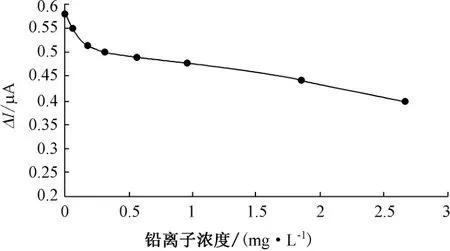
图10 铅离子影响曲线
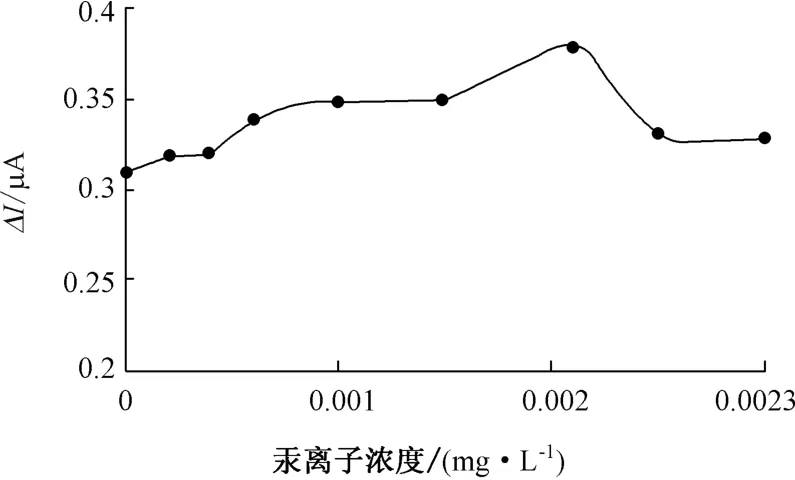
图11 汞离子影响曲线
3.2.4 加标回收率实验
取海水样做加标回收率实验,结果见表4:

表4 加标回收率试验
3.2.5 对照实验
用本实验方法、文献[15]的传感器及传统BOD5法测定同一份青岛海水,结果见表5。结果表明,QH菌微生物传感器法与传统BOD5法有很好的相关性,比文献[15]的传感器测量的误差小。

表5 BOD传感器与BOD5法的对照实验
3 结论
用秦皇岛海域海水作为菌株筛选的菌源,经过初步筛选,秦白(QB)、秦红(QH)菌性能菌落面积较大,生长速度达到要求,本研究是用QH菌作为性能测试的菌株,组装传感器,测试出传感器测试模拟海水BOD的最佳实验条件,包括温度、pH值,在最佳实验条件下测试响应曲线,并测试传感器的性能。实验结论如下:
(1)传感器最适宜工作温度为33 ℃,pH值为7.2,传感器标准曲线线性方程为y=0.061 2x-0.001 3,线性相关系数为0.992。
(2)盐度测试表明,QH菌驯化之前,对盐度变化比较敏感,响应不稳定,在驯化之后,能够在含盐2.5%~4.5%的底液中稳定响应。
(3)在重金属影响实验中,当锌离子浓度在0.8 mg/L以下时,对传感器响应影响较小,浓度在1 mg/L以上时,对响应产生明显抑制作用。铜离子的微量存在使传感器响应值略有增加,当浓度达0.3 mg/L时,响应值达到最大。随着铜离子浓度的继续增加,信号值开始下降。铅离子对传感器响应的抑制作用较为明显,当浓度在0.25 mg/L时,响应信号立即降低了原响应信号的1/6。汞离子浓度在0.002 mg/L时,传感器响应信号逐渐增大到最大。而后,随着汞离子浓度增大,响应信号开始下降,说明微量汞离子的存在对QH菌有激活作用。对海水的两次加标回收率实验,回收率分别为118%和91.7%。测定海水BOD与BOD5相对误差为-17.8%,有很好的相关性。QH菌可以用于海水BOD在线监测使用。深入研究选定响应菌株的生理习性和对有机物的降解特性,确定菌株的适用水质类型,提高响应的灵敏度和响应范围是下一阶段研究的重点。

