超声引导联合内镜监视建立经皮肾镜工作通道*
王大明 丁德茂 谢栋栋 叶青林 张志强 于德新
(安徽医科大学第二附属医院泌尿外科,合肥 230601)
经皮肾镜碎石取石术(percutaneous nephrolithotomy,PCNL)是治疗直径>2 cm或复杂性肾结石的首选方法[1],穿刺定位和通道建立为手术成功的关键环节。我国多采用超声引导,优点是可分辨周围脏器、判断血流、精准穿刺和无辐射,缺点是易受血块、积液等因素干扰,对残留结石判断困难,复杂性肾结石建立多通道较困难,缺乏对通道建立过程中的监控[2]。应用球囊扩张器建立通道可实现超声全程监控,但对于无积水肾或肥胖患者,可能发生通道过浅“短扩张”和扩张过程中通道移位,导致出血等严重并发症[3]。如何在复杂性肾结石的治疗中使用超声引导安全、有效地建立工作通道,仍需探索。2020年5月~2021年7月,我院在超声引导下行内镜联合肾内手术(endoscopic combined intrarenal surgery,ECIRS)治疗23例复杂性肾结石,对球囊扩张建立通道的全程进行监控,探讨其安全性和有效性。
1 临床资料与方法
1.1 一般资料
本组23例,男20例,女3例。年龄22~72岁,(53.5±13.4)岁。BMI 19.3~33.5,(25.9±3.6),其中4例BMI>28。腰痛17例,体检发现6例,均行泌尿系CT和KUB检查,诊断复杂性肾结石[4],左侧15例,右侧8例;完全鹿角形结石3例,部分鹿角形结石11例,马蹄肾合并肾结石1例,肾结石合并脊柱侧弯畸形1例,孤立肾肾结石2例,肾结石伴BMI>28 4例,肾上盏结石1例(脾脏和结肠遮挡,穿刺空间较小);肾结石长径20.4~53.5 mm,(34.3±7.4)mm;肾结石表面积400.6~1203.1 mm2,(653.4±198.9)mm2;累及肾小盏数目≥3个17例,<3个6例。Guy分级[5]:Ⅱ级3例,Ⅲ级17例,Ⅳ级3例。S.T.O.N.E.评分[5]:7分7例,8分10例,9分5例,10分1例。均有肾积水,轻度13例,中度8例,重度2例。尿路感染(尿白细胞>39/μl)19例,其中尿培养阳性3例(1例大肠埃希菌,1例金黄色葡萄球菌,1例产气克雷伯菌),其余均为阴性。合并高血压9例,高血压和糖尿病5例,脊柱结核1例。
病例选择标准:复杂性肾结石,排除身体严重畸形无法摆放体位、严重心肺功能不全、凝血异常等。
1.2 手术方法
全麻,改良俯卧分腿位[6,7]。手术由2位泌尿外科医生同时进行,一位行PCNL,另一位行经尿道逆行手术。将手术床升高并头部降低与水平线呈30°角。经尿道逆行置入输尿管镜,寻及患侧输尿管口,放置亲水性导丝,输尿管镜沿导丝进入输尿管上段后退出,沿导丝逆行放置输尿管软镜鞘(12/14F),输尿管软镜逆行进入肾盂,检查肾盏及结石分布,结合超声确定最佳穿刺肾盏(术前CT检查评估,盏颈宽度适宜,能够最大程度清除结石的肾盏)。在超声引导下经皮穿刺靶肾盏,内镜监视下观察穿刺针进入肾盏,超声结合内镜引导穿刺针在肾盏乳头中心进入。在超声和内镜引导下,将3.5F J形尖端导丝置入肾盏(图1A)。在超声和输尿管软镜的连续实时监控下,用10F筋膜扩张器沿导丝预扩张,再沿导丝放置球囊扩张器(Bard,美国)(图1B),扩张器的尖端进入肾盏后,注水使压力达到25 atm(1 atm=101.325 kPa),球囊扩张器完全扩张(图1C),沿球囊放置24F鞘(图1D),鞘在内镜监视下进入肾盏。球囊取出后,将24F鞘留作工作通道,肾镜下应用第五代EMS超声或气压弹道碎石。对于肾镜无法寻及的结石,输尿管软镜可将结石移至肾镜视野,也可直接采用钬激光碎石。输尿管软镜结合超声检查各盏是否有>4 mm的残余结石,放置6F输尿管支架管和16F肾造瘘管。
记录经皮肾镜通道建立时间(从超声和输尿管软镜开始评估观察至工作鞘成功放置)和数量、内镜监视情况(完全监视和部分监视)、总的手术时间,术后评估手术完成情况。
术后当天、第1天复查血常规、肾功能,记录术后并发症,根据Clavien-Dindo严重程度分级[8],作为安全性指标。术后第3天和1个月复查腹部平片和CT评估结石清除率(stone free rate,SFR),术后1个月CT检查无结石和残留结石直径<4 mm为结石完全清除[9],作为有效性指标。
2 结果
23例均顺利完成手术,通道一次建立成功,无通道建立失败,输尿管软镜完全监视建立通道19例(图1),4例在部分监视下建立(不能看到肾盏全貌)(图2)。单通道22例,双通道1例,24个通道建立时间4~11 min,(7.0±1.7)min。手术时间25~140 min,(76.8±26.6)min。术后住院时间3~7 d,(5.0±1.3)d。
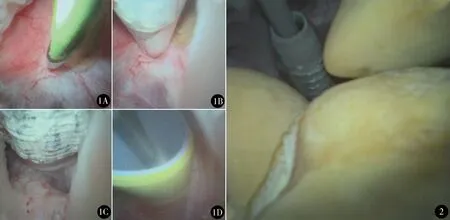
图1 内镜监视穿刺和扩张全过程:A.3.5F J形尖端导丝置入;B.球囊扩张器置入;C.球囊扩张器完全扩张;D.24F鞘置入 图2 内镜部分监视通道建立过程
术后一期SFR 91.3%(21/23);2例结石残留,其中1例下盏残留结石长径17 mm,1个月后行超微肾镜碎石取石术成功,另1例下盏残留结石长径5 mm,无需再次手术。
术后第1天血红蛋白(118.6±11.6)g/L,与术前(123.8±22.7)g/L无显著差异(配对t检验,t=1.438,P=0.164);术后第1天血肌酐(101.3±25.6)μmol/L,与术前(96.1±21.3)μmol/L无显著差异(配对t检验,t=-1.578,P=0.129)。术后4例并发症,Clavien-Dindo Ⅰ级2例,均为轻度出血,保守治疗;Ⅱ级2例,术后高热、寒战,加强抗感染等治疗治愈。无Ⅲ级及以上严重并发症。
3 讨论
对于复杂性肾结石的PCNL,通道建立为手术成功的关键环节。超声联合X线建立经皮肾镜工作通道可集中两者优势,既避免血块、气泡、肾周积液的干扰,有利于残石的识别,提高通道建立的成功率,又能减少透视辐射时间[2]。ECIRS技术使顺行和逆行技术相结合,为复杂性肾结石提供良好的治疗方案[10],也为通道建立提供新的思路:内镜引导经皮肾镜通道的建立。Grasso等[11]1995年报道对7例重度肥胖、首次经皮肾镜通道建立失败者在逆行输尿管软镜和透视引导下成功建立通道。Kawahara等[12]2012年报道仅用输尿管软镜辅助逆行肾造瘘,穿刺针经输尿管软镜从肾盏反向穿出皮肤,但由于肾盏空间小,无法准确控制穿刺角度,失败率较高。此后,透视引导联合内镜监视建立经皮肾镜工作通道的技术得到发展,与单纯透视引导相比更安全有效,还可以缩短透视时间,减少多次透视的需要,降低手术早期终止或二次手术的风险[13]。随着超声引导在PCNL中的兴起,Alsyouf等[14]2016年报道在内镜和超声引导下建立经皮肾镜工作通道,避免使用透视。
目前建立经皮肾镜通道的器械主要为筋膜扩张器和球囊扩张器。球囊扩张器虽然费用较高,但在安全性和成功率方面优于筋膜扩张器,与筋膜扩张器相比,避免逐级扩张,是沿肾盏垂直方向横向扩张,基本一步法建立通道,可缩短通道建立时间,扩张过程中对通道损伤的血管持续压迫,出血量较少[15]。球囊扩张器是目前超声唯一可以基本全程监控的扩张器。本研究结合ECIRS技术和球囊扩张器特点,采用超声引导联合内镜监视球囊扩张建立经皮肾镜通道,治疗23例复杂性结石取得成功,包括孤立肾、严重肥胖、肾脏畸形、周围脏器遮挡导致穿刺空间狭小等特殊类型肾结石。利用该技术可以达到从皮肤至肾内完全可视化,全程实时监控,使穿刺针从肾盏乳头处进入集合系统,避免损伤叶间动脉,减少大出血的风险[16]。在球囊置入和扩张过程中监控,避免置入球囊扩张器和鞘时肾脏位置移动或扩张过程中球囊回退造成通道建立失败[17,18],相较于传统超声定位增加了肾内的视野,有利于穿刺和扩张精确到位。本组23例24个通道无建立失败,未出现短扩张或扩张过深,术后第1天血红蛋白较术前无显著差差异,2例术后少量暗红色出血,考虑肾盂黏膜损伤,保守治疗止血,未出现活动性大出血。输尿管软镜可协助肾镜寻找结石,借助取石网篮移动结石,钬激光直接碎石,对经皮肾镜无法寻及的结石,尤其对于穿刺平行盏内结石,避免经皮肾镜工作鞘过度摆动造成出血,提高SFR。本组一期SFR 91.3%,1例后期行超微肾镜碎石取石术,完全清除,另1例无需再次手术。ECIRS技术可准确判断肾结石清除状态,减少对术后CT的依赖,术后残余结石的主要决定因素是初始结石大小[19]。在防止感染方面ECIRS也有较大优势,输尿管软镜鞘和经皮肾镜工作鞘互为引流通道,避免高压冲洗时肾盂内压力过高和灌注液外渗,降低术后感染的风险。本组2例术后高热寒战,加强抗感染治疗治愈,未出现脓毒血症等严重并发症。
尽管本研究显示超声引导联合内镜监视建立经皮肾镜工作通道安全有效,适用于肥胖、无积水肾、孤立肾、肾脏畸形及出血风险较大的复杂性肾结石,但并不适合所有患者,如合并输尿管狭窄、畸形、结石严重梗阻等。另外,对于完全鹿角形结石,肾盂和肾盏的空间较小,不可能实现完全内镜监测,本组完全鹿角形结石3例,部分鹿角形结石11例,其中4例输尿管软镜无法监视穿刺肾盏的全貌,内镜仅能监视导丝和扩张器的尖端。我们的经验是,对于上述情况选择超声影像中距离最短的盏穿刺,采用亲水导丝或斑马导丝引导,其头端可在肾脏黏膜表面与结石间隙中进入肾盂,以方便内镜监视,必要时在输尿管软镜下钬激光击碎穿刺肾盏的结石,暴露穿刺肾盏乳头。本研究不足之处是的样本量较少,无对照组,今后将纳入更多病例,分析影响超声引导联合内镜监视球囊扩张建立经皮肾镜工作通道的危险因素,结合设备的发展,使该技术更加成熟。
总之,超声引导联合内镜监视球囊扩张建立经皮肾镜工作通道在复杂性肾结石治疗中效果良好,一次性建立通道的成功率高,通道建立安全、有效,在提高结石清除率和预防并发症方面具有明显优势。
——可重复性或一次性输尿管软镜孰优孰劣?

