腹腔镜经胃切除近贲门或幽门胃肿物8例*
钟克力 李明伟 丁顺凯 李 方 夏利刚 王立生
(深圳市人民医院 暨南大学第二临床医学院 南方科技大学第一附属医院胃肠外科,深圳 518020)
胃黏膜下肿物病理性质包括平滑肌瘤、胃肠间质瘤、神经内分泌肿瘤等间叶组织来源的肿瘤,其中胃肠间质瘤约占61.8%[1]。随着内镜和腹部CT检查的普及,越来越多的胃黏膜下肿物在较小的状态下就被发现。由于胃黏膜下肿物的病理性质和恶性程度通过CT和内镜无法获得精准判断,推荐对肿瘤进行完整切除[2~4]。较小的胃黏膜下肿物可以内镜切除,较大的胃体或胃底黏膜下肿物可以通过腹腔镜技术切除[5]。但对于特殊部位如胃底贲门周围、幽门旁等胃黏膜下肿物,尤其肿瘤直径>3 cm、胃腔内生长的肿物,过去往往采用近端胃切除或远端胃大部切除[6]。1995年Ohashi[7]提出腹腔镜经胃切除(laparoscopic intragastric resection,LIGS)治疗早期胃癌,该术式逐渐被胃肠外科医生用于处理胃黏膜下肿物[8~10]。2018年3月~2019年10月,对胃镜切除困难的贲门(6例)和幽门(2例)附近黏膜下肿物,我们采用普通腹腔镜器械行腹腔镜经胃手术完成肿物局部切除,无需内镜辅助定位,均获成功,报道如下。
1 临床资料与方法
1.1 一般资料
本组8例,男3例,女5例。年龄34~68岁,平均51.1岁。1例因黑便行胃镜检查,其余7例无特异性临床症状,其中4例以上腹饱胀不适、2例体检、1例2年前有贲门肿物手术史行胃镜检查。胃镜均提示局部黏膜下隆起,贲门5例,近贲门1例,幽门2例,均为单发;1例黑便患者肿物表面存在黏膜凹陷和溃疡,病理活检为炎症,其余7例局部黏膜光滑,无充血,未行组织活检;均行超声内镜检查,提示肿物位于黏膜下胃壁肌层,2例贲门附近肿物和1例幽门管肿物侵及胃壁浆膜,超声内镜下测量肿物直径1.0~4.0 cm,平均2.6 cm。消化内科认为内镜黏膜下隧道技术切除(submucosal tunnel endoscopic resection,STER)或内镜黏膜下剥离(endoscopic submucosal dissection,ESD)手术困难,转入我科。完善全腹增强CT等检查,明确肿物位置,排除肿瘤远处转移。
纳入标准:①位于胃贲门附近或者幽门附近的黏膜下肿物,内镜医师判断内镜下切除困难,常规开腹手术或腹腔镜手术会影响贲门、幽门功能;②肿物直径<4 cm;③肿物胃腔内生长,或瘤体大部分位于胃腔内。
排除标准:①胃癌和淋巴瘤等恶性肿瘤;②术前检查发现远处转移;③术中探查发现腹腔广泛粘连,无法完成腹腔镜手术。
1.2 手术方法
气管插管全麻,“人”字位,术前放置导尿管,无需胃管。脐孔下缘10 mm观察孔,建立气腹,气腹压力同常规腹腔镜手术(10~13 mm Hg),探查腹腔。根据术前影像学和胃镜检查资料大致明确肿物位置,在左上腹距离胃大弯最近处置10 mm trocar,超声刀在胃大弯胃前壁切开小口进入胃腔,10 mm trocar置入胃腔;若单trocar操作切开胃壁困难,可以在剑突下备做胃内手术的操作孔处置5 mm trocar,协助切开胃壁。胃内供气后腹腔镜下见胃腔膨胀,胃腔气压设定10 mm Hg左右。胃内压过高时,胃内气体会通过胃壁trocar孔溢出到腹腔,故脐孔观察孔的trocar要间断放气减压;同时,由于胃腔内气体可以自动溢出,所以无需阻断十二指肠或空肠来防止远端肠道进气。胃腔膨胀后将腹腔镜插入胃腔探查肿物位置,根据肿物位置确定胃体2个5 mm操作孔位置(图1)。
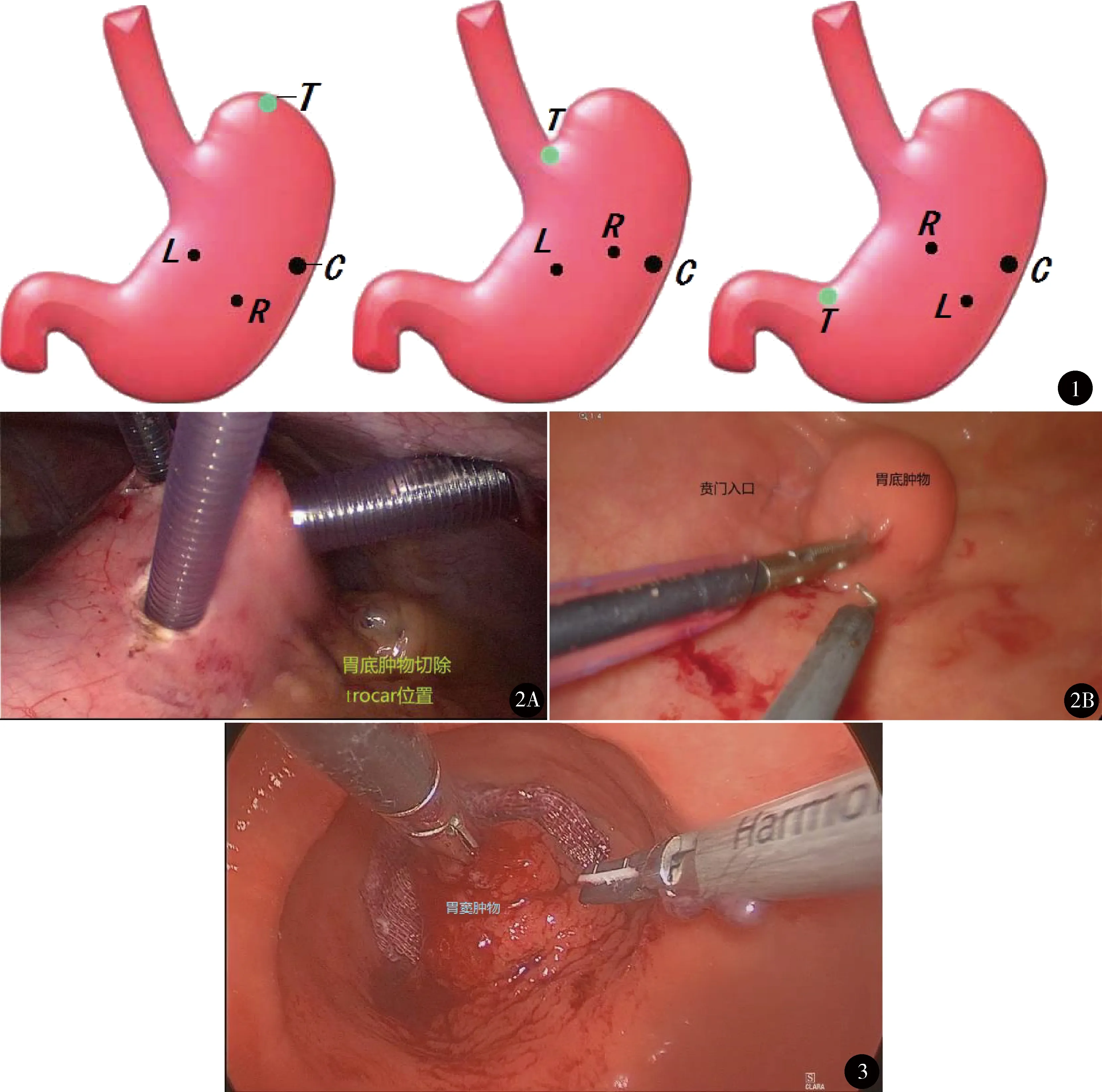
图1 胃壁trocar布局:T-肿瘤;C-观察孔;L-左操作孔;R-右操作孔图2 胃底肿物切除:A.trocar位置(10 mm为观察孔,2个5 mm为操作孔);B.切除术中 图3 胃窦肿物切除
在胃腔内用超声刀或电钩在距离肿物边缘0.5 cm处切开黏膜,沿肿物边缘切开胃壁黏膜下层和肌层,完整切除肿物(图2、3)。创面彻底止血,倒刺线全层缝合胃内创面。3个胃壁trocar孔单层间断缝合。第1例和第2例术中放置胃管和腹腔引流管,术后48 h拔除胃管,术后72 h拔除腹腔引流管,其余6例均未放置胃管和腹腔引流管。未放置胃管者术后第1天即可进食流质,如无异常,术后第2~4天开始进食半流质饮食,可出院。
2 结果
术中见肿物均为膨胀性生长,边界清晰,8例均顺利完整切除肿物,其中2例发现肿物旁存在多个子灶位于胃壁肌层,一同完整切除。1例有开腹贲门肿物切除术史,术中腹腔粘连,行松解术,暴露全部贲门和胃体。5例肿瘤位于为贲门齿状线旁,1例位于贲门旁3 cm处,2例位于幽门管内。无中转开腹或常规腹腔镜手术。手术时间60~130 min,平均99 min,术中出血20~50 ml。术后住院3~8 d,平均6 d。无并发症发生。术后诊断胃肠间质瘤5例,平滑肌瘤1例,神经内分泌瘤1例,炎性肉芽肿1例。
8例电话和门诊随访22~39个月,平均31个月,无吞咽困难、消化道出血和呕吐等并发症,行胃镜和全腹增强CT检查未发现贲门和幽门狭窄,无局部肿瘤复发和腹腔转移。
3 讨论
腹腔镜下切除胃黏膜下肿物多采用胃楔形切除术,游离肿物所在的胃壁后,用直线切割闭合器离断肿物旁胃壁,切除肿物和部分胃壁,将肿物完整切除,达到无瘤要求[11,12]。但对位于贲门旁和幽门附近等特殊部位的胃黏膜下肿物,腹腔镜下完整切除肿物,同时要避免损伤贲门和幽门功能,存在相当难度。如果上述特殊部位的肿物瘤体中心位于胃腔内,腹腔镜下无法准确判断肿瘤边缘,还需要依靠内镜指引识别肿物边缘,没有内镜支援时无法采用腹腔镜完成这类肿物切除。对于贲门附近的黏膜下肿物,可以采用STER[13],技术上对内镜医生要求较高,仅限于少数医院开展,而且对于肿物大小存在一定的限制。对于幽门部位的肿物,如果肿物侵犯胃壁全层,内镜下切除肿物和全层胃壁亦需要高超的内镜技术,术中容易出血;幽门近小弯侧肿物,内镜下切除全层胃壁,容易损伤胃周网膜血管或胃右血管,造成腹腔大出血,我们曾参与消化内科类似病例的抢救,故该部位肿物内镜下切除难度高。鉴于上述理由,要精准切除上述特殊部位的胃黏膜下肿物,不合适采用常规腹腔镜和内镜手术。我们从2018年开始采用LIGS治疗消化内科无法处理的特殊部位胃黏膜下肿物8例,由于术前CT和内镜描述胃肿物大小、位置、肿物中心腔内生长等信息全面,术中无需内镜辅助,全部采用常规腹腔镜手术器械,顺利完成肿物精准切除,术后无胃漏、消化道或腹腔出血、切口感染、腹腔脓肿等并发症发生,随访无肿物腹腔内种植、复发。LIGS除能精准切除胃肿物、最大限度保留贲门和幽门功能等特点外,尚存在如下优势:①气腹压充盈胃腔,可以提供常规腔镜器械操作空间,使胃腔内缝合创面和止血较为方便。②胃腔内空间大,高清和超高清腹腔镜能提供清晰手术视野,无需内镜辅助,便于肿物精准切除,最大限度避免贲门和幽门功能损伤,相对较大的肿物同样可以完成胃腔内切除。③能提供腹腔内和胃腔内双视野,如果肿物附近和腹腔内存在粘连,常规腹腔镜在处理完局部粘连后,依然可以完成肿物切除;如果腹腔内发生出血或副损伤,腹腔镜器械在腹腔内同样可以处理,增加安全性。④主要手术医生为术者和扶镜手,只需2人即可完成手术,在急诊等手术人员不足的条件下亦可顺利完成。
LIGS采用常规腹腔镜器械完成手术,术中存在trocar容易从胃壁滑脱等问题,导致手术时间延长。随着手术经验的积累和手术技巧的提升,该困难相信能够被克服。

