左甲状腺素钠对孕中期亚临床性甲状腺功能减退症患者血清鸢尾素水平、血脂及凝血功能的影响
邓文娟 宁改君 王 静 左丽娟
1.河北北方学院附属第一医院内分泌科,河北张家口 075000;2.河北北方学院附属第一医院妇产科,河北张家口 075000
妊娠期临床甲状腺功能减退症作为妊娠期妇女内分泌性疾病之一,对孕产妇、胎儿及新生儿的生长发育带来极大健康风险[1-2]。临床上,亚临床性甲状腺功能减退症(subclinical hypothroidism,SHT)较为常见[3],SHT 的发生率占所有甲状腺功能减退症的90%以上[4]。鸢尾素是一种与糖脂代谢疾病密切相关的肌肉因子,近年来已被用作代谢性疾病的新诊疗靶点[5]。相关研究表明,SHT 患者的血清鸢尾素水平均明显高于甲状腺功能正常者,且SHT 患者血清鸢尾素水平与血清促甲状腺素(thyroid stimulating hormone,TSH)水平有独立相关性[6]。本课题组前期研究提示,血清鸢尾素水平对于妊娠期甲状腺功能减退症患者的临床诊断具有一定价值[7-8]。此外,有学者研究表明,妊娠期SHT 患者存在一定的脂代谢和凝血功能异常的临床表现[9]。既往关于左甲状腺素钠对妊娠期SHT 患者甲状腺功能及妊娠结局的影响研究已有报道[10-12],但其对孕中期SHT 患者血清鸢尾素水平、血脂水平及凝血功能的影响尚不清楚。本研究旨在探究左甲状腺素钠对孕中期SHT 患者的血清鸢尾素水平、血脂水平及凝血功能的影响,从而为孕中期SHT 患者的临床诊治提供新思路和依据。
1 资料与方法
1.1 一般资料
本研究经河北北方学院附属第一医院(以下简称“我院”)伦理委员会审核并批准通过(伦理审批号K2018146),所有研究对象对本研究知情。选取2018 年6 月至2020 年6 月于我院定期接受孕期检查、围产期保健的SHT 患者80 例,按照随机数字表法将其分为研究组和对照组,各40 例。纳入标准:①单胎妊娠;②年龄≥20 岁;③孕龄<10 周前即完成首次孕期甲状腺功能检查。排除标准:①合并多囊卵巢综合征、糖尿病、高脂血症、肿瘤等疾病;②合并严重心、肺、肾等脏器功能不全;③合并原发性高血压及重度子痫前期;④有精神疾病史;⑤既往有甲状腺功能减退症病史,诊断为SHT[13]。两组一般资料比较,差异无统计学意义(P >0.05),具有可比性。见表1。
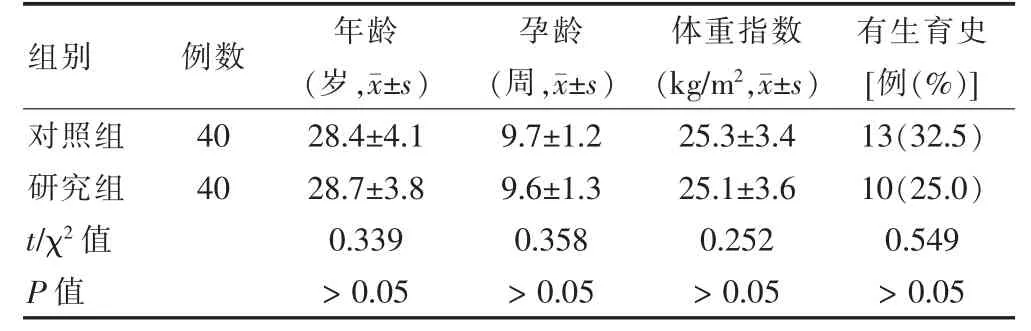
表1 两组一般资料比较
1.2 治疗方法
对照组仅给予含碘饮食指导,避免放射性物质接触等常规性治疗建议,并嘱患者定期对甲状腺功能与胎儿发育情况复查,治疗4 周后检测各项指标。观察组给予清晨空腹顿服左旋甲状素钠片(德国默克公司,生产批号:600UFE,规格:50 μg/片,100 片/盒)治疗,并避免与妊娠时补充的铁、维生素等剂同服。给药剂量则依据患者血清TSH 水平检测结果进行制订和阶段调整,剂量控制在12.5~100.0 μg/d,1 次/d,每周复查1 次,治疗4 周后检测各项指标。
1.3 观察指标
分别检测两组治疗前后的如下指标:①甲状腺功能指标及血脂指标,抽取两组清晨外周静脉血清样本后,利用7600 型全自动血液生化分析仪(日本日立公司)对血清TSH、游离甲状腺素(free thyroxine,FT4)、甘油三脂(triglycerides,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平进行检测,检测用TSH(生产批号:52368101)和FT4(生产批号:52813203)的试剂盒为罗氏公司生产,TG(生产批号:AUZ8790)、TC(生产批号:AUZ8183)、HDL-C(生产批号:AUZ8542)和LDL-C(生产批号:AUZ8357)试剂盒为贝克曼库尔特公司生产。②血清鸢尾素水平,采集两组清晨外周静脉血后,使用酶联免疫吸附试验进行血清鸢尾素水平的检测,检测过程严格遵照血清鸢尾素CUSABIO 公司提供的试剂盒(生产批号:HC5734)使用说明。③凝血功能指标,采集两组清晨外周静脉全血样本,利用CS 5100 型全自动血凝仪(日本Sysmex 公司)对凝血酶原时间(prothrombin time,PT)、活化部分凝血酶时间(activated partial thrombin time,APTT)和纤维蛋白原进行检测,检测用PT(生产批号:565701A)、APTT(生产批号:562608A)和纤维蛋白原(生产批号:565061)试剂盒为德国西门子公司生产。
1.4 统计学方法
采用SPSS 22.0 对所得数据进行统计学分析,计量资料采用均数±标准差()表示,组间比较采用t检验,计数资料采用例数和百分率表示,组间比较采用χ2检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组治疗前后血清甲状腺功能指标、鸢尾素水平比较
治疗后,研究组TSH、鸢尾素水平低于治疗前,且研究组TSH、鸢尾素水平低于对照组,差异有统计学意义(P <0.05)。见表2。
表2 两组治疗前后血清甲状腺功能指标、鸢尾素水平比较()
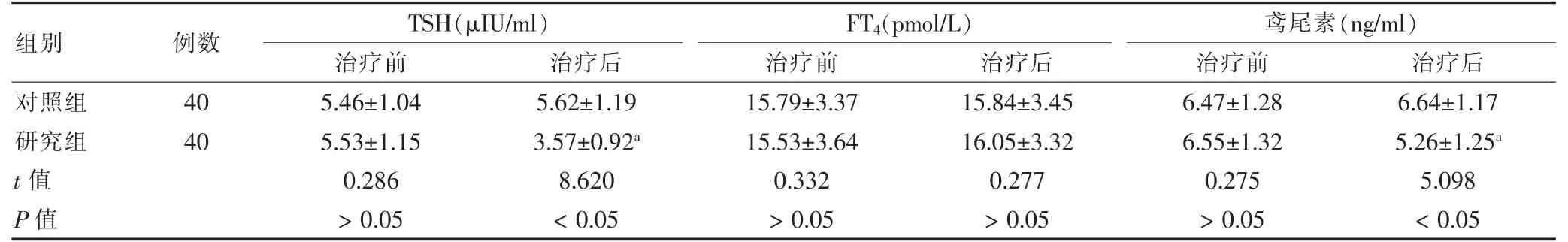
表2 两组治疗前后血清甲状腺功能指标、鸢尾素水平比较()
注:与本组治疗前比较,aP <0.05。TSH:促甲状腺素;FT4:游离甲状腺素
2.2 两组治疗前后血脂指标比较
治疗后,研究组TG、TC、LDL-C 高于治疗前,HDL-C 高于治疗前,且研究组TG、TC、LDL-C 低于对照组,差异有统计学意义(P <0.05)。见表3。
表3 两组治疗前后血脂指标比较(mmol/L,)
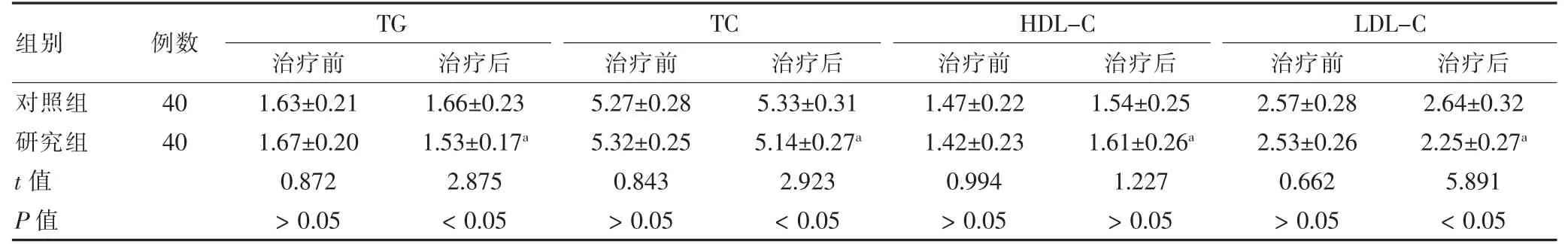
表3 两组治疗前后血脂指标比较(mmol/L,)
注:与本组治疗前比较,aP <0.05。TG:甘油三脂;TC:总胆固醇;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇
2.3 两组治疗前后凝血功能指标比较
治疗后,研究组PT、APTT 长于治疗前,纤维蛋白原低于治疗前,且研究组PT、APTT 长于对照组,纤维蛋白原低于对照组,差异有统计学意义(P <0.05)。见表4。
表4 两组治疗前后凝血功能指标比较()
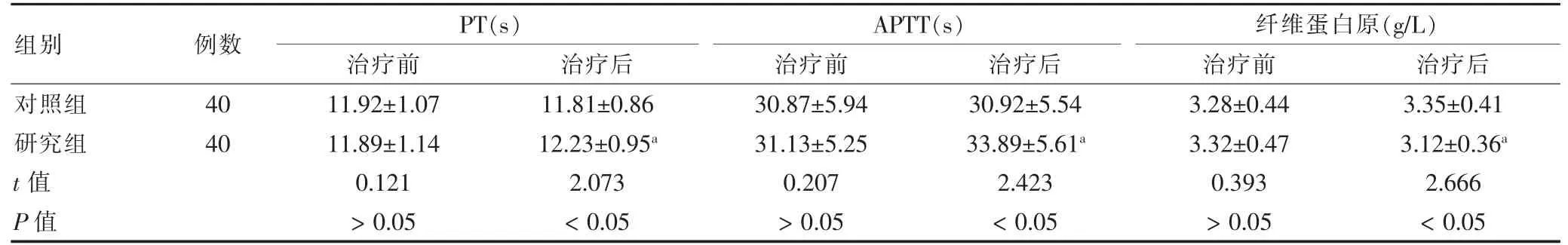
表4 两组治疗前后凝血功能指标比较()
注:与本组治疗前比较,aP <0.05。PT:凝血酶原时间;APTT:活化部分凝血酶时间
3 讨论
妊娠后,女性体内代谢、免疫功能等会发生一定变化[14],主要表现为人绒毛膜促性腺激素水平升高和肾脏对碘清除率增加等[15]。加之,胎儿会在妊娠期6~10 周开始增加甲状腺激素的摄取,这导致妊娠期孕妇体内甲状腺功能的改变而增加SHT 的发生率。甲状腺激素可直接参与胎儿的生长发育,其水平不足将引发早产等,水平升高则可增加先兆流产风险,若不及时有效控制,可能导致流产、妊娠期高血压、胎盘早剥等不良妊娠结局发生,甚至还可能会损害新生儿智力发育与行为能力[15-18]。左甲状腺素钠是目前临床上治疗妊娠期SHT 患者的首选药物,但其对孕中期患者的各生理指标的影响尚少见报道,而孕中期SHT 患者的各项生理指标对于后期的调整用药及妊娠结局十分关键。故研究孕中期SHT 患者的用药后的各项生理指标的变化有重要意义。
TSH、FT4是由腺垂体分泌,可促进甲状腺上皮细胞代谢,是评估甲状腺功能的重要指标。本研究结果显示,经左甲状腺素钠治疗4 周后,研究组血清TSH水平低于治疗前和对照组,而FT4水平变化差异无统计学意义,与其他学者研究结果基本一致[19-20]。值得注意的是,治疗4 周后,研究组鸢尾素水平低于治疗前和对照组。左甲状腺素钠是一种人工合成的四碘甲状腺原氨酸钠,进入人体后与三碘甲状腺原氨酸钠受体结合并转化为三碘甲状腺原氨酸钠,发挥与甲状腺激素类似的作用,促进机体物质与糖脂代谢,反馈于腺垂体而减少TSH 的分泌。血清鸢尾素水平与TSH 水平呈正相关,血清TSH 水平的降低则抑制鸢尾素水平的代偿性升高[21],这对于孕中期SHT 患者的用药后病情诊断有着重要意义。
毛玉山等[22]研究发现,胆固醇、TG、载脂蛋白B 随TSH 升高而逐渐升高,HDL-C 在TSH 异常组显著降低,因此孕妇妊娠期甲状腺功能减退时,会引起一定程度的血脂水平升高。血脂升高将直接导致患者血液黏稠度增加,使内皮细胞功能紊乱,抗凝血功能异常,从而激活内源性凝血纤维蛋白溶解系统,凝血因子和血栓前物质水平也显著增加[23],生化指标上显示为PT、APTT 的延长和纤维蛋白原水平的增加。本研究结果提示,经左甲状腺素钠治疗后,研究组血脂指标TG、TC 和LDL-C 水平降低,而HDL-C 水平升高;凝血功能PT、APTT 延长,而纤维蛋白原降低。可能因为甲状腺激素作为体内的调节因子参与机体代谢的各个环节,妊娠早期甲状腺功能减退与糖脂代谢指标变化密切相关[24]。妊娠期SHT 患者由于甲状腺激素水平的降低,脂肪代谢减缓,且脂肪合成大于分解速度,表现为血脂相关的TG、TC 和LDL-C 水平的升高,而HDL-C 水平降低[25]。另外,甲状腺激素可调节肝酯酶及脂蛋白酯酶的活性[26],增加HDL-C 清道夫受体的表达,脂蛋白酯酶通过水解由TG 合成的脂蛋白而降低TG 水平,促进胆固醇从这些脂蛋白到HDL-C的转化,而脂蛋白酶水平在甲状腺激素作用下增加[27],因此研究组给药后血脂水平和凝血功能得以纠正。
综上所述,左甲状腺素钠不仅能提高孕中期SHT患者甲状腺功能和降低血清鸢尾素水平,也在一定程度上改善了患者的血脂及凝血功能,对孕中期SHT患者生理指标的纠正有着重要价值。

