炎性指标在慢性阻塞性肺疾病合并肺部细菌感染中的诊断价值
马莹暄,赵晓丽,格日勒图,范宝军,祝振忠
(北京大学首钢医院急诊科,北京 100043)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)主要是由于气道的反复损伤导致通气功能障碍,且是以持续气流受限为主要特征的疾病。COPD生理改变不仅表现于肺部,也因患者自身防御功能、免疫功能的降低,易合并肺部感染,加重病情。血细胞分析中的白细胞计数(WBC)是目前临床诊断细菌感染的最常用指标,但存在个体差异,特异性差,早期不易区分不同病情的患者,因此寻找能预测诊断病情严重程度的指标,对指导临床用药具有重要意义[1]。降钙素原(PCT)是目前临床公认的细菌感染的重要参考指标,当机体被细菌感染后,其水平明显升高[2]。中性粒细胞/淋巴细胞比值(NLR)与血小板/淋巴细胞比值(PLR)分别反映中性粒细胞、血小板及淋巴细胞之间的动态平衡关系,近年来被多项研究证实NLR、PLR与机体炎症反应密切相关,感染早期其较白细胞升高更早,且NLR、PLR通过血细胞分析即可获得,检测便捷,价格低廉[3-4]。基于此,本文回顾性分析了126例COPD合并肺部细菌感染患者的临床资料,旨在探讨PCT、NLR、PLR在COPD合并重症肺部细菌感染中的诊断价值,以期为临床诊断和治疗提供参考,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2020年2月至12月北京大学首钢医院收治的126例确诊为COPD合并肺部细菌感染患者的临床资料,根据临床肺部感染评分(CPIS)[5]分为轻症组(98 例,CPIS ≤ 6 分)与重症组(28 例,CPIS>6分)。诊断标准:参照《慢性阻塞性肺疾病诊治指南(2013年修订版)》[6]中的相关诊断标准。纳入标准:符合上述诊断标准者;明确为细菌感染,表现为发热、新近出现的咳嗽及咳痰症状,WBC>10×109/L,胸部X线或CT检查显示肺部炎症者;意识清晰且治疗依从性较佳者;临床资料完整者。排除标准:合并其他器官严重功能障碍者;严重的气胸、纵膈气肿者;合并支气管哮喘等其他呼吸系统疾病者;免疫系统疾病或接受免疫治疗者。本研究经北京大学首钢医院医学伦理委员会批准。
1.2 研究方法 入院后统计两组患者基础资料信息,详细记录患者咳嗽、喘息、发热、气促、发绀等临床症状。给予患者吸氧和对症支持治疗,维持生命体征平稳,必要时应用呼吸机辅助呼吸,根据患者具体情况可给予祛痰、抗感染等治疗措施[7]。所有患者入院时均抽取外周静脉血5 mL,分成两份,其中一份静脉血采用全自动血细胞分析仪行血细胞分析检测(包括中性粒细胞、淋巴细胞及血小板),并计算NLR、PLR比值;另一份静脉血离心(3 000 r/min,5 min)处理后,取血清,采用酶联免疫吸附实验法检测血清PCT水平。
1.3 观察指标 ①比较两组患者临床特征资料,包括性别、年龄、咳嗽、喘息、发热、气促、发绀等。②比较两组患者PCT、NLR、PLR水平。③通过多因素Logistic回归分析筛选影响COPD患者合并重症肺炎细菌感染的独立危险因素。④通过受试者工作特征(ROC)曲线评价PCT、NLR、PLR单独检测及联合检测在COPD合并重症肺部细菌感染中的诊断价值。
1.4 统计学方法 采用SPSS 23.0统计软件分析数据,计量资料以(±s)表示,采用t检验;计数资料以[ 例(%)]表示,采用χ2检验;危险因素分析采用多因素Logistic回归分析;采用ROC曲线对COPD合并重症肺部细菌感染的诊断价值进行评估。以P< 0.05为差异有统计学意义。
2 结果
2.1 临床特征 重症组喘息、发绀患者的占比均显著高于轻症组,差异均有统计学意义(均P< 0.05),而两组患者年龄及性别、咳嗽、发热、气促患者占比相比,差异均无统计学意义(均>0.05),见表1。

表1 两组患者临床特征比较
2.2 实验室指标 重症组患者PCT、NLR、PLR水平均显著高于轻症组,差异均有统计学意义(均P< 0.05),见表2。
表2 两组患者实验室指标比较( ±s)

表2 两组患者实验室指标比较( ±s)
注:PCT:降钙素原;NLR:中性粒细胞/淋巴细胞比值;PLR:血小板/淋巴细胞比值。
组别 例数 PCT(ng/mL) NLR(%) PLR(%)轻症组 98 2.16±0.25 4.22±1.41 165.48±31.24重症组 28 5.81±1.11 6.18±1.62 235.34±33.33 t值 30.245 6.272 10.282 P值 <0.05 <0.05 <0.05
2.3 影响COPD患者合并重症肺部细菌感染的多因素Logistic回归分析 以影响COPD患者合并重症肺部细菌感染为因变量,将两组患者单因素分析中差异有统计学意义的因素作为自变量,进行多因素Logistic回归分析,筛选影响COPD患者合并重症肺炎细菌感染的独立危险因素,结果显示,发绀及PCT、NLR、PLR水平均是影响COPD患者合并重症肺部细菌感染的独立危险因素,差异均有统计学意义(OR= 3.655、6.994、4.512、4.556,均P< 0.05),见表 3。

表3 影响COPD患者合并重症肺部细菌感染发生的多因素Logistic回归分析
2.4 诊断价值 联合诊断的ROC曲线下面积(AUC)、灵敏度、特异度、约登指数均显著高于PCT、NLR、PLR单独诊断,差异均有统计学意义(均P< 0.05),见表4和图1。

表4 炎性指标单独检测和联合检测在COPD合并重症肺部细菌感染中的诊断价值比较
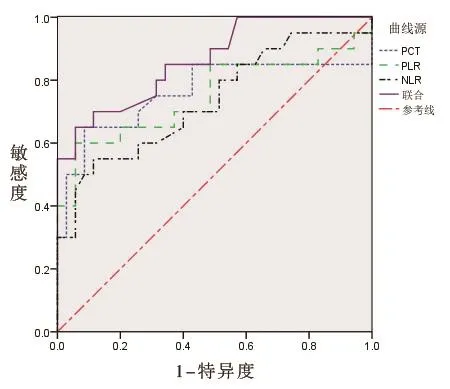
图1 炎性指标单独检测和联合检测诊断COPD合并重症肺部细菌感染的ROC曲线
3 讨论
COPD与抽烟、空气污染、遗传等因素有关,患者的气流受限为不完全可逆,且病情呈现进行性进展,患者长期慢性状态可导致防御机制受损。由于COPD患者机体免疫力低下,可造成病原菌入侵,导致多种感染的发生,从而出现急性加重,对患者肺部功能产生严重影响,加剧慢性低氧程度,引发呼吸衰竭。COPD患者肺部感染后不易控制,且很难彻底治愈,如果不及时进行治疗,可威胁患者生命,因此早期诊断和判断COPD合并肺部细菌感染患者的病情严重程度,对于指导临床治疗、延缓病情进展具有重要意义[8]。
炎症指标在机体炎症反应和免疫调节过程中发挥着重要作用,也参与COPD合并肺部细菌感染的病理过程。WBC是临床上判定感染发生最主要的参考指标之一,但其上升有一定的滞后性,因此通过常规WBC检测不能很好地反映机体炎症状况,且应激反应同样可以刺激WBC升高[9]。PCT是一种糖蛋白,其水平在正常人群中较低,但在细菌感染后明显升高,可作为早期诊断细菌感染的重要指标,且PCT水平越高表明患者感染程度越重[10]。中性粒细胞为炎性激活因子,淋巴细胞为炎性调节因子,正常生理情况下两者在一定范围内波动,当机体感染后两者将超出各自的波动范围;NLR升高则表明中性粒细胞凋亡减少,淋巴细胞凋亡增加,其作为全身性炎症反应综合征的生物标志物,可反映机体的炎症程度,对感染具有一定的诊断价值[11]。COPD患者凝血功能异常可加速病情进展,导致肺动脉高压的形成,PLR可以反映患者炎症反应程度,血小板增多使内皮细胞因子、血小板因子等细胞趋化因子增加,从而吸引大量炎性因子聚集到炎症部位,加重炎症反应[12]。因此,炎症早期PCT、NLR、PLR可作为COPD合并肺部细菌感染严重程度的检测指标。本研究结果显示,重症组患者喘息、发绀的患者占比显著高于轻症组,且重症组患者PCT、NLR、PLR水平显著高于轻症组,表明相较于COPD合并轻症肺部细菌感染的患者,COPD合并重症肺部细菌感染的患者更容易出现喘息、发绀症状,PCT、NLR、PLR水平更高,PCT、NLR、PLR水平的高低可用来判断COPD合并肺部细菌感染患者病情的严重程度,指导临床治疗,与沙正凯等[13]研究结果基本一致。
多因素Logistic回归分析发现,发绀及PCT、NLR、PLR水平均是影响COPD患者合并重症肺部细菌感染的独立危险因素,分析其原因可能为,发绀表明患者气道痉挛严重,从而造成严重缺氧,进而导致气道炎症反应加重,分泌物增多,易进展为重症[14];PCT、NLR、PLR均是机体炎症反应指标,其水平越高表明机体炎症反应越严重,又可进一步刺激机体产生多种炎性因子,进而加重病情,形成恶性循环[15]。因此,临床需及时采取相应治疗措施缓解COPD患者症状,降低患者体内炎性因子水平,以防病情进一步发生发展。
为更好地早期鉴别诊断病情严重程度,本研究行ROC曲线分析,结果显示,PCT、NLR、PLR单独诊断重症肺部细菌感染的AUC > 0.7,提示上述指标单独诊断有一定价值,但单独诊断的灵敏度及特异度均比较低,因此临床应用具有局限性;而联合检测的AUC > 0.85,且联合诊断的灵敏度、特异度、约登指数均显著高于PCT、NLR、PLR单独诊断,提示三者联合诊断具有更高的临床价值,临床可对三者进行联合检测以便诊断COPD合并重症肺部细菌感染的严重程度,并更好地指导临床治疗。
综上,相较于COPD合并轻症肺部细菌感染,COPD合并重症肺部细菌感染患者容易发绀、喘息,PCT、NLR、PLR水平更高,且发绀及PCT、NLR、PLR水平均是影响COPD合并重症肺部细菌感染的危险因素,PCT、NLR、PLR联合检测具有更高的临床诊断价值。临床需及时采取相应治疗措施缓解COPD合并肺部细菌感染患者的症状,降低患者体内炎性因子水平,以防病情进一步发生发展。但本研究未对相关指标进行动态观察,且本研究样本量较少,因此未来仍需进行大样本研究进一步验证结论。

