UHPLC-Q-Exactive-Orbitrap HR-MS分析大黄素甲醚在大鼠体内的代谢产物
董萍萍,王少平,王喻淇,李浩然,李启艳,魏 霞,代 龙*,张加余*
(1.山东中医药大学药学院,山东 济南 250300;2.滨州医学院药学院,山东 烟台 264003;3.北京大学药学院,北京 102488;4.山东省食品药品检验研究院,山东 济南 250300)
药物代谢指药物进入体内后,在体内多种药物代谢酶的作用下,化学结构发生改变的过程。药物在体内经生物转化后可以被活化,由无药理活性转化成为有药理活性或毒性的代谢物[1]。因此,对代谢产物的研究可为药物疗效的表达提供依据。然而,由于代谢产物谱和药物处理过程的复杂性,药物代谢产物和代谢途径分析一直面临诸多挑战。
近年来,高分辨率质谱可为化合物的结构鉴定提供丰富的信息,极大地提升了代谢产物鉴定效率,成为中药化学成分及其体内代谢过程研究的常用方法[2-3]。其中,超高效液相色谱-四极杆/静电场轨道阱高分辨质谱(UHPLC-Q-Exactive Orbitrap Mass spectrometry)可进行高分辨率(140 000 FWHM)和高质量精度质谱数据采集,保证筛查结果的可靠和准确性。同时结合质量亏损过滤(MDF)、中性丢失过滤(NLF)、诊断碎片离子过滤(NFIF)等数据处理技术,可为中药化学成分的体内代谢研究提供更可靠、更有效的技术支撑[4-6]。
现代研究表明,蒽醌类化合物具有广泛的药理作用,包括泻下作用、抗肿瘤、抗炎、抗菌、抗氧化、抗损伤和乙酰胆碱酯抑制等作用[7]。大黄素甲醚是一种蒽醌类衍生物,广泛存在于大黄[8]、何首乌[9]以及土大黄[10]等中草药中。作为这些中药的主要有效成分,大黄素甲醚由于其良好的药理作用而受到越来越多的关注。例如,它不仅通过诱导细胞凋亡、破坏细胞周期和抑制肿瘤转移而发挥有效的抗肿瘤活性[11],而且还表现出对各种真菌、细菌和病毒明显的抑制作用[12]。此外,许多研究报道大黄素甲醚有抗炎、抗氧化、脂质调节和神经保护作用[13-14]。然而,大黄素甲醚也会引起肝毒性、肾毒性和遗传毒性,且具有剂量依赖性[15-17]。目前,大黄素甲醚的体内代谢过程亟需进一步研究,以期为蒽醌类成分的新药研发及中药材、制剂的全面质量控制奠定基础。
1 材料
UHPLC Q Exactive-Orbitrap HR-MS(美国Thermo Fisher Scientific公司),配置电喷雾离子源和XCalibur 2.1质谱工作站;超声波清洗机(上海比郎仪器制造有限公司);C18固相萃取小柱(500 mg/3 mL,美国Sigma公司);TTL-DCI型氮吹仪(北京同泰联科技发展有限公司);BT25S型电子分析天平(十万分之一,北京赛多利斯仪器有限公司);-80 ℃超低温冷冻储藏冰箱(美国Thermo Fisher Scientific公司)。
大黄素甲醚(批号MUST-19032622)、大黄酸(批号MUST-19031309)、芦荟大黄素(批号MUST-19091912)、大黄素(批号MUST-18110810)、大黄酚(批号MUST-19040301)对照品均购自成都普曼斯特生物科技有限公司,纯度均大于98%。乙腈、甲醇(质谱纯,美国Thermo Fisher公司);甲酸(色谱纯,德国Merck公司)。
雄性SD大鼠,体质量(200±10)g,购于济南朋悦实验动物繁育有限公司,动物生产许可证号SCXK(鲁)20190003,饲养于SPF级动物房,昼夜循环12 h,温度22~24 ℃,相对湿度55%~65%。
2 方法
2.1 溶液制备 精密称取大黄素甲醚、大黄素、大黄酸、大黄酚、芦荟大黄素对照品各1 mg 至10 mL量瓶中,甲醇超声溶解,滤过,即得对照品溶液。称取大黄素甲醚对照品60 mg,加入6 mL生理盐水,配成质量浓度为10 mg/mL的混悬液。
2.2 动物实验与样品采集 6只大鼠随机分为空白组和给药组,每组3只,实验前适应性喂养1周,禁食12H,不禁水,给药组按25 mg/kg剂量灌胃给药[18-20],空白组灌胃给予等量生理盐水,灌胃后分别于0.5、1、2、4、6 h眼眶取血0.5 mL,置于肝素钠抗凝EP管中,摇匀,3 500 r/min离心15 min,合并上清液,得空白血浆和含药血浆,置于-80 ℃冰箱中保存备用;收集0~24H尿样,3 500 r/min离心15 min后取上清液,于-80 ℃冰箱保存,得空白尿样与含药尿样;收集0~24 h粪样,晾干后碾碎,装于离心管中保存[21-22]。
2.3 生物样品前处理 取空白组和给药组大鼠粪便各1 g,研磨,加入5 mL纯水超声提取30 min,3 500 r/min离心15 min后取上清液,即得空白粪样与含药粪样[18]。取固相萃取柱,依次用3 mL甲醇、3 mL水对其进行活化,吸取血浆、尿液、粪便各1 mL上样,依次用3 mL水、3 mL甲醇洗脱,收集甲醇洗脱液,在室温下用N2吹干,残渣用100 μL初始流动相溶解,涡旋振荡3 min,14 000 r/min离心15 min,取上清液[23-24]。
2.4 分析条件
2.4.1 色谱 WatersHSS T3 UPLC色谱柱(100 mm×2.1 mm,1.8 μm);流动相0.1%甲酸(A)-乙腈(B),梯度洗脱(0~1 min,5%B;1~3 min,5%~40%B;3~6 min,40%~50%B;6~11 min,50%~65%B;11~19 min,65%~95%B);体积流量0.3 mL/min;柱温35 ℃;进样量3 μL。
2.4.2 质谱 正负离子检测模式;鞘气、辅助气氮气(纯度≥99.99%),体积流量30、10 L/min;毛细管温度320 ℃;蒸发器温度400 ℃;喷涂电压4 500/-3 800 V;分辨率70 000;高分辨扫描范围m/z80~1 200;碰撞能30 eV;dd-MS2分辨率17 500。
2.5 数据处理 所有蒽醌类化合物都具有共同的碱性1,8-二羟基对苯二酚的结构,以及C-3、C-5不同取代(主要是甲基、羟基、甲氧基和羧基),经过一系列代谢反应后大黄素型5种游离蒽醌会相互转化[23]。因此,本实验以5种大黄素型蒽醌为原型,建立其可能的代谢反应模板,包括化合物名称,分子式,结构式等,进行目标化合物的筛选与鉴定。
采用Thermo Xcalibur 2.1工作站进行数据采集和处理,为了获得尽可能多地获得大黄素甲醚代谢物的ESI-MS/MS碎片离子,选择正离子模式强度不低于40 000、负离子模式强度不低于10 000的信号峰进行鉴定。根据精确分子质量,元素组成和可能发生反应,对所有母离子和碎片离子的分子式进行预测设置,参数设置为C[5-30],H[5-60],O[2-20],S[0-2],N[0-3],环不饱和双键数(RDB)[3-20],质量精度误差在1.0×10-5以内。
3 结果
3.1 大黄素甲醚质谱裂解规律分析 在负离子模式下,大黄素甲醚的准分子离子峰[M-H]-为m/z283.061 1(C16H11O5),见图1,在其二级质谱中检测到特征离子碎片m/z240[M-H-CO-CH3]-、m/z197[M-H-2CO-CH2O]-、m/z183[M-H-2CO-CH2-CH2O]-、m/z211[M-H-CO-CH2-CH2O]-,其可能的裂解规律见图2。大黄素、芦荟大黄素、大黄酚、大黄酸的二级质谱图以及碎片离子见图3、表1。

图1 大黄素甲醚对照品一级(A)、二级(B)质谱图(负离子模式)
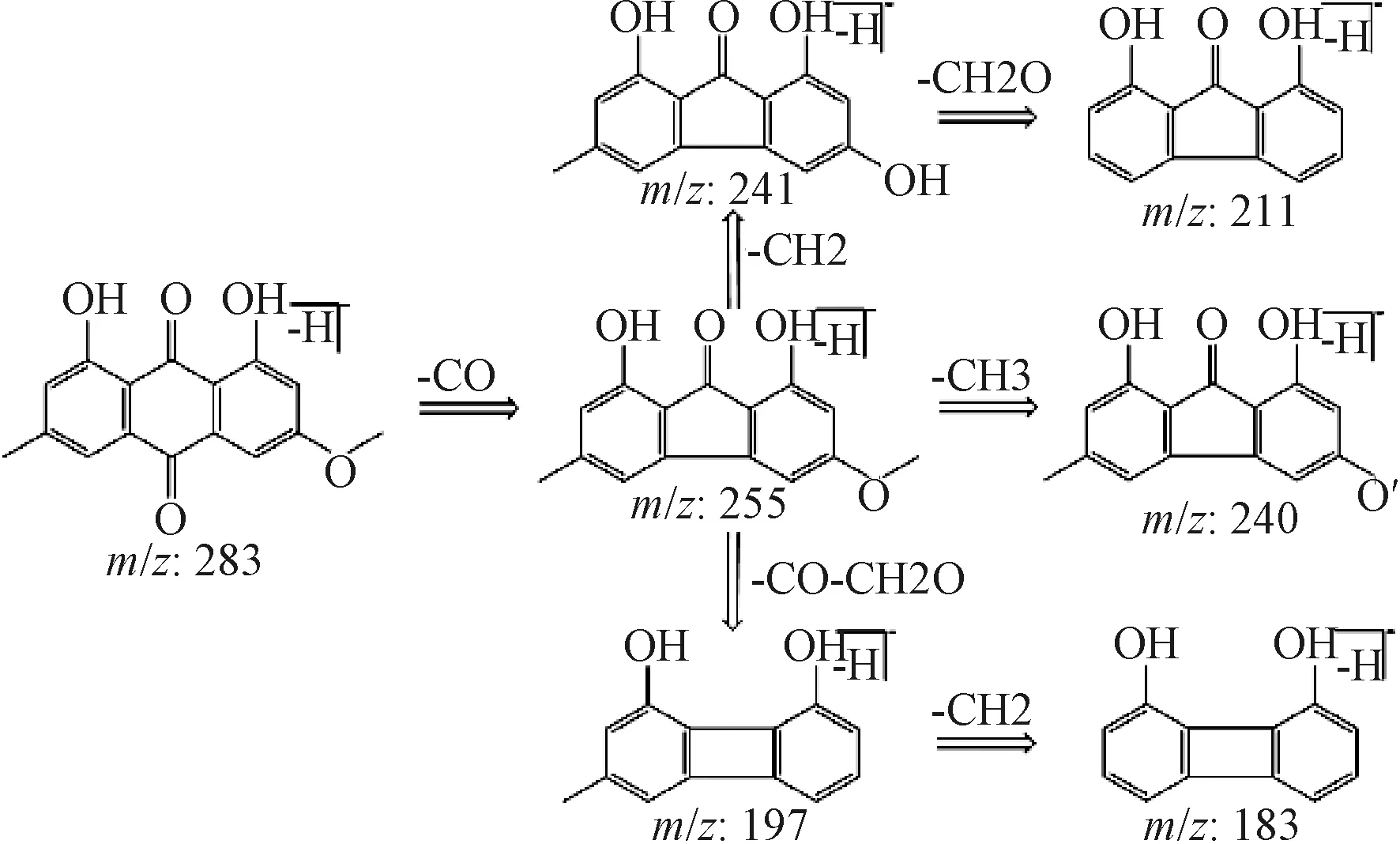
图2 大黄素甲醚质谱裂解规律(负离子模式)

图3 大黄素(A)、大黄酸(B)、芦荟大黄素(C)、大黄酚(D)二级图谱
3.2 大黄素甲醚体内代谢产物分析
对大鼠给药前后的尿液、血浆、粪便进行分析,结合精确分子质量、保留时间、二级碎片离子、ClogP值等参数,共初步鉴定出20种代谢物,具体质谱信息见表1。

表1 大黄素甲醚代谢产物(Ⅰ)
M1在正离子模式下准分子离子为m/z576.128 2,保留时间3.25 min,推测其最可能的分子式为C25H26O11N3S。根据文献和筛选所用模板,推测其为ω-羟基大黄素-半胱氨酸。在其二级质谱中,m/z397[M+H-C5H8N203S]+为谷胱甘肽第二个肽键断裂,中性丢失半胱氨酸-甘氨酸二肽而形成的碎片离子。同时,m/z178为此二肽质子化碎片。离子对m/z415和m/z162为半胱氨酸中叔碳和N原子相连的键经过诱导碰撞断裂而形成的互补离子对。m/z287为准分子离子丢失C10H15N3O5S而形成,经计算,该中性碎片为谷氨酸残基-半胱氨酸-甘氨酸,可确定M1为ω-羟基大黄素-半胱氨酸。
M2和M3准分子离子峰分别为m/z445.077 5和445.077 3,保留时间分别为4.48 min和4.54 min。经计算,最可能的分子式为C21H17O11,其相对分子质量比大黄素和芦荟大黄素多176,故推测M1和M2为大黄素/芦荟大黄素葡萄糖醛酸化产物。其中M2和M3的二级碎片离子m/z175[GluA-H]-为葡萄糖醛酸碎片离子,m/z269[M-H-GluA]-为准分子离子峰m/z445[M-H]-脱去GluA中性碎片产生的离子。在M2的ESI-MS2中,碎片离子m/z225与芦荟大黄素标准品的碎片离子一致,而M3的二级碎片中,m/z239与大黄素标准品碎片相同,故最终推测M2为芦荟大黄素的葡萄糖醛酸结合产物,而M3为大黄素葡萄糖醛酸结合产物。
M6在正离子模式下的准分子离子为m/z255.064 9,其二级碎片与大黄酚的一致。但是保留时间比大黄酚提前,极性比大黄酚大,推测其为大黄酚的同分异构体。M4保留时间为4.66 min,[M-H]-为m/z417.118 9,其最可能分子式为C21H21O9。其二级质谱中,m/z175和中性丢失176(m/z417→m/z241)都证明了葡萄糖醛酸的存在。脱去葡萄糖醛酸后其分子式为C15H13O3,是大黄酚氢化脱氧形成的大黄酚蒽酮的氢化产物。m/z135和m/z121分别为离子m/z241在中间环裂解失去C7H6O和C8H8O而形成的,最终鉴定M4是大黄酚双氢化脱氧葡萄糖醛酸化产物。M8的准分子离子为m/z433.113 9,比M4高16,同时二级碎片离子m/z257比M4的m/z241高16,故推测M8为M4的羟基化产物。M7和M9分别在4.98 min和5.28 min处被洗脱出来,准分子离子分别为m/z269.045 5和m/z269.045 6,计算其最可能分子式为C15H9O5。在ESI-MS2中,碎片离子m/z225比分子离子少44,推测为中性丢失一分子CO2,证明羧基的存在。根据其分子式和不饱和度,最终M7和M9被鉴定为大黄酸蒽酮。M5的准分子离子峰[M-H]-为m/z313.071 4,分子式为C17H13O6。经碰撞诱导,准分子离子脱去一分子CO2产生二级碎片m/z269,故可判定其分子结构中存在羧基。结合其不饱和度以及分子式,其母核结构为大黄酸蒽酮化合物,推测其为大黄酸蒽酮的双甲基化、羟基化产物。其中二级碎片离子m/z119和m/z161为非羧基取代侧的苯环被两个甲基取代后,在中间环的碳基左右两侧断裂后分别得到的碎片离子,证明双甲基取代和羟基取代分别发生在两侧苯环上,具体结构见图4。最终,M5被鉴定为大黄酸蒽酮-双甲基-羟基化产物。

图4 大黄素甲醚代谢通路
M10的准分子离子为m/z367.013 0(C15H11O9S),比ω-羟基大黄素多82,结合其分子式,推测其为ω-羟基大黄素的氢化、硫酸酯化代谢产物。由m/z367→m/z287的中性丢失80可知硫酸根的存在。二级碎片离子m/z231为m/z287连续丢失CO和C2H2而形成的,m/z187为m/z287连续丢失4分子水和1分子CO而成。最终,M10被鉴定为ω-羟基大黄素-氢化-硫酸酯化产物。
M11和M12拥有共同的理论[M-H]-值m/z459.092 2,计算分子式为C22H19O11。二者的ESI-MS2基本一致,其中m/z175和m/z113为葡萄糖醛酸的特征离子碎片,m/z283为准分子离子中性丢失葡萄糖醛酸碎片形成。碎片离子m/z240为大黄素甲醚特征碎片,且碎片离子m/z268为大黄素甲醚丢失CH3而形成。故推测二者为大黄素甲醚的葡萄糖醛酸结合产物。根据二者ClogP值,最终推测M11为大黄素甲醚-8-O-葡萄糖醛酸,M12为大黄素甲醚-1-O-葡萄糖醛酸。
M13在6.31 min时被洗脱出来,准分子离子为m/z267.066 3(C16H11O4)。在其二级质谱中,基峰离子m/z252比准分子离子少15,说明其失去一个CH3,证明了M13结构中存在一个碰撞后易失去的甲基,且最可能与氧相连。离子m/z223比准分子离子[M-H]-少44,是由后者中性丢失一分子CO2形成的,说明结构中同样存在羧基。离子m/z117为M13连续失去CO2和CH3后又失去环C6H4O而形成的,说明甲基和羧基存在于另一侧环上。故M13被鉴定为1-甲氧基-3-羧基-蒽酮。M15在保留时间为6.60 min 时被洗脱出来,其准分子离子为m/z241.050 3,计算得分子式为C14H9O4。根据数据库pubchem(https://pubchem.ncbi.nlm.nih.gov/)以及分子式相结合,推测其为三羟基蒽酮。在其ESI-MS2中,m/z123为苯环上取代三个羟基所形成得碎片离子,而碎片离子m/z75是由蒽酮中无取代的苯环形成的碎片离子。m/z213是由准分子离子失去一分子CO形成的。结合以上条件以及保留时间,M15最终被鉴定为1,2,3-三羟基-蒽酮。
M14、M16和M18的[M-H]-为m/z253.049 5,其分子式为C15H9O4。结合保留时间和相对分子质量,推测三者为大黄酸蒽酮的脱羟基反应产物。其多级碎片离子m/z209为m/z253脱去1分子CO2形成,证明羧基的存在。离子m/z191是由m/z209继续分子内脱水形成,说明羟基的存在。M14和M18的m/z117(C8H7O-)为C9、C10与羟基和羧基所在的苯环连接的键断裂后所形成的碎片离子,说明二者的羧基和羟基在同一侧苯环上。M16的m/z147为羰基和羧基所在一侧,m/z105为其互补碎片离子,说明羧基和羟基在两侧苯环上。M14、M16和M18最终被鉴定为大黄酸蒽酮脱羟基产物异构体。M19的准分子离子峰为m/z265.050 4(C16H9O4),保留时间为7.53 min。在其二级质谱中,碎片离子m/z221比准分子离子小44,推测为准分子离子峰中性丢失一分子CO2形成,证明了羧基的存在。离子m/z193是由碎片离子m/z221中性丢失一分子CO而形成的,根据其分子式和不饱和度,最终鉴定其结构为甲基化3-羧基-蒽醌。
M17的保留时间为5.15 min,准分子离子峰为m/z269.045 7,推测其分子式为C15H9O5。M17保留时间和二级碎片裂解行为与大黄素相似,由此可将M17准确鉴定为大黄素,由大黄素甲醚失去甲基而形成。M20的准分子离子m/z349.001 5比芦荟大黄素多80,推测其为芦荟大黄素硫酸酯化反应物。在ESI-MS2中,m/z269是由分子离子峰中性丢失一分子SO3而形成,特征碎片m/z197与芦荟大黄素一致。最终推测,M20为芦荟大黄素硫酸酯化产物。
此外,本实验整合了文献报道的信息中大黄素甲醚可能发生的代谢反应及其分子式改变的情况,预测其代谢物可能的分子式,通过准确质荷比信息,提取不同质荷比的一级质谱图,并判断其峰形,然后对比文献报道的信息,对没有二级质谱的物质进行分析。最后从一级质谱中初步分析出23种可能的代谢物,分析结果如表2所示,其可能的结构如图4所示。

表2 大黄素甲醚代谢产物(Ⅱ)
3.3 大黄素甲醚的体内代谢途径分析 大黄素甲醚的代谢通路图见图4。大黄素甲醚吸收入体内后,在血液中检测到27个代谢产物,尿液中检测到21个代谢产物,粪便中检测到11个代谢产物。大黄素甲醚在血液中检测出了葡萄糖醛酸结合产物、硫酸酯化产物以及转化的蒽酮、氢蒽等物质,其中以葡萄糖醛酸化结合产物为主。在尿液中产生了谷胱甘肽代谢产物以及大黄酸和大黄酸蒽酮类物质。在粪便中鉴定出了大黄酚和大黄素以及它们的硫酸酯化、葡萄糖醛酸化产物。
4 讨论
为了检测尽可能多的代谢物,建立了UHPLC-Q-Exactive Orbitrap MS结合整合定性分析策略对其在血液中的 Ⅰ 相代谢物和 II 相代谢物进行靶向筛选和定性分析,在正、负离子模式下对血浆,尿液和粪便中的大黄素甲醚代谢物进行了全面的分析和鉴定,并阐明了其主要的体内代谢途径。
药物体内代谢产物具有复杂多样性,并且这些复杂的代谢产物含量不一,有些甚至很难被检测到。由于质谱扫描过程中二级质谱会选择全扫描中响应前 N 强的离子进行二级扫描,这就导致一些微量代谢产物只存在于一级质谱中,而被二级扫描所忽略造成假阴性。基于此,本文整合了文献中报道的大黄素甲醚的代谢产物,对其可能存在的代谢产物进行了初步的分析。
有研究报道,蒽醌类成分在体内含量过高会有一定的毒性,在体内代谢时主要通过尿液和胆汁排泄促进其毒性的清除[25]。在本实验中,大黄素甲醚吸收进入体内后,在大鼠血、尿、粪中均未发现其原型,在血液中检测到27个代谢产物,尿液中检测到21个代谢产物,粪便中检测到11个代谢产物,表明了大黄素甲醚主要通过尿液进行排泄。大黄素甲醚在大鼠体内主要进行葡萄糖醛酸结合、硫酸酯化等反应以及转化成蒽酮、氢蒽等物质,进一步进入血液,输送到各个器官,发挥其药理作用。其中在尿液中以糖苷化、硫酸酯化和谷胱甘肽结合产物为主。尿液中检测到的的谷胱甘肽结合产物在肝脏中会与细胞亲核物质形成共价加和物,从而导致肝毒性[27]。与报道一致的是,大黄素甲醚进入体内后,在代谢过程中会转化成大黄素、芦荟大黄素、大黄酸以及大黄酚等,这些物质的蒽醌类基本母核相互转化,其代谢物不仅来自自身,也来自于其他成分[26],其代谢途径见图4。
本实验研究了大黄素甲醚在大鼠体内的代谢情况,为单个物质和整个蒽醌类物质在体内代谢时的相互转化提供了更进一步的依据,同时也为蒽醌类药物的临床安全用药提供了依据。本实验基于从体内代谢过程的角度研究蒽醌类化合物的药效和毒性其物质基础,对于确保相关中药临床使用的安全、有效具有重要意义。
——α-葡萄糖醛酸酶的研究进展*

