“风寒湿致痹”理论指导下体内外骨关节炎模型建立与评价研究❋
沈 雪, 薛 艳, 陈 龑, 李 名, 张 琥, 曹月龙
(上海中医药大学附属曙光医院, 上海 201203)
膝骨关节炎(knee osteoarthritis,KOA)是由环境刺激、机械应力、年龄因素等导致膝关节软骨损伤、退变的疾病[1,2]。KOA属于中医学“膝痹”范畴[3],而风寒湿邪外袭是其致病的重要因素。《素问·痹论篇》提及风属阳邪,为百病之长,性能疏散,易使腠理开泄;寒湿皆属阴邪,乘风邪侵袭人体,引起经络痹阻和气血不畅,说明风寒湿可进一步促进关节炎的发展,但目前缺乏相关实验证明。本文从实验角度构建风寒湿体内环境及风寒湿关节炎大鼠体内外模型,体内实验通过观察软骨组织学及检测血清中炎症因子表达,体外实验通过观察加入风寒湿血清的软骨细胞形态及检测相关基因表达,证明“风寒湿”外邪可促进膝骨关节炎进展。本研究已通过上海中医药大学实验动物福利与伦理委员会审查,伦理编号PZSHUTCM190322003。
1 材料
1.1 动物
体内实验选用SPF级5周龄雄性SD大鼠45只,体质量180~200 g,购于上海西普尔-必凯实验动物有限公司,实验动物许可证号SCXK(沪)2013-0016。体外实验选用SPF级新出生24 h内的裸鼠,体质量1.5~4 g,购于上海西普尔-必凯实验动物有限公司,许可证号码SCXK(沪)2018-0006。
1.2 主要试剂与仪器
HE染色试剂盒(上海碧云天生物技术有限公司,货号C0105 S);白细胞介素(interleukin, IL)-1β、IL-6 ELISA试剂盒(美国R&D公司,货号分别为RLB00,R6000B);DMEM培养基、胎牛血清、青霉素-链霉素试液、0.25%胰蛋白酶(Gibco,货号分别为C11995500BT,10270106,15140-122,25200-056);胶原酶Ⅱ型(DIYIBIO,货号DY40126);甲苯胺蓝(Servicebio,货号G1032);RNA文库构建试剂盒(NEB,货号E7530)。
人工气候箱(型号LTC-1000,上海三腾仪器有限公司);石蜡切片机(型号RM2165,德国Leica公司);石蜡包埋机(型号EG1150C,德国Leica公司);显微镜(型号IX71,Olympus);细胞培养箱(型号HERA cell 150,Thermo);酶标仪(型号Synergy4,Biotek);Bioanalyzer 2100系统(型号Illumina Hiseq 4000,Agilent Technologies)。
2 方法
2.1 动物分组及模型建立
大鼠依据随机数字分配原则分为空白组(Blank组)、膝骨关节炎组(KOA组)、风寒湿+膝骨关节炎组(FKOA组)每组各15只。Blank组无干预措施,KOA组采用改良Hulth法(切断大鼠膝关节内侧副韧带,摘除内侧半月板及切断前交叉韧带)建立膝骨关节炎模型,FKOA组采用改良Hulth法+人工气候箱(设置湿度93%~97%、温度2~6 ℃、风力3级)模拟风寒湿环境因素建立SD大鼠风寒湿型膝骨关节炎模型,连续造模4周。
2.2 细胞分组及模型建立
取新生SD裸鼠膝关节软骨细胞进行分离、提取及培养,选取第3代(细胞状态较好)进行干预。实验分组:Control组(软骨细胞经20 ng/mL IL-1β诱导炎症成功后作为膝骨关节炎细胞模型),FHS组(加入10% FKOA组大鼠造模成功后的血清+20 ng/mL IL-1β)。
2.3 体内实验检测指标与方法
2.3.1 HE染色 大鼠造模成功后,戊巴比妥钠腹腔过量注射处死,用刀片切取大鼠膝关节软骨,4%多聚甲醛固定样品,脱水、包埋、制作石蜡切片,HE染色后显微镜下观察各组软骨形态。
2.3.2 ELISA法检测大鼠血清中IL-1β及IL-6含量 取大鼠腹主动脉血10 mL,按照ELISA试剂盒使用说明书检测大鼠血清中IL-1β与IL-6的含量。
2.4 体外实验检测指标与方法
2.4.1 软骨细胞染色鉴定 当软骨细胞长满至培养皿底部80%左右时,传第1代软骨细胞。继续培养并传代获得第3代软骨细胞,接种于6 孔板中,待细胞爬满至50%~60%时弃培养基,PBS缓冲液冲洗2次后,置于4%多聚甲醛中固定1 h,再用PBS洗2次后加入1%甲苯胺蓝室温放置染色10~30 min,无水乙醇冲洗至无色,倒置显微镜下观察细胞并拍照。
2.4.2 软骨细胞形态学观察 2组软骨细胞(第3代)给予相应干预后分别培养24 h后,用倒置显微镜观察并拍照。
2.4.3 软骨细胞转录组测序及差异表达基因聚类分析 使用Bioanalyzer 2100系统评估RNA完整性,RIN值大于7认为RNA完整性合格,每个样品提取1.5 μg total RNA。使用RNA文库构建试剂盒并按照说明构建测序文库,并将barcode添加到每个样品文库序列中,Illumina Hiseq 4000平台测序产生150bp的配对序列。参考基因组和基因注释文件直接从基因组网站下载。使用HISAT2 v2.1.0将配对末端clean reads与参考基因组比对,参数设置为默认值。HTSeq v0.11.2计算比对到每个基因的序列片段数量。使用FPKM值为表达水平,做层次聚类分析。
2.5 统计学方法
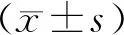
3 结果
3.1 体内实验结果
3.1.1 软骨组织HE染色比较 图1示,Blank组中膝关节软骨细胞排列有序,软骨表面光滑,其中表浅层、移行层、辐射层、钙化层4层结构清晰可见,软骨细胞排列整齐,潮线完整(图1A)。KOA组软骨表面欠光滑,软骨细胞结构层次紊乱、肥大,有细胞团聚成簇现象和软骨细胞凋亡(图1B)。FKOA组表层软骨细胞数量明显增多并伴有肥大化,出现空隙窝和细胞排列紊乱(图1C)。

注:A.空白组(Blank组),B.膝骨关节炎组(KOA组),C.风寒湿+膝骨关节炎组(FKOA组)
3.1.2 ELISA检测血清IL-1β、IL-6表达比较 图2示,通过ELISA检测大鼠血清中IL-1β及IL-6含量,与Blank组比较,KOA组及FKOA组中IL-1β和IL-6含量均明显升高(P<0.01);与KOA组比较,FKOA组中IL-1β含量显著升高(P<0.05),IL-6含量也均显著升高(P<0.01)。

注:与Blank组比较:**P<0.01,与KOA组比较:#P<0.05,##P<0.01;白细胞介素(interleukin, IL);空白组(Blank组)、膝骨关节炎组(KOA组)、风寒湿+膝骨关节炎组(FKOA组)
3.2 体外实验结果
3.2.1 原代软骨细胞染色鉴定 图3示,经甲苯胺蓝染色对所分离提取的软骨细胞进行鉴定,可见获得的软骨细胞核均呈深蓝色,胞浆呈浅蓝色。

图3 原代软骨细胞形态学染色鉴定(×100)
3.2.2 2组软骨细胞形态学比较 图4示,Control组中软骨细胞逐渐变成长梭状,而加入风寒湿血清干预后的风寒湿组软骨细胞则表现出明显的形态学改变,多为类成纤维细胞样的扁平长梭形或不规则形。

注:A为Control组(软骨细胞经20 ng/mL IL-1β诱导炎症成功后作为膝骨关节炎细胞模型),B为FHS组(加入10% 风寒湿+膝骨关节炎组大鼠造模成功后的血清+20 ng/mL IL-1β);白细胞介素(interleukin, IL)
3.2.3 2组软骨细胞差异表达基因聚类分析 图5示,选取骨关节炎发生发展相关的基因进行聚类分析,取以2为底的对数后,利用系统聚类法得到聚类。图6示,与Control组比较,FHS组中Ⅱ型胶原蛋白α1(collagen type II alpha 1,Col2a1)、蛋白多糖(Aggrecan,Acan)、SRY相关高迁移率族盒蛋白转录因子9(SRY-related HMG box transcription factor 9,SOX9)mRNA的表达明显下降(P<0.01)。

注:Control组(软骨细胞经20 ng/mL IL-1β诱导炎症成功后作为膝骨关节炎细胞模型),FHS组(加入10% 风寒湿+膝骨关节炎组大鼠造模成功后的血清+20 ng/mL IL-1β);白细胞介素(interleukin, IL)

注:与Control组比较:**P<0.01;Control组(软骨细胞经20ng/mL IL-1β诱导炎症成功后作为膝骨关节炎细胞模型)、FHS组(加入10% 风寒湿+膝骨关节炎组大鼠造模成功后的血清+20 ng/mL IL-1β);白细胞介素(interleukin, IL);Ⅱ型胶原蛋白α1(Collagen type II alpha 1,Col2a1),蛋白多糖(Aggrecan,Acan),SRY相关高迁移率族盒蛋白转录因子9(SRY-related HMG box transcription factor 9,SOX9)
4 讨论
骨关节炎属于中医学“痹证”“骨痹”范畴。《素问·痹论篇》曰:“风寒湿三气杂至合而为痹”“不与风寒湿气合,故不为痹”。风寒湿邪外袭是致病的重要因素,对2027篇文献中所提及的骨关节炎证型进行分析后显示,风寒湿痹为较常见的证型,其提取的病性证素也以风、寒、湿比例最高[4]。本实验证明,风寒湿外界因素会导致膝骨关节炎进一步加重,说明风、寒、湿外界因素在膝骨关节炎中的重要性。
首先课题组采取使用较多的改良Hulth法进行造模[5-7],并采用人工气候箱模拟风寒湿环境构建风寒湿型膝骨关节炎动物模型[8]。观察大鼠软骨组织染色发现,风寒湿外界因素促进了关节炎的进一步发展。并且通过ELISA实验对大鼠血清中关键炎症因子IL-1β和IL-6进行检测,发现风寒湿外界因素确实可以进一步加重炎性反应。
课题组进一步通过分离提取经过风寒湿外界因素干预的膝骨关节炎大鼠模型血清干预原代软骨细胞,观察软骨细胞形态,发现加入风寒湿血清干预后的风寒湿组软骨细胞表现出明显的形态学改变,多为类成纤维细胞样的扁平长梭形或不规则形,说明风寒湿血清可以影响软骨细胞学形态。
为验证风寒湿血清确实对软骨细胞产生的影响,课题组又进行了基因组测序,通过观察软骨细胞中Ⅱ型胶原及蛋白聚糖以及与维持软骨细胞形态相关的指标发现,FHS组Col2a1、Acan、Sox9 mRNA的表达明显下降,进一步证实风寒湿血清促进了软骨细胞的退变。
风寒湿痹证相关体外研究的文献较少,主要是以先制造动物模型来提取相关组织细胞进行实验[9-11],但是存在提取软骨组织样本个体性差异大、结果数据不稳定等问题。为减少此类问题,本研究基于动物实验证实“风寒湿”因素会显著升高大鼠体内血清炎症因子含量,并尝试提取风寒湿组大鼠血清对软骨细胞进行干预。通过进行风寒湿动物模型造模、提取其血清加入软骨细胞、模拟风寒湿体内环境达到造模的目的,保证了体外实验数据的稳定性和可靠性。
总而言之,本研究从体内外角度证明“风寒湿”因素对于膝骨关节炎的发生发展具有重要意义,开创了一条制备风寒湿细胞模型的新方法,为今后研究外界环境因素对膝骨关节炎的影响提供了新的实验基础与方法,为“风寒湿致痹”这一中医病因病机理论提供了实验依据。

