针刺结合亚低温对脑缺血再灌注损伤大鼠脑缺血侧海马区差异miRNA功用及miR-106b-5p表达的影响❋
郑慧娥, 田浩梅, 何灏龙, 陈芯仪, 高音来, 陈楚淘
(湖南中医药大学针灸推拿学院, 长沙 410208)
脑血管病属于全球范围的高危疾病之一,具有高发病率、高致残率、高致死率及高复发率等特点,给人类带来诸多危害,包括身心危害、经济损失及社会关系损害等[1]。其中缺血性脑血管病约占脑血管病的4/5[2],救治后可继发脑缺血再灌注损伤(cerebral ischemia reperfusion injury, CIRI)。CIRI主要病理表现为脑水肿及神经元损伤[3],临床常以认知障碍、运动失调及感觉失灵为主要症状[4],因此寻求安全有效的治疗方法对CIRI有重要意义。
中医治疗脑卒中多以针刺联合他法治疗为多,且联合治疗效果往往更佳。针刺具有“简便廉验”等特点,是治疗脑血管病的常用治法[5]。亚低温是唯一被临床证实具有改善患者生存率及神经功能预后的治疗方法[6]。微小RNA(MicroRNA,miRNA)高度保守且不具编码作用,长度约为22个核苷酸,其分布范围非常之广包括动植物及人类等,且功能涉及到细胞的增殖分化、凋亡、分裂以及器官发育等[7]。此外有研究证实,miRNA种类及表达量于再灌注期间处于动态变化,可见miRNA与缺血再灌注的演变是相关的[8]。miR-106b-5p是miRNA成员之一,具有调节细胞凋亡及细胞增殖等功能[9],且前期多认为它是疾病诊断的重要因子[10,11],然鲜有干预miR-106b-5p防治疾病的文献报道。本研究应用针刺与亚低温相结合的方法,通过探讨针刺结合亚低温法对CIRI大鼠缺血侧海马区差异miRNA功用及miR-106b-5p表达的调控作用,以期丰富针刺联合治疗脑缺血再灌注损伤机制研究,为临床治疗提供实验依据。本研究已通过湖南中医药大学实验动物伦理委员会审查,批准号20140403。
1 材料与方法
1.1 动物
90只雄性SD大鼠,体质量(265±15) g,购于湖南斯莱克景达实验动物有限公司,实验动物许可证号SCXK(湘)2013-0004。饲养于湖南中医药大学SPF级动物实验中心常温环境中,适应性饲养1周左右,确保自然光暗周期,湿度约60%。
1.2 主要试剂及仪器
4%多聚甲醛(维尔生物,WB0401);1.5%TTC溶液(维尔生物,C19H15);DEPC水(维尔生物,WB0006) ;miRNeasy Kit(Qiagen, 217004);miRCURYTM芯片标记试剂盒(Exiqon公司,208032-A);Trizol(美国Invitrogen 公司,15596026)RT-PCR试剂盒(美国ABI公司,4334973)。
线栓(北京西浓科技,A4-263650);肛温温度计(北京冀诺泰,JNT-LGJ);数位温度表(台湾泰仕,TES1310);荧光定量RCP仪(Thermo公司,PIKO REAL 96);荧光定量PCR板(Thermo公司,SPL0960)。
1.3 动物分组及造模
90只大鼠按照随机数字表法分为正常组15只、假手术组15只和造模组60只,假手术组仅插入线栓,不栓塞右侧大脑中动脉(middle cerebral artery, MCA)。造模组60只大鼠参照Zea Longa[12]改良线栓法,10%水合氯醛(0.3 mL/100 g体质量)麻醉后,给予颈部正中喉结旁作约10 mm切口,暴露颈总动脉(common carotid artery, CCA)、颈外动脉(extra carotid artery, ECA)和颈内动脉(inner carotid artery, ICA)。依次对CCA近心端及ECA近分叉口处进行结扎,于CCA远心端做微小切口,并沿此切口经CCA-ICA路径插入线栓约18 mm,以黑色标记点过ECA和ICA分叉起始点并感受阻力为度,栓塞右侧MCA制备缺血模型,局部喷洒青霉素,缝合颈部正中切口并将线栓尾部固定于皮肤上。缺血2 h后(约90 min苏醒)小心拔出线栓即完成CIRI模型。所有大鼠于缺血再灌注后2 h行神经功能症状缺损评分:无神经功能症状缺损记0分;提尾见栓塞动脉对侧前肢屈曲记1分;行走见向栓塞动脉对侧旋转记2分;行走见向栓塞动脉对侧倾倒记3分;术后失去意识者记4分。造模组1~3分大鼠纳入实验,并采取相同实验方法对缺失大鼠进行补齐。至此,造模组60只大鼠再次按照随机数字表法依次分为模型组、亚低温组、针刺组及针刺结合亚低温组各15只。
1.4 干预方法
全部分组完成后各组大鼠行相应治疗。正常组不做任何处理;假手术组、模型组捆绑30 min,每次12 h共72 h;亚低温组捆绑30 min,每次12 h,参考舒鑫[13]亚低温法并加以改良,将大鼠置于放有冰袋和碎冰的代谢笼中维持肛温(33±1) ℃和鼓膜温度(31±1) ℃于亚低温状态72 h,每1 h监测1次;针刺组捆绑并针刺“人中”“百会”“大椎”穴位[14],捻转法行针1 min并留针30 min(期间15 min时捻转法行针1次,捻转行针频率90次/min),每次12 h共治疗72 h;针刺结合亚低温组联合使用针刺组和亚低温组的处理方法。
1.5 观察指标及方法
1.5.1 神经功能症状评分 参照Zea Longa五级四分法,所有大鼠分别于造模后、72 h后完成神经功能症状评分[12]。
1.5.2 梗死灶面积比测量 72 h后每组随机取5只大鼠,麻醉后取全脑,冰冻固定,切片(约2 mm)后采用TTC 染色法,肉眼观察梗死部位,数码相机拍片,并用 BL-2000 图像分析仪测定梗死面积比。
1.5.3 CIRI大鼠缺血侧海马组织miRNA功能检测 72 h后每组随机择取5只大鼠,取患侧(右)海马用于抽提RNA,采用电泳法检测RNA的完整性并筛选符合基因芯片试验标准的RNA样品。从符合要求的RNA样品中对miRNA依次进行分离、标记及浓缩等处理并进行芯片杂交。使用GenePix 4000B Scanner扫描芯片,荧光波长为635 nm,应用Genepix Pro 6.0提取荧光强度数据并进行分析,筛选并获得每2组间差异表达miRNA(显著性水平为P<0.05),最后通过GO数据库查询相关差异miRNA的功能。
1.5.4 miR-106b-5p表达量检测 72 h后每组随机取5只大鼠。分离患侧(右)海马用于RNA提取,进行miRNA反转录合成cDNA并运用SYBR法进行miR-106b-5p荧光定量PCR检测,miR-106b-5p引物序列为:TAAAGTGCTGACAGT-GCAGAT。
1.6 统计学方法
本实验设计方法为多样本完全随机设计,采用SPSS 17.0软件进行统计分析,实验数据为计量资料,组内自身前后比较,符合正态分布者用配对t检验,不符合者采用配对秩和检验。符合正态分布方差齐者采用单因素方差分析,两两比较采用LSD法,不符合正态分布采用非参数检验,P<0.05为差异有统计学意义。
2 结果
2.1 针刺结合亚低温对CIRI大鼠神经功能症状评分的影响
表1示,造模后组间比较,与正常组及假手术组比较,模型组、亚低温组、针刺组及针刺结合亚低温组神经功能症状评分显著升高(P<0.01),提示模型制备成功。组内与造模后比较,72 h后正常组、假手术组及模型组的神经功能症状评分差异无统计学意义(P>0.05),而3个治疗组(亚低温组、针刺组及针刺结合亚低温组)的神经功能症状评分均显著下降(P<0.01),因此认为3种治疗方式均可改善CIRI大鼠神经功能症状。72 h后组间比较,与正常组及假手术组比较,模型组神经功能症状评分显著升高(P<0.01);与模型组比较,亚低温组及针刺组神经功能症状评分明显下降(P<0.05),针刺结合亚低温组的神经功能症状评分极其显著下降(P<0.01),提示针刺结合亚低温法改善神经功能症状更具优势。
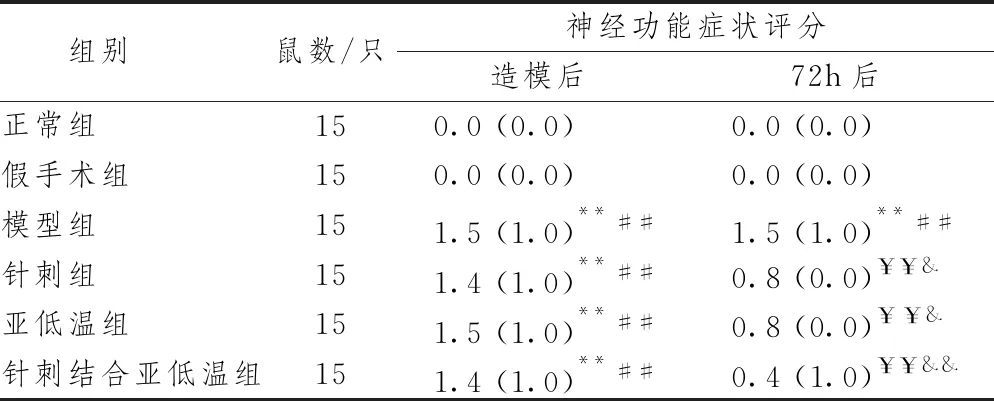
表1 针刺结合亚低温对CIRI大鼠神经功能症状评分的影响[M(Q)]
2.2 针刺结合亚低温对CIRI大鼠脑组织梗死灶面积比的影响
图1示,红色区域为正常脑组织,白色区域为缺血脑组织,即图中蓝色箭头所指。正常组及假手术组未见缺血组织,模型组可见大片缺血组织,亚低温组及针刺组可见明显缺血组织,而针刺结合亚低温组仅见小片缺血组织。
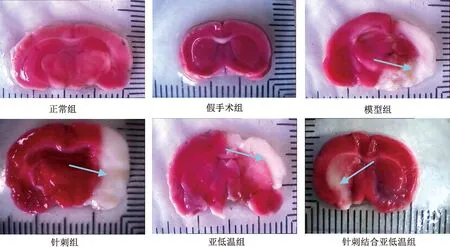
图1 各组大鼠梗死面积TTC染色图
表2示,与正常组及假手术组比较,模型组梗死面积比显著上升(P<0.01),提示CIRI模型制备成功。与模型组比较,亚低温组、针刺组及针刺结合亚低温组梗死面积比显著下降(P<0.05或P<0.01),因此认为3种治疗手段均能有效改善CIRI梗死面积。与亚低温组比较,针刺组梗死面积比差异无统计学意义(P>0.05),针刺结合亚低温组梗死面积比明显下降(P<0.05),说明针刺结合亚低温优于单用亚低温的作用效果。
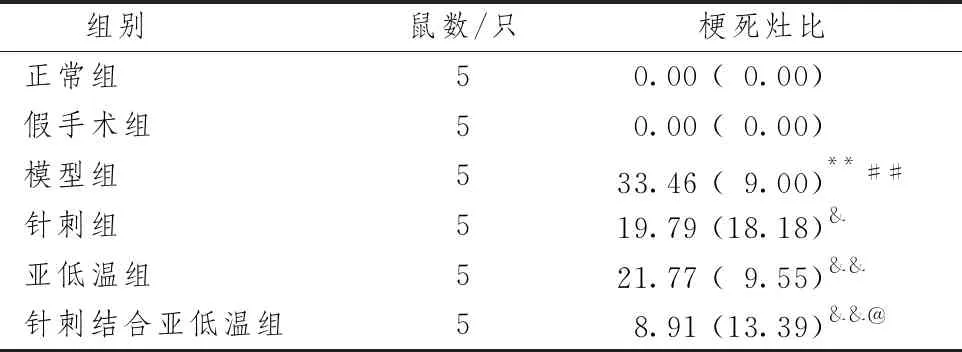
表2 针刺结合亚低温对CIRI大鼠缺血侧梗死面积比影响比较[M(Q)]
2.3 基因芯片检测结果
2.3.1 CIRI大鼠缺血侧海马组织miRNA表达谱 图2示,CIRI大鼠缺血侧海马组织差异miRNA聚类分析图,横列示差异miRNA,纵列示样本组织,其中红色荧光所示为高表达,绿色荧光所示为低表达。
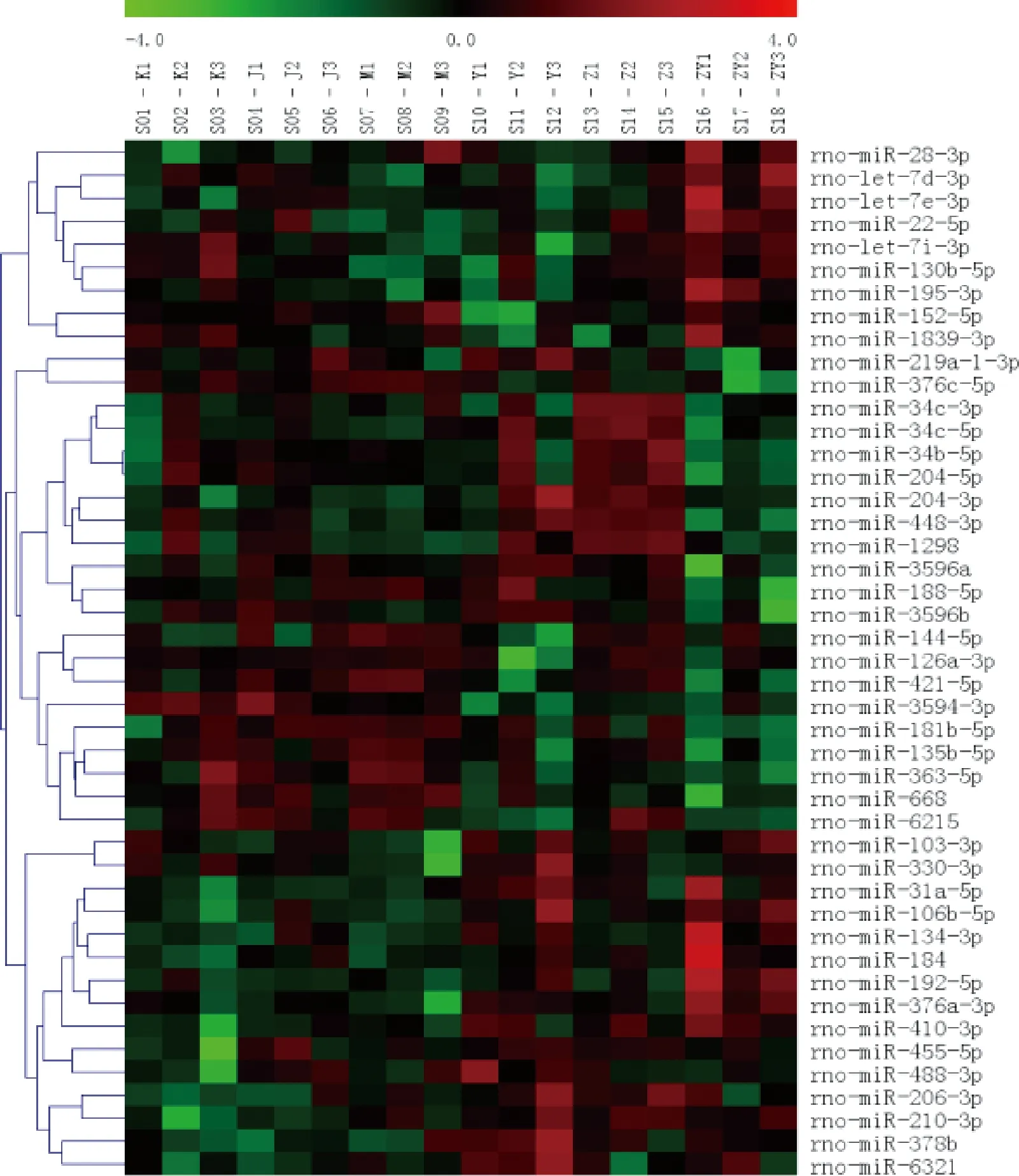
图2 CIRI大鼠缺血侧海马组织差异miRNA聚类分析图
2.3.2 各组间差异miRNA功能情况 图3示,与正常组比较,模型组差异表达4种miRNA,功能包括调节细胞增殖及细胞凋亡,提示造模后部分差异表达miRNA参与CIRI过程,其功能包括调节细胞增殖及细胞凋亡。与假手术组比较,模型组差异表达5种miRNA;与模型组比较,亚低温组差异表达7种miRNA,针刺组差异表达16种miRNA及针刺结合亚低温组差异表达23种miRNA,且差异miRNA功能均涉及调节细胞增殖、细胞凋亡、神经元分化、轴突延伸、基因表达及炎症反应,可见治疗后差异表达miRNA功能丰富。
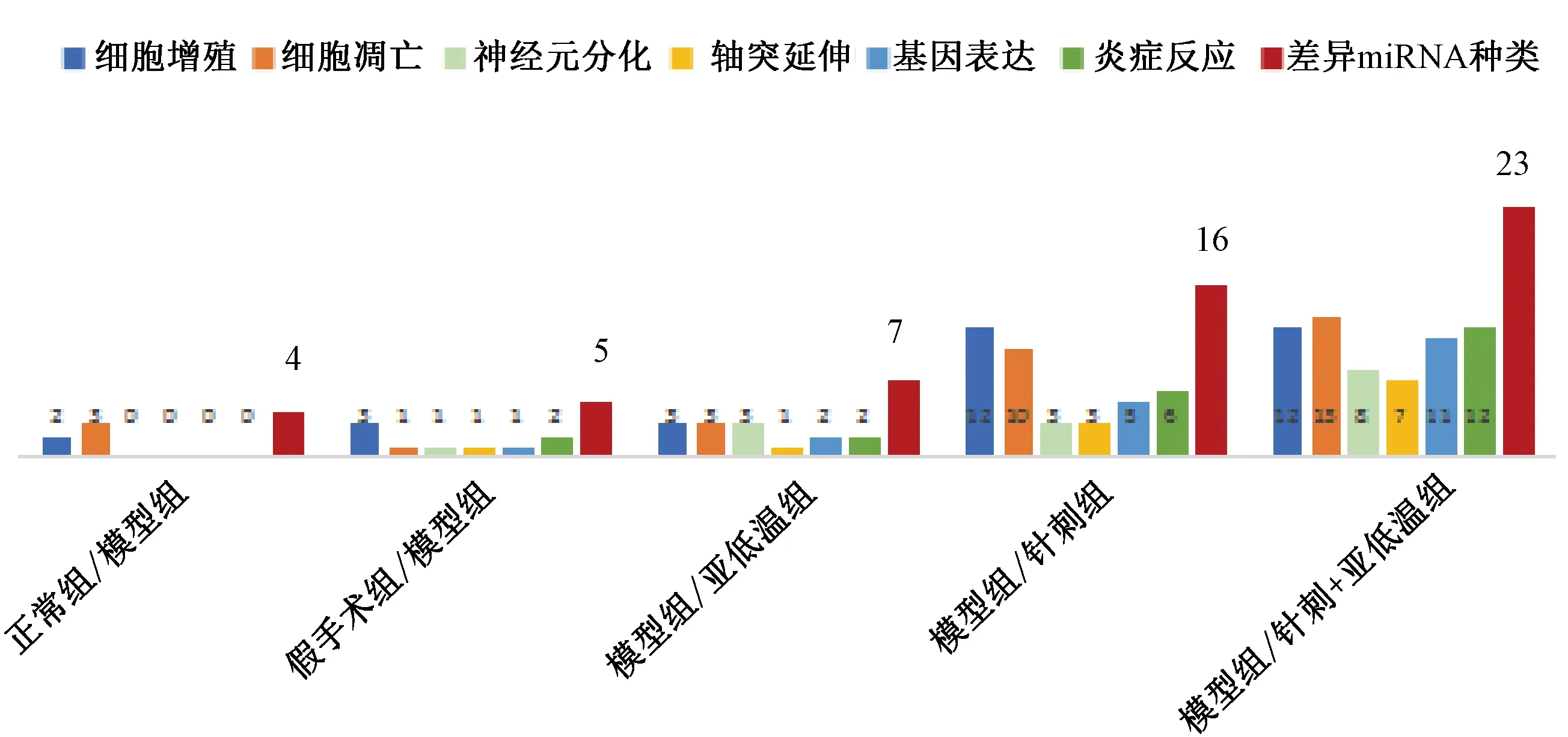
图3 各组间差异miRNA功能比较
2.4 CIRI大鼠缺血侧海马组织miR-106b-5p表达量
表3示,与正常组及假手术组比较,模型组大鼠脑缺血侧海马区miR-106b-5p表达量显著上升(P<0.01),提示miR-106b-5p上调参与CIRI过程。与模型组比较,3个治疗组大鼠脑缺血侧海马区miR-106b-5p表达量均下降(P<0.05或P<0.01),提示3种治疗方式均下调CIRI后缺血侧组织miR-106b-5p表达。与亚低温组比较,针刺组大鼠脑缺血侧海马区miR-106b-5p表达量差异无统计学意义(P>0.05),针刺结合亚低温组大鼠脑缺血侧海马miR-106b-5p表达量明显降低(P<0.05),说明针刺结合亚低温下调miR-106b-5p的表达较单一亚低温处理更具优势。

表3 各组miR-106b-5p相对表达量比较
3 讨论
脑缺血再灌注损伤是缺血性脑卒中的主要并发症,属于中医学“卒中”“中风”[15]范畴。其病情是缺血性脑卒中恢复血供后继发的脑组织损伤,较之原发病更为复杂[16]。迄今为止,抗脑缺血再灌注损伤治疗多从抗炎、抗氨基酸毒性作用、抗钙离子超载、抗一氧化氮累积及抗细胞凋亡等机制展开研究[17],而从基因视角探讨抗CIRI的治疗鲜有报道。针刺是中医临床治疗脑病的常用手段,可以较好地改善患者运动障碍等后遗症,同时有临床研究发现,亚低温法可有效降低大面积急性脑梗死神经功能缺损评分,提升临床治疗效果[18,19]。诸多实验研究证实,单纯针刺或亚低温疗法均对CIRI后miRNA的表达有着重要的调控作用[20,21]。故本研究将中医针刺与亚低温结合作为干预手段,从基因水平探讨针刺结合亚低温抗脑缺血再灌注损伤作用。根据本实验结果可知,与模型组比较,治疗组的神经功能症状评分及脑梗死面积比均下降,说明无论是单独针刺或亚低温,亦或是联合针刺与亚低温的治疗方法均能有效改善CIRI神经功能症状及脑梗死面积。
miRNA家族种类繁多,功能丰富,可参与调节细胞凋亡、细胞增殖、炎症反应等功能活动,与疾病的演变密切相关[22,23]。如miRNA可通过参与脑缺血再灌注过程的神经发生、炎症反应、脑水肿、细胞凋亡及氧化应激等影响CIRI演变[24]。本实验结果显示,造模后4种miRNA发生差异表达,其功能仅调节细胞增殖及细胞凋亡。而应用亚低温、针刺及针刺结合亚低温治疗后,与模型组比较,各治疗组差异miRNA不仅种类大幅增加,而且功能也更为丰富,除可调节细胞增殖及细胞凋亡外,还可调节神经元分化、轴突延伸、基因表达及炎症反应,由此可见CIRI损伤的修复与差异miRNA功能的丰富相关。而与其他2种治疗方法比较,针刺结合亚低温组各功能的差异miRNA数量占据明显优势,可见针刺结合亚低温抗CIRI的效果与激发差异miRNA功能密切相关。
miR-106b-5p是miRNA家族成员之一,与诸多疾病的诊断、治疗及预后有关[10,11]。李鹏飞等[25]认为,血清中miR-106b-5p对提高诊断缺血性脑卒中的准确性具有重要意义。本实验在造模后发现,miR-106b-5p表达上调,与上述观点一致,可见miR-106b-5p的表达水平关乎CIRI的发生。而运用亚低温、针刺及针刺结合亚低温法干预后可下调miR-106b-5p表达,说明这几种治疗手段均可通过下调miR-106b-5p,改善CIRI实现脑保护,且下调miR-106b-5p表达量或决定了CIRI改善程度。
针刺治疗脑血管疾病的疗效值得肯定[26],但事实上单纯针刺法治疗脑卒中在临床并不常见,多联合使用其他手段进行治疗,如针电结合、针药结合及针刺联合康复训练等方法,在获得不错的临床效果的同时,也普遍被患者及患者家属所接受[27-29]。而诸多研究同样证实,亚低温可从多方面达到抗CIRI的目的[30]。本实验运用针刺结合亚低温法治疗CIRI大鼠,结果发现针刺结合亚低温法对改善CIRI神经功能症状及脑梗死面积较单纯针刺或亚低温法更具优势。
综上所述,针刺结合亚低温法可有效改善CIRI,且其机制或与miRNA功能及下调miR-106b-5p表达量进而实现脑保护有关,值得临床推广应用。

