逍遥散对慢性轻度不可预见应激抑郁大鼠中枢多巴胺及其受体的影响❋
张欢润, 岳广欣, 梁 媛, 杨婧雯, 李 妍, 吴望男, 聂文祎, 楚天云, 巩子汉, 佘楷杰
(中国中医科学院中医基础理论研究所, 北京 100700)
抑郁症以显著而持久的心境低落为主要临床特征,其高复发率、高自杀率对个人及社会造成了较大危害[1]。近年来,抑郁症的发病率呈显著上升趋势,有学者预计,由该病所产生的相关支出将在2030年成为全球范围内所有疾病负担之首[2]。抑郁症的发病机制有很多假说,单胺神经递质学说受到广泛认可。多巴胺(dopamine,DA)是奖赏功能最重要的神经递质,与人的精神情绪活动密切相关,多项研究表明,抑郁症的发病与DA的含量下降有关[3]。
目前临床上有很多治疗抑郁症的药物,如三环及四环类抗抑郁药、单胺氧化酶抑制剂和选择性 5-羟色胺再摄取抑制剂等,但仅对 1/3 的患者显现出明显改善作用,且药物起效存在数周至数月的潜伏期[4]。中医药抗抑郁具有多靶点、疗效好、不良反应少等独特优势。大量临床与实验文献证实,肝郁脾虚证是抑郁症最常见的证型,逍遥散是中医治疗肝郁脾虚证的经典方剂,对抑郁症有着明确的治疗效果[5,6]。课题组前期实验发现,慢性轻度应激大鼠出现糖水摄入量减少、食欲与性欲下降等奖赏功能紊乱的症状表现,且伴有中枢和外周多巴胺(dopamine,DA)含量变化,逍遥散对此具有明显的调节作用[7,8]。在前期研究基础上,提出解郁名方逍遥散除了能够通过调节神经-内分泌-免疫网络、神经突触可塑性以及脑肠轴等多方面机制发挥抗抑郁效应[5]之外,是否还能对奖赏功能产生影响这一科学性问题。因此,本研究从奖赏脑区DA及其受体与转运体的基因与蛋白表达水平等方面,观察逍遥散对应激抑郁大鼠的干预作用,进一步探究逍遥散治疗抑郁症的作用机制。本研究已通过中国中医科学院中医基础理论研究所实验动物伦理委员会批准,批准号2019-003。
1 材料与方法
1.1 动物
SPF级健康雄性SD大鼠60只,体质量180~220g,购于北京维通利华实验动物技术有限公司,生产许可证号SCXK(京)2016-0006。饲养于中国中医科学院中医基础理论研究所SPF级动物房,许可证号SYXK(京)2021-0017。室温22±2 ℃,湿度34%~44%,明暗周期12 h,适应性喂养3 d后进行实验。
1.2 中药及其制备
逍遥散组成:柴胡15 g,当归15 g,白芍15 g,白术15 g,茯苓15 g,生姜5 g,薄荷5 g,炙甘草7.5 g,组方选自《太平惠民和剂局方》。中药饮片购自北京同仁堂(亳州)饮片有限责任公司,生产许可证号(皖)Y20170043,生产批号800000397。以上中药分别加10倍、8倍、8倍水煎煮3次,过滤沉渣、浓缩、低温真空干燥为浸膏,粉碎、低温干燥备用。使用前稀释为含生药7.41 g/mL的中药混悬液[9]。
1.3 主要试剂与仪器
DA、3,4-二羟基苯乙酸(3,4-dihydroxyphenylacelic acid,DOPAC)、高香草酸(homovanillic acid,HVA)标准品,96%(Extrasynthese,北京索莱宝生物科技有限公司);色谱柱为 XB-C18(50 mm×2.1 mm,1.8 μm,美国Welch公司);Trizol试剂(货号15596-026,美国Invitrogen公司);所有引物均由宝生物(大连)工程有限公司合成;SYBR Green PCR荧光定量试剂盒(货号4368708,美国Applied Biosystems公司);多巴胺受体1(Dopamine receptor 1,D1R,abcam,货号ab20066),多巴胺转运体(dopamine transporter,DAT,abcam,货号ab18445), 多巴胺受体2(dopamine receptor 2,D2R,Proteintech,货号55084-1-AP),以上一抗均购自北京永泰兴成商贸有限公司。
3K15sICbIA高速泠冻离心机(上海珂淮仪器有限公司);Nexera UHPLC LC-30A高效液相色谱仪(Shimadzu),Mass Spectrometer QTRAP 4500 三重四极杆质谱仪(AB Sciex)。
1.4 分组与造模
根据课题组前期实验方法进行应激易感大鼠的筛选,即施加2周应激因素后按糖水测试结果将应激大鼠分为应激易感大鼠(糖水消耗下降40%以上)与应激恢复大鼠(糖水消耗未减少),取应激易感大鼠纳入下一步实验,随机分为模型组和逍遥散组[8],另设正常对照组5只/笼群养共10只。模型组与逍遥散组大鼠继续施加4周的应激因素,连续造模时间共计6周[8]。应激与灌胃给药过程中陆续有大鼠损耗,最后模型组10只,逍遥散组14只大鼠纳入行为学实验。
1.5 给药方法
逍遥散组大鼠从第3周开始灌胃逍遥散混悬液,连续给药4周。每天开始应激前30 min给药,根据前期实验制定最佳给药剂量为2.224 g·kg-1·d-1,以生药量计算为中剂量[10]。模型组和正常组大鼠灌胃相同体积纯水。造模加灌胃4周后进行行为学检测。
1.6 行为学检测
1.6.1 旷场实验 大鼠适应行为学室15 min后,放入旷场箱(120 mm×120 mm×45 cm)中心点,设中心点附近60 mm×60 cm区域为中央区,其余区域为周围区。记录各组大鼠5 min运动总距离(mm)、中央区进入次数(次)、中央区停留时间(s)、中央区运动距离(mm)、周围区停留时间(s)和周围区运动距离(mm)。
1.6.2 O迷宫 O迷宫是改良的高架十字迷宫,外径95 cm、内径85 cm,分为开臂和闭臂,闭臂高20 cm,O迷宫离地面高60 cm。实验时将大鼠放入开臂上,头向闭臂,观察5 min内大鼠的开放臂停留时间(s)、开放臂运动距离(mm)、封闭臂停留时间(s)、封闭臂运动距离(mm)、5 min平均速度(mm/s)和5 min运动总距离(mm)。
1.7 液质联用(high performance liquid chromato-graphy-mass Sp,HPLC-MS)方法检测前额皮质与伏核DA、DOPAC、HVA浓度
行为学实验完成后每组各取5只大鼠麻醉处死,冰上剥脑,用飞鹰牌保安刀片切出各层脑片,手术刀剥离出前额皮质与伏核。取前额皮质与伏核样本50 mg~60 mg,加入0.1%甲酸-水混合物匀浆,离心、复溶后取上清液进样。色谱条件:水相为0.1%甲酸水溶液(DA&DOPAC)/纯(HVA),有机相为乙腈,流速0.3 mL/min,柱温40 ℃,进样量5.00 μL。用 Analyst(AB Sciex)软件采集目标物的色谱图并计算积分,以 1/X2为加权系数进行线性回归。
1.8 荧光定量PCR检测前额皮质与伏核D1R、D2R、DAT(SLC6A3 )mRNA表达
每组各取5只大鼠,Trizol法提取各组大鼠左侧脑前额皮质与伏核的总RNA,使用Nanodrop 2000检测RNA浓度及纯度,将浓度过高的RNA进行适当比例稀释,使其终浓度为100~500 ng/μL。采用逆转录试剂盒反转录合成cDNA,存入-20 ℃保存备用。使用SYBR Green PCR荧光定量试剂盒检测D1R、D2R、DAT(SLC6A3)转录表达水平,以GAPDH作为内参。所有引物均由宝生物(大连)工程有限公司合成,2-ΔΔCt法进行相对定量分析。

表1 引物序列表
1.9 Western blot检测前额皮质与伏核脑区D1R、D2R、DAT蛋白表达
收集各组大鼠右侧前额皮质与伏核到EP管中,提取组织总蛋白并对浓度进行测定。各组统一取蛋白样品20 μg进行 12.5% SDS-PAGE电泳,蛋白分离并转移至PVDF膜上。经5%脱脂牛奶37℃、封闭2 h、PBST洗膜后加入相应的一抗(D1R 1∶1000,D2R 1∶1000,DAT 1∶1000)4 ℃孵育过夜。内参为β-actin(1∶3000),PBST洗膜5×15 min,依次加入山羊抗兔的二抗(1∶3000)37 ℃ 孵育 1 h后,TBST 洗膜 5×15 min,在膜上滴加ECL显色液后进行曝光、显影和定影,采用PhotoShop和Alpha整理去色、分析目标光密度值。
1.10 统计学方法
2 结果
2.1 各组大鼠旷场实验结果
表2示,慢性轻度不可预见应激模型大鼠5 min旷场实验中央区进入次数与停留时间、中央区运动距离均有极其显著减少(P<0.01),5 min运动总距离明显下降(P<0.05),表明逍遥散能显著上调中央区进入次数(P<0.05)。
表2 各组大鼠旷场实验结果比较
2.2 各组大鼠O迷宫实验结果
表3示,慢性轻度不可预见应激模型大鼠5 min平均速度、开放臂停留时间、开放臂运动距离、封闭臂运动距离、5 min运动总距离均有显著下降(P<0.05,P<0.01),封闭臂停留时间明显上升(P<0.05),除封闭臂运动距离外,逍遥散对其余指标均有显著上调作用(P<0.05,P<0.01)。
表3 各组大鼠O迷宫实验结果比较
2.3 各组大鼠前额皮质与伏核DA、DOPAC、HVA含量比较
图1、2示,与正常组比较,模型组前额皮质与伏核中DA与DOPAC含量、伏核中HVA含量均明显低于正常组(P<0.05,P<0.01),表明逍遥散能显著上调模型组各脑区DA和HVA水平(P<0.05,P<0.01)。逍遥散组前额皮质中DOPAC含量也有显著上升(P<0.01),伏核脑区中DOPAC水平虽有上调趋势,但与模型组比较差异无统计学意义(P>0.05)。
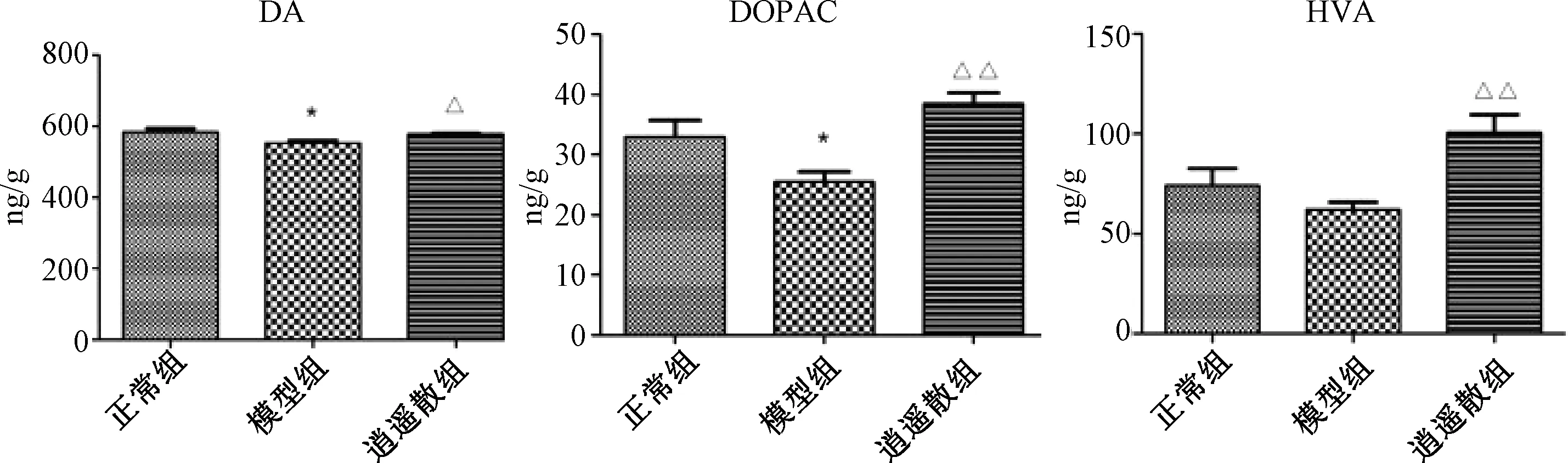
注:与正常组比较:*P<0.05;与模型组比较:△P<0.05,△△P<0.01
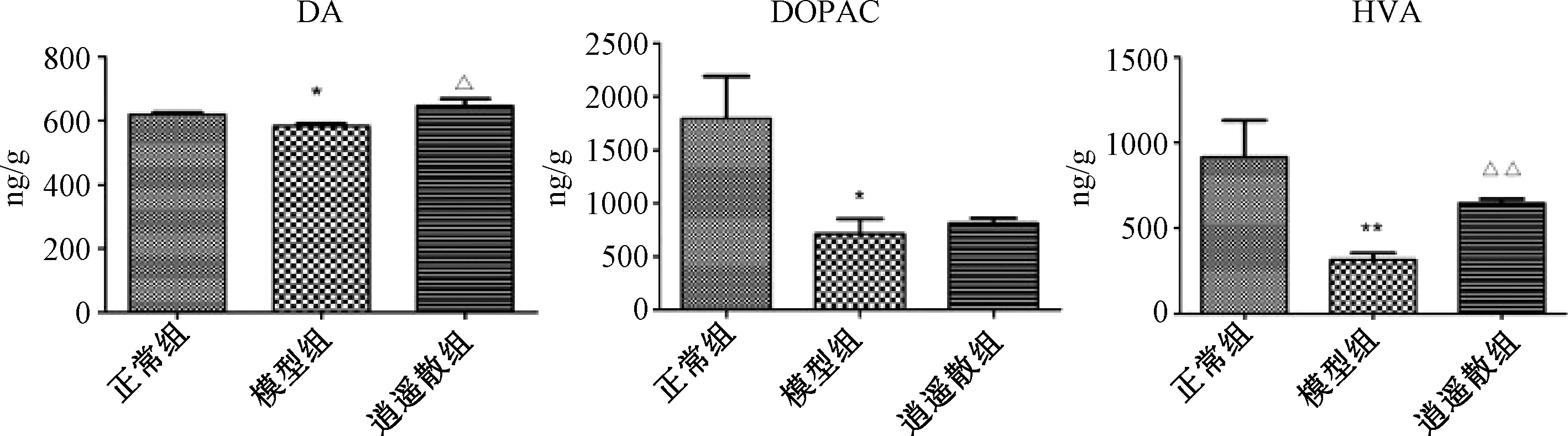
注:与正常组比较:*P<0.05,**P<0.01;与模型组比较:△P<0.05,△△P<0.01
2.4 各组大鼠前额皮质D1R、D2R、DAT的蛋白与mRNA表达
图3示,前额皮质与正常组比较,模型组D1R的蛋白与mRNA表达均显著上升(P<0.01),DAT的蛋白表达明显增加(P<0.05),逍遥散对上述指标均有显著下调作用(P<0.05,P<0.01)。模型组D2R的蛋白与mRNA表达较正常组均有明显下降(P<0.05),逍遥散对其均表现出显著的上调作用(P<0.05,P<0.01)。
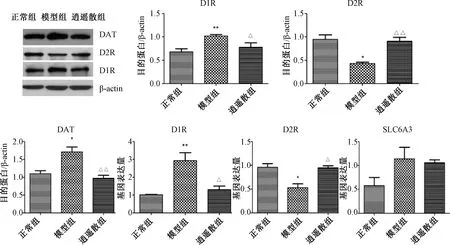
注:与正常组比较:*P<0.05,**P<0.01;与模型组比较:△P<0.05, △△P<0.01
2.5 各组大鼠伏核D1R、D2R、DAT的蛋白与mRNA表达
图4示,伏核与正常组比较,模型组D1R蛋白与mRNA表达均显著上升(P<0.01),DAT的蛋白与SLC6A3 mRNA表达也显著上升(P<0.05),逍遥散对上述指标均有显著下调作用(P<0.05,P<0.01)。模型组D2R的蛋白与mRNA表达较正常组均有明显下降(P<0.05),逍遥散能够显著上调D2R蛋白表达(P<0.05)。
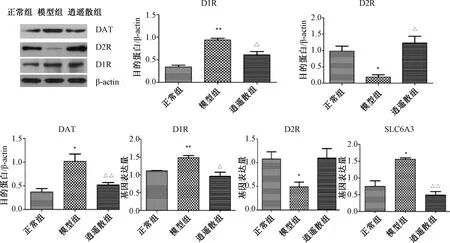
注:与正常组比较:*P<0.05,**P<0.01;与模型组比较:△P<0.05,△△P<0.01
3 讨论
慢性不可预见应激模型在动物实验中应用广泛,可模拟人类抑郁症发病机制[11]。旷场实验、高架O迷宫是评价啮齿类动物抑郁焦虑情绪的经典方法[12]。行为学结果显示,慢性轻度不可预见应激模型大鼠在旷场实验中活动性明显降低,在中央区域的进入次数与停留时间也较正常对照组显著下降。在O迷宫开放臂停留时间、进入次数及运动距离均有明显降低,在封闭臂的停留时间明显延长。分析结果可知,造模使大鼠对陌生环境的探索与适应能力下降、主动性与积极性降低,焦虑情绪增长,表现出明显的抑郁样症状。
单胺类神经递质在中枢神经系统中起极其重要的作用[13]。DA是奖赏系统中主要神经递质之一,DOPAC和HVA是DA的主要代谢产物,能够反映中枢DA神经元的功能状态[13]。本研究中,模型组大鼠在接受慢性应激刺激后,前额皮质、伏核脑区DA、DOPAC、HVA的含量均较正常组明显下降。与国外1项研究发现,慢性应激能够减少内侧前额叶皮质中DA含量,与提高啮齿类动物在社会击败中的易感性结果一致[14],说明慢性应激可能是通过下调脑内DA及其代谢产物水平,进而影响奖赏系统功能、导致快感减低等抑郁相关的症状表现。
神经受体假说认为,抑郁症的发病与DA受体异常表达相关[15]。DA受体可分为D1样和D2样受体两类。D1R属于兴奋型D1样受体,主要定位于突触后膜,激活后能够诱发多个细胞内信号通路,增强神经元的兴奋性,参与个体快感体验能力的维持[16]。实验证实,给小鼠注射D1R受体拮抗剂可以减少其运动动机[17]。D2R属于D2样受体,分布于DA能神经元突触前膜,其所介导的信号通路作用与D1R正好相反,D2R和DA结合后可以通过激活G蛋白门控内向整流钾离子通道,反过来使DA能神经元发生超极化,降低DA神经元兴奋性,抑制DA的释放[18]。伏核参与奖励相关过程,激活伏核中阿片类受体和内源性大麻素受体,增强机体对食物奖励的情感反应。但在快感缺失人群中,这种奖励进程会被中断[19]。前额皮质是除海马以外最容易受到应激影响的脑区之一,慢性应激导致的前额皮质神经形态、突触密度与功能的改变与多种情绪与认知功能失调有关[20]。本研究结果显示,慢性轻度不可预见应激抑郁大鼠前额皮质和伏核脑区D1R mRNA与蛋白表达较正常组有所上升,D2R mRNA与蛋白表达下降。与抑郁症自杀者尸检发现,脑纹状体组织中D1R含量增加结果一致[21],说明DR1和D2R均参与慢性轻度不可预见应激抑郁的发生过程,其相反的表达趋势可能与二者在抑郁发病过程中所发挥的作用并不相同有关。本研究还发现,抑郁模型大鼠脑组织中DAT的基因与蛋白表达上升。DAT位于神经细胞突触前膜,可调节细胞内DA存储池的存储数量,在维持多巴胺能神经传递的稳态方面有十分重要的作用。DAT受体增加会引发突触间隙DA的耗竭,突触后D1和D2受体表达代偿性改变[25]。对转基因小鼠的研究发现,DAT基因敲除小鼠细胞外DA浓度增加了5倍,而DAT基因加载小鼠纹状体细胞外DA水平持续性降低,并显示出突触后D1R水平有显著升高[26]。故推测本实验中DAT和DA受体的变化都反映了应激后DA能系统处于非稳态状态,进而导致个体对长期慢性应激表现出超敏反应,影响到动物的行为与情绪。
内科名方逍遥散出自《太平惠民和剂局方》,由柴胡、白芍、白术、茯苓、当归、甘草、生姜、薄荷8味药物组成,能疏肝解郁、养血健脾,是临床常用调和肝脾的代表方,对抑郁症有明确的治疗作用[24-26],其抗抑郁的作用可由多种机制介导。本实验中,逍遥散能显著上调旷场中央区进入次数,上调O迷宫实验中5 min平均速度、开放臂停留时间、开放臂运动距离、5 min运动总距离,减少封闭臂停留时间,使抑郁状态改善。同时,逍遥散对模型大鼠各脑区的DA、DOPAC和HVA水平有不同程度上调作用,还能显著降低模型大鼠前额皮质与伏核脑区中D1R mRNA及蛋白表达,升高前额皮质D2R mRNA及蛋白表达水平,对伏核脑区中DAT mRNA及蛋白表达也有下调作用。根据行为学及指标进行推测,逍遥散对慢性轻度不可预见应激抑郁大鼠的治疗作用,可能与其调节模型大鼠前额皮质与伏核脑区DA及其代谢产物水平,DA受体D1R、D2R及DAT的表达,反馈性地调节DA受体平衡与稳定状态相关,其干预机制可能包括逍遥散能够通过阻断突触后DA受体,使DA能神经元反馈性兴奋,释放更多的DA神经递质;逍遥散通过抑制突触前膜DAT,降低对突触间隙DA的重摄取与转运,从而减少对DA的清除,使突触间隙DA含量增加或DA消减时间延长,从而增强DA神经元介导的奖赏效应。

