经自然腔道(肛门)取标本腹腔镜下右半结肠切除术6例报告*
刘 楠 邢光远 茹东跃 刘 奇 朱绍凤 陈德兴
(吉林省前卫医院普外科,长春 130012)
随着微创技术的不断进步,经自然腔道取标本手术(natural orifice specimen extraction surgery,NOSES)蓬勃发展,通过改变传统的标本取出方式,达到腹壁手术创伤更小,术后恢复更快的效果[1~4]。2017年与2019年《中国NOSES 联盟,中国医师协会结直肠肿瘤委员会NOSES专委会,结直肠肿瘤经自然腔道取标本手术专家共识》的对比显示,NOSES的适应证在逐步扩大,同时也提高手术团队的经验要求[5]。传统腹腔镜下右半结肠切除术需要在腹部做5~6cm切口以完成手术标本的取出,此切口增加患者的术后疼痛,并带来一系列影响,如延缓术后排气时间、延长术后进食时间,且小切口不仅影响美观,还可能发生切口疝等并发症。目前,我国NOSES在右半结肠手术中的应用研究相对较少,2018年4月~2019年我科对6例右半结肠良性病变行无辅助切口经自然腔道(肛门)取标本腹腔镜下右半结肠切除术,现报道如下。
1 临床资料与方法.
1.1 一般资料
本组6例,男5例,女1例。年龄30~71岁,中位年龄60岁。1例(病例1)因急性阑尾炎行腹腔镜手术,术中见肠壁增厚,行纤维结肠镜检查示回盲部溃疡性病变并伴肠腔狭窄,既往腹痛、慢性腹泻,诊断为慢性阑尾炎;2例(病例2、6)因有家族性息肉史、直系亲属大肠癌史,常规体检结肠镜示结肠肿物,表现为广基底无蒂,超声内镜提示肿物深度超出黏膜下层;3例(病例3~5)以下腹部间断性疼痛为主要临床表现,偶伴有乏力,无明显低热及消瘦。病变直径4.0、3.0、3.0 cm。病变部位: 回盲部3例,升结肠1例,肝曲1例,横结肠近肝曲1例。6例一般情况见表1。
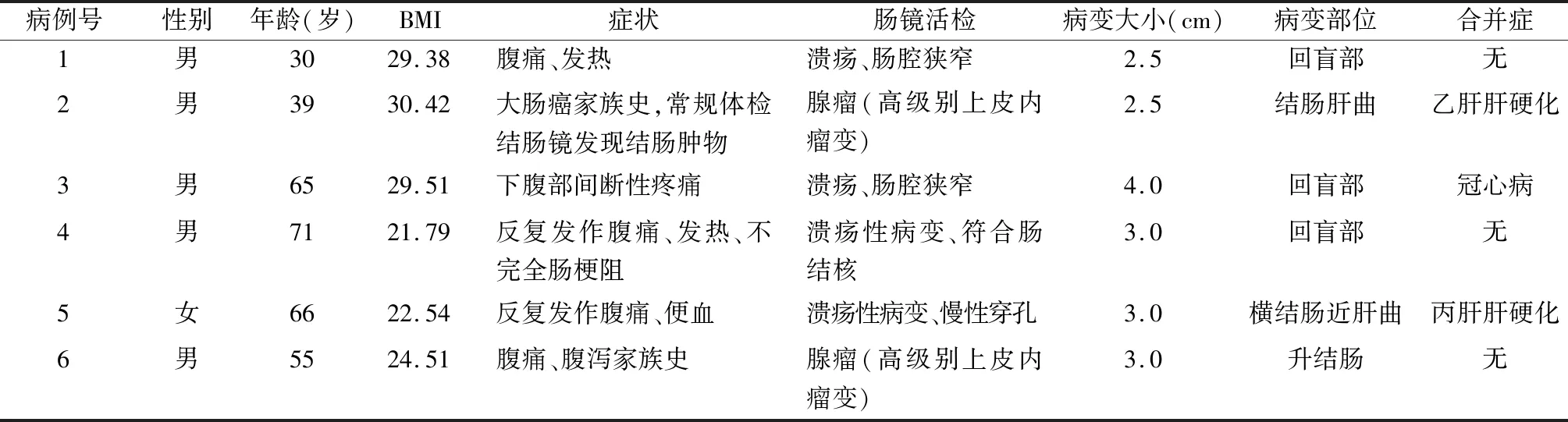
表1 6例一般资料
病例选择标准:①术前经肠镜及病理检查证实为良性病变或癌前病变;②术前 CT 检查无肝脏、肺部、腹膜病变;③无严重心脏心脑血管疾病,肝功能Pugh-Child A级或经过治疗可达Pugh-Child A级;④患者及家属接受此项技术及相关风险。
1.2 方法
术前患者及其家属签署知情同意书。术前常规肠道准备结束后,术晨应用0.5%碘伏溶液灌肠保留5~10 min。全身麻醉,截石位。取脐下 5 cm 处切口长约 1 cm,置入 10 mm trocar,建立气腹后置入腹腔镜,镜下于右中腹、右下腹、左中腹、左下腹置入 5、5、12、5 mm trocar,显露肠系膜根部及肠系膜上血管主干投影。将后腹膜沿肠系膜上血管方向剪开,显露该静脉,在十二指肠水平部下方显露回结肠血管主干,Hem-o-lok夹闭后离断,由此进入Toldt间隙。超声刀锐、钝性分离,向头侧暴露十二指肠及胰腺头部,暴露结肠右血管主干,Hem-o-lok夹闭后离断,向右侧游离至右结肠旁沟侧腹膜。超声刀离断回肠系膜直至距回盲瓣 15 cm 处,用切割缝合器离断回肠,横结肠预切除处直线切割缝合器离断结肠。经12 mm trocar置入电线保护套,肛门置入结肠镜,进入横结肠断端,注入2%碘伏,结肠断端周围碘伏纱条保护,超声刀开放结肠,结肠镜置入镜下圈套器将保护套经肛门拖出,再次经保护套内置入结肠镜(图1),结肠镜圈套器套牢回肠末段,同时用肠钳将标本拉直并辅助进入结肠保护套内(图2),将标本经直肠、肛门取出(图3),行快速病理检查。腹腔镜下直线切割缝合器封闭结肠开口,回肠-结肠侧侧吻合,3-0薇乔线缝合共同开口。吻合完毕后再次置入结肠镜观察吻合口无出血、狭窄,是否通畅。术区充分冲洗,吸净冲洗液,于吻合口及盆腔各留置螺旋引流管 1 根。
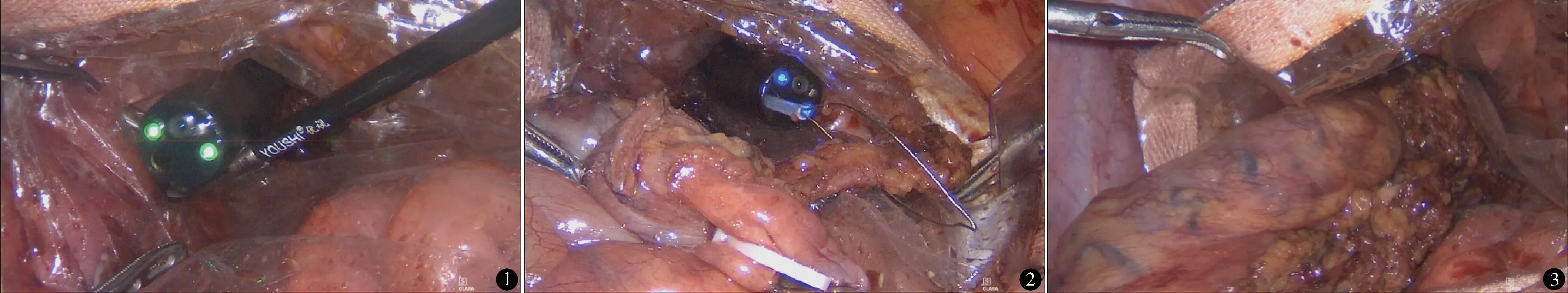
图1 经保护套内置入结肠镜 图2 用结肠镜圈套器套牢肠管 图3 将标本经肛门取出
2 结果
6例均顺利完成手术,无一例中转开腹。手术时间(204.8±47.4) min;术中出血量20~150 ml,中位数50 ml;术后肛门排气时间(23.5±7.7) h;术后进半流食时间(4.2±0.8)d;术后(10.5±2.6)d 顺利出院。1例术后发热体温最高38.6 ℃,应用抗炎药物术后第3天体温恢复正常,未发生腹腔脓肿等腹腔感染,无肠梗阻、吻合口漏等并发症。6例随访3~12个月,中位随访时间10个月,无并发症发生,病例4术后继续给予抗结核治疗。见表2。
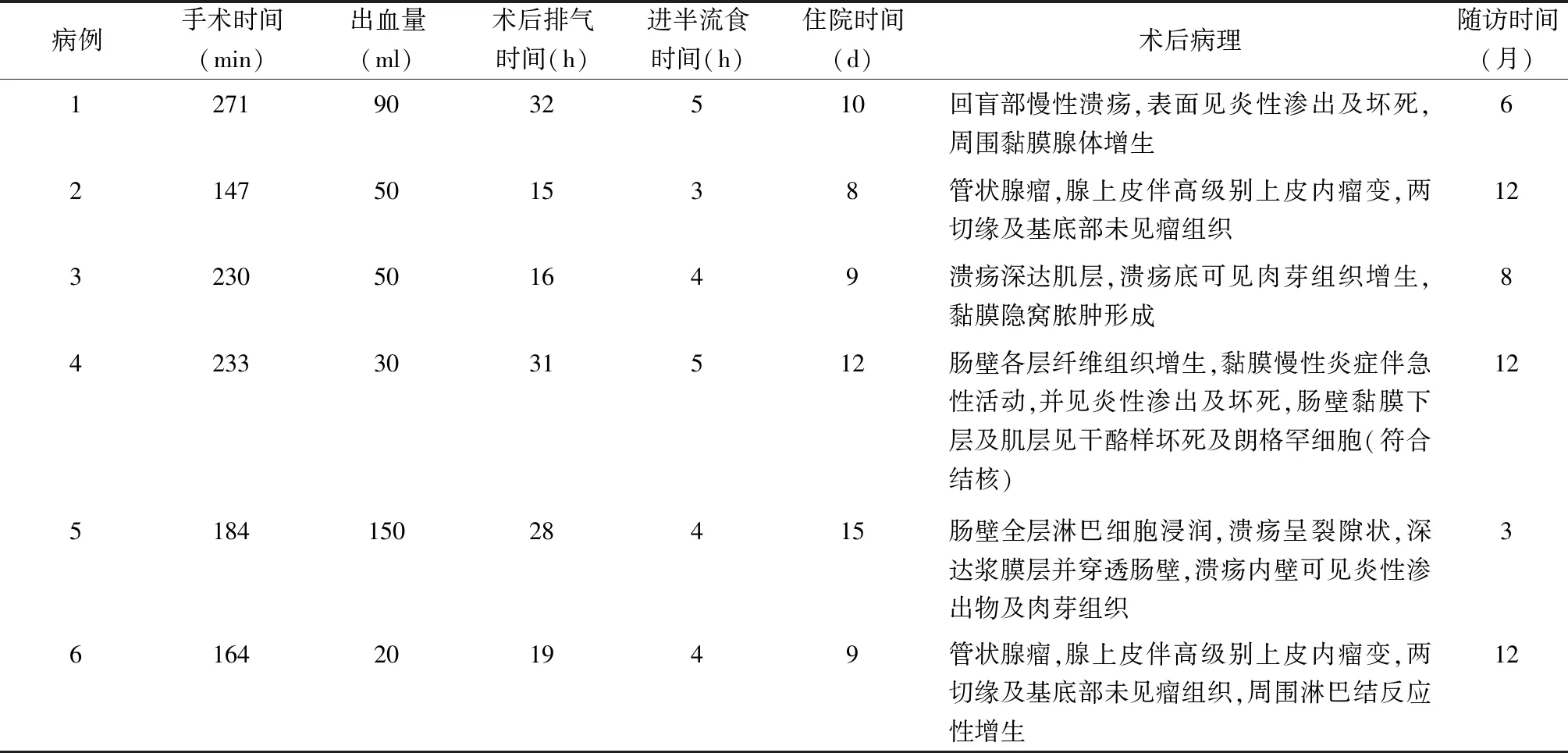
表2 6例术中、术后情况
3 讨论
目前,我国专家共识中推荐的结直肠 NOSES 术式主要有10种,手术方式覆盖结直肠各个部位。结肠NOSES 包括五类手术,主要适用于左半结肠、右半结肠以及全结肠。CRC-NOSES Ⅷ(A、B 法)是治疗右半结肠癌的推荐术式[6]。林峰等[7]研究表明经自然腔道取标本腹腔镜下右半结肠癌根治术具有良好的近期疗效且不影响患者的盆底功能。NOSES 的定义已明确表明这项技术的本身是基于传统腹腔镜手术的基础上完成腹盆腔内各种常规手术操作(切除与重建),所以手术的关键点及难点在于如何保证无菌无瘤操作过程,尤其是经自然腔道取标本右半结肠手术,从标本切除至标本取出整个过程均有增加腹腔感染、肿瘤细胞脱落的可能[8,9]。
本组6例均属于右半结肠良性病变,因该术式存在相应的操作难度,故此项技术开展早期我们选择的入组病例均为良性病变。良性病变需做右半结肠切除者包括回盲部结核、慢性回盲部套叠、盲肠扭转、回盲部慢性炎症性肉芽肿、右半结肠多发息肉病、外伤、复杂粪瘘、慢性局限性肠炎、阑尾类癌等[10]。病例1为青年男性,诊断为慢性阑尾炎多年,反复发作腹痛及偶尔发热,慢性阑尾炎急性发作行腹腔镜手术时见回盲部肠壁增厚、僵硬,术后结肠镜检查示回盲部溃疡性病变并伴肠腔狭窄、镜身勉强通过。病例2、6术后病理为癌前病变,均有大肠癌家族史,根据超声内镜判断的病变侵及深度,选择行右半结肠切除术可达根本治疗的目的。病例3因肠梗阻入院,反复发作多次,经保守治疗后好转后结肠镜检查示回盲部溃疡性病变导致肠腔狭窄。病例4为老年男性患者,有肺结核病史,口服抗结核药物后肺结核控制尚可,反复发作的腹痛、低热、不完全性肠梗阻,结肠镜提示溃疡性病变伴有肠腔狭窄,活检符合结核改变,为解除肠梗阻而行右半结肠切除术,术后继续给予抗结核治疗。病例5为老年女性患者,间断性腹部2年、便血病史6个月,腹部CT提示结肠肝曲肠壁明显增厚,肠周脂肪间隙浑浊,结肠镜示结肠肝曲溃疡性病变合并慢性肠穿孔,肠腔狭窄镜身通过困难。
按照我国目前的分类标准,本组采用的术式并不包括在现有的NOSES中,既不经阴道,也不经直肠拖出标本,而是经横结肠断端开口,经肛门取出标本。因右半结肠切除的标本体积大,取出所经过的路程长,增加标本取出的难度,同时也提高术前肠道准备及术中保持操作无菌性的要求。术前常规肠道准备结束后,术晨应用0.5%碘伏溶液灌肠保留5~10 min,术中再将2%碘伏溶液注入至横结肠断端,并在肠镜的配合下吸净,以减少切开横结肠断端时对腹腔的污染几率。病例1术前未用0.5%碘伏溶液灌肠,考虑患者术后出现发热可能于此有关。该患者取标本时也未用电线套辅助,术后我们总结经验,标本取出时采用肠镜全程配合,同时应用电线保护套辅助,增加肠管间的滑动性的同时减少腹腔感染的机会。标本取出需经部分横结肠、降结肠、直肠、肛管,在取出的过程中难免会遇到阻力,尤其在横结肠脾区处,需要熟练的内镜操作与手术操作经验配合,标本在取出前需在无菌标本袋中经简单修剪,并在取出时配合拉动标本肠管以保持肠管在一直线水平上更易取出。取标本的操作相对其他术式略显复杂,同时也限制病变的大小,一般情况下病变直径应在3 cm左右。目前,我们选择的病例基本均为良性病变,仅1例(病例2)为癌前病变。该术式的优势在于并未增加其他脏器的损伤,如阴道、直肠前壁等,降低术后直肠漏、阴道漏等并发症发生的几率,避免术后出现直肠狭窄或盆底功能障碍,同时也减轻患者术后腹痛的程度。
综上所述,完全腹腔镜下右半结肠切除术经自然腔道(肛门)取标本安全、可行,因病例数少,需积累更多经验以缩短手术时间,提高取标本的速度及成功率。

