亚气生球状绿藻一新种
——重庆单星藻
王清华 宋会银 刘旭东 胡征宇 刘国祥
(1. 太原师范学院生物系, 晋中 030619; 2. 中国科学院海洋研究所海洋生态与环境科学重点实验室, 青岛 266071; 3. 山西大学生命科学学院, 太原 030006; 4. 中国科学院水生生物研究所中国科学院藻类生物学重点实验室, 武汉 430072)
单星藻属CoelastrellaChodat隶属于绿藻纲Chlorophyceae环藻目Sphaeropleales栅藻科Scenedesmaceae空星藻亚科Coelastroideae, 属内植物多为单细胞或聚合群体, 常附生于干燥或潮湿的石块、墙壁或树皮表面等气生和亚气生环境, 有时也可见于淡水水体。单星藻属主要的形态特征是细胞呈球形、椭球型或呈纺锤形, 细胞壁具一端或两端顶点增厚, 多数细胞壁表面具规则的纵向分布的肋纹, 但部分种类肋纹仅在扫描电镜下可见, 而在光镜下并不明显。
单星藻属植物具有共性特征, 即在自然生长后期或是在高盐、高光等胁迫条件下, 藻细胞极易积累类胡萝卜素和油脂而变为橙黄色至砖红色外观,主要积累的类胡萝卜素有角黄素、虾青素、叶黄素、紫黄素和金盏花黄质等[1,2]。近年来, 大量新发现的单星藻藻株被应用于生理学研究。有研究表明, 一株分离于中国台湾南部热带地区能耐受高温环境的单星藻藻株Coelastrellasp. F50, 其积累类胡萝素的含量可占细胞干重的4%以上[3]。藻株Coelastrellasp. M60在3%的NaCl盐胁迫条件下, 细胞积累油脂含量可占细胞干重的37%以上[4]。除了在天然抗氧化剂、食品色素和生物油脂等生物质生产方面的优势, 该类群在生物水环境监测、水体营养盐去除、金纳米粒子生物合成和工业废气再利用等方面研究均有良好表现[5—8]。然而, 目前关于该类群的基础分类学研究却相对薄弱, 致使许多新分离的有经济价值的藻株无法得到准确的物种鉴定和命名。藻株命名的混淆与杂乱, 也使得类似的生理学研究间缺乏可比性, 阻碍了这些优质藻种资源的进一步开发利用。
单星藻属最初由Chodat建于1922年, 以肋纹单星藻Coelastrella striolata为模式种[9]。其后, 经过多次分类学变更, 目前被置于栅藻科空星藻亚科[10]。属内成员主要包括原单星藻属OriginalCoelastrella和原拟螺翼藻属OriginalScotiellopsis成员。拟螺翼藻属Scotiellopsis最初由Vinatzer建于1975年,以红色拟螺翼藻Scotiellopsis rubescens为模式种[11]。1981年Punčochářová和Kalina对该属进行修订, 将许多螺翼藻属(ScotiellaFritsch)中以似亲孢子繁殖的个体转移至此属。他们的研究最先阐明单星藻属与拟螺翼藻属可能具有较近的亲缘关系, 两个属间最主要的形态区别仅仅是细胞形状不同(单星藻属呈球形或宽椭球型, 拟螺翼藻属多呈纺锤形)及在单星藻属中不存在顶点增厚[12]。1998年, Hanagata首次基于18S rDNA分子数据对拟螺翼藻亚科Scotiellocystoideae进行系统发育分析, 发现单星藻属与拟螺翼藻属在系统发生上与栅藻类群较近, 至此二者由小球藻科转移至栅藻科[13]。关于二者间的关系一直以来都有争论, 依据传统的形态学分类方法,普遍认为二者是不同的属[14]。但是2013年, 捷克藻类学家Kaufnerová和Eliáš对该类群18S rDNA及ITS2二级结构特征进行分析, 证明了拟螺翼藻属的模式种红色拟螺翼藻与单星藻类群在系统发生上无法区分, 二者合并后, 目前认为拟螺翼藻属是单星藻属的异名[15]。
我国对单星藻属的关注较晚, 宋会银[16]最先在2015年报道在我国分离到单星藻藻株, 发现2个中国新记录种(塞班单星藻Coelastrella saipanensis和红色单星藻Coelastrella rubescens)。其后作者对我国的单星藻类群做过初步调查, 共发现3个新种(耐热单星藻Coelastrella thermophila、英山单星藻Coelastrella yingshanensis及薄壁单星藻Coelastrella tenuitheca), 2个新变种(红色单星藻卵形变种Coelastrella rubescensvar.oocystiformis和耐热单星藻球形变种Coelastrella thermophilavar.globulina),另有1个中国新记录种(卵形单星藻Coelastrella oocystiformis)[17]。此外, 作者也发表了塞班单星藻的叶绿体基因组数据[18]。本研究于我国重庆缙云山和河南周口地区采集到2株单星藻藻株, 经形态学和系统发育学鉴定为一新种, 命名为重庆单星藻Coelastrella chongqingensissp. nov.。
1 材料与方法
1.1 样本的采集与培养
本研究所用藻株分别采集于河南周口及重庆缙云山。河南周口藻株FACHB-3314以无菌BG11平板置于空气下12h后, 带回实验室培养分离获得。重庆缙云山藻株FACHB-3315分离于阴暗区潮湿石头表面, 以刀片直接刮取样品, 放于离心管后带回实验室经平板涂布法分离获得。分纯后的藻株置于25℃恒温培养箱中培养, 光照强度为 30 μmol/(m2·s)左右。
1.2 藻株形态特征观察
本研究光学显微图片主要采集于Olympus BX53(Olympus Cop, 日本)光学显微镜, 分别用明场(Bringt field, BF)、微分干涉(Differentical interference contrast, DIC)模式和荧光显微技术(Epifluorescence microscopy, EFM), 观察藻株的细胞形态,用印度墨水负染, 确认藻株是否具胶被。
扫描电镜制样选取对数生长期的细胞, 先用2.5%戊二醛固定, 再经乙醇梯度脱水后用临界点干燥仪干燥样品, 后经细胞喷金, 用Hitachi S-4800扫描电镜(Hitachi High-Technologies, 日本)观察[18]。
透射电子显微镜制样选取对数生长期细胞, 分别经2.5%戊二醛及1%锇酸固定后, 再用1%的醋酸铀过夜处理样品。经过一系列浓度的乙醇梯度脱水, 在包埋剂内包埋, 固化后用Leica uc7超薄切片机(Wetzlar, 德国)切片, 厚度为70 nm。用2% 醋酸铀-枸橼酸铅双染色, 最后用透射电镜(Hitachi High-Technologies, 日本)观察[19]。
1.3 基因组DNA获取及单分子标记扩增
取培养至对数生长期的藻株于2 mL冻存管中,用磷酸盐缓冲液(PBS pH=7.0)洗涤3次, 加入0.4 mL的磷酸盐缓冲液和适量的玻璃珠(d=0.5 mm), 用MiniBeadBeater(Model607EUR, 美国)震荡3min(分3次, 每次1min)以破碎细胞。之后, 使用植物基因组小量制备试剂盒(AxyPrep, 苏州, 中国)提取基因组DNA。
18S rDNA扩增采用引物对18A: 5′-AACCTG GTTGATCCTGCCAGT-3′; 18B: 5′-TGATCCTTCT GCAGGTTCACCTAC-3′[20]。ITS序列扩增采用引物对NS7: 5′-GGCAATAACAGGTCTGT-3′[21];LR1850: 5′-CCTCACGGTACTTGTTC-3′。tufA基因扩增采用引物对tufAF: 5′-TGAAACAGAAMAW CGTCATTATGC-3′;tufAR: 5′-CCTTCNCGAAT MGCRAAWCGC-3′[22]。PCR产物经琼脂糖凝胶电泳检测后送测序公司测序(擎科生物, 武汉)。测序结果使用ContigExpress Project 进行拼接[23], 并手动校正, 经校正后的序列提交至GenBank数据库。
1.4 系统发育学分析
从GenBank数据库中获得栅藻类群近缘序列,18S rDNA和ITS序列登录号及藻株信息示于表 1。序列比对使用软件Mafft7.0[24], 比对后的数据集使用MEGA 6.0[25]手工裁剪校正。序列拼接串联使用软件SequenceMatrix[26], 使用MEGA 6.0和Bioedit 7.0[27]进行碱基组成分析、碱基转换与颠换的比率分析等。序列饱和度检验利用软件DAMBE[28]。系统发育分析主要采用最大似然法(Maximum likelihood, ML)和贝叶斯算法(Bayesian Inference, BI)。ML法使用IQ-TREE web server[29]完成。BI法则选择使用MrBayes 3.2.1完成[30]。贝叶斯分析运行3000000代, 每1000代取样一次, 分析达到平稳(标准误差<0.01)则运行结束。
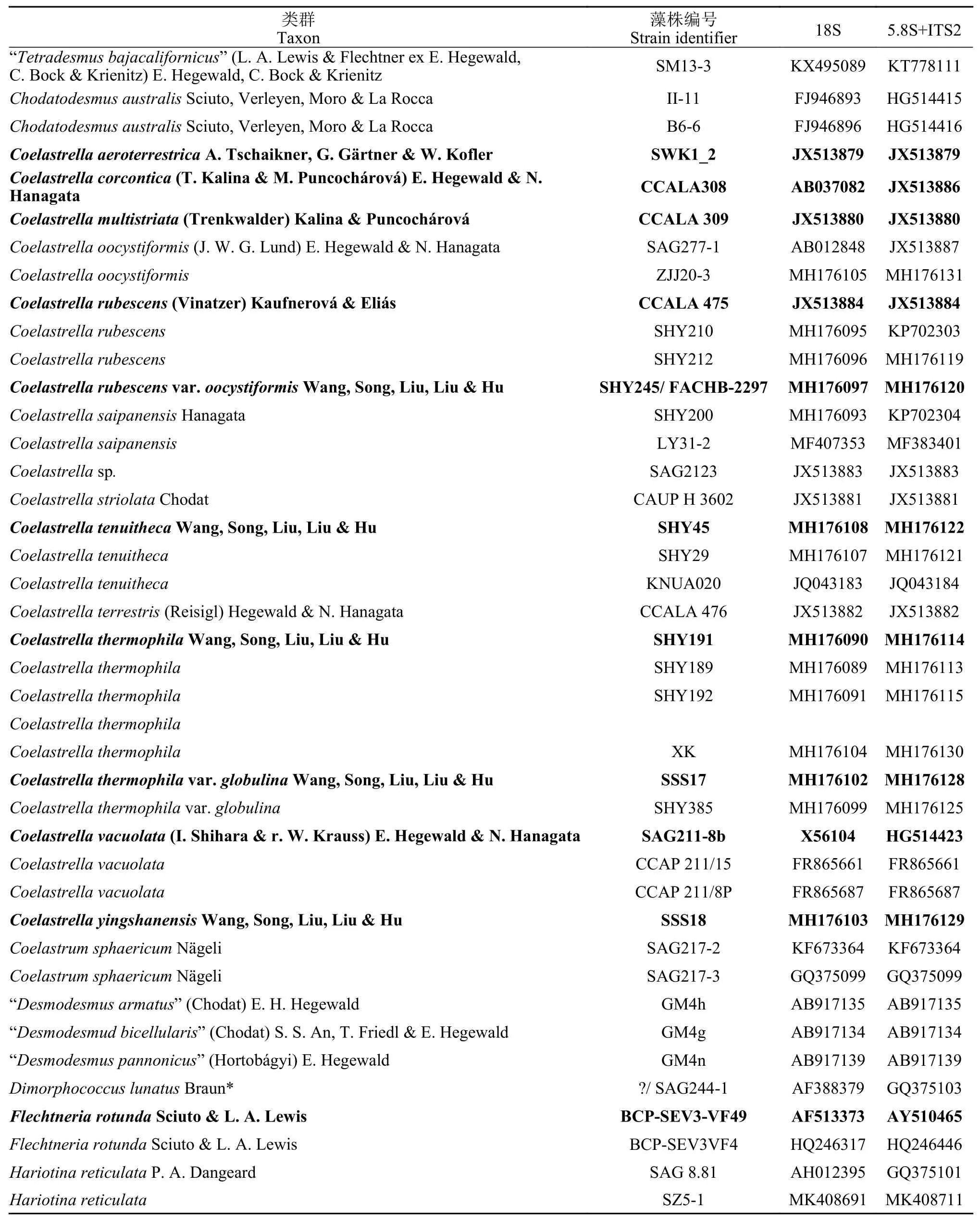
表1 下载自GenBank数据库中的近缘藻株序列(18S rDNA和 ITS)信息Tab. 1 Strains whose sequences (18S rDNA & ITS) were downloaded from the GenBank
续表1
2 结果
2.1 形态学描述及新种确认
营养细胞多为单细胞, 幼期细胞多呈椭球型,少数卵形或不规则球形, 细胞大小约(6—9) μm×(5—7) μm, 一个周生片状色素体(图 1A和1B)。成熟细胞多呈球形或椭球型, 直径约8—14—(18) μm(图 1C)。色素体周生, 具一个明显蛋白核, 并随细胞成熟逐渐碎片化。细胞通常具一至多个液泡。多通过形成2—4—8—16个似亲孢子进行无性生殖(图 1D—F), 有性生殖未观察到。老化细胞的细胞壁增厚, 细胞内逐渐积累类胡萝卜素而变为砖红色(图 1G、1H), 印度墨水染色后显示细胞外无胶被(图 2I)。扫描电镜照片显示该种细胞壁近似光滑或仅具细微皱纹(图 2A和2B), 不具有单星藻属典型的纵向分布的肋纹。透射电镜显示周生色素体具一个明显蛋白核(图 3A、3C—E)及若干淀粉粒(图 3B),蛋白核外裹有2个厚淀粉鞘(图 3A、3C—E)。老化细胞的细胞壁增厚, 并富集大量溶有类胡萝卜素的油滴(图 3F)。
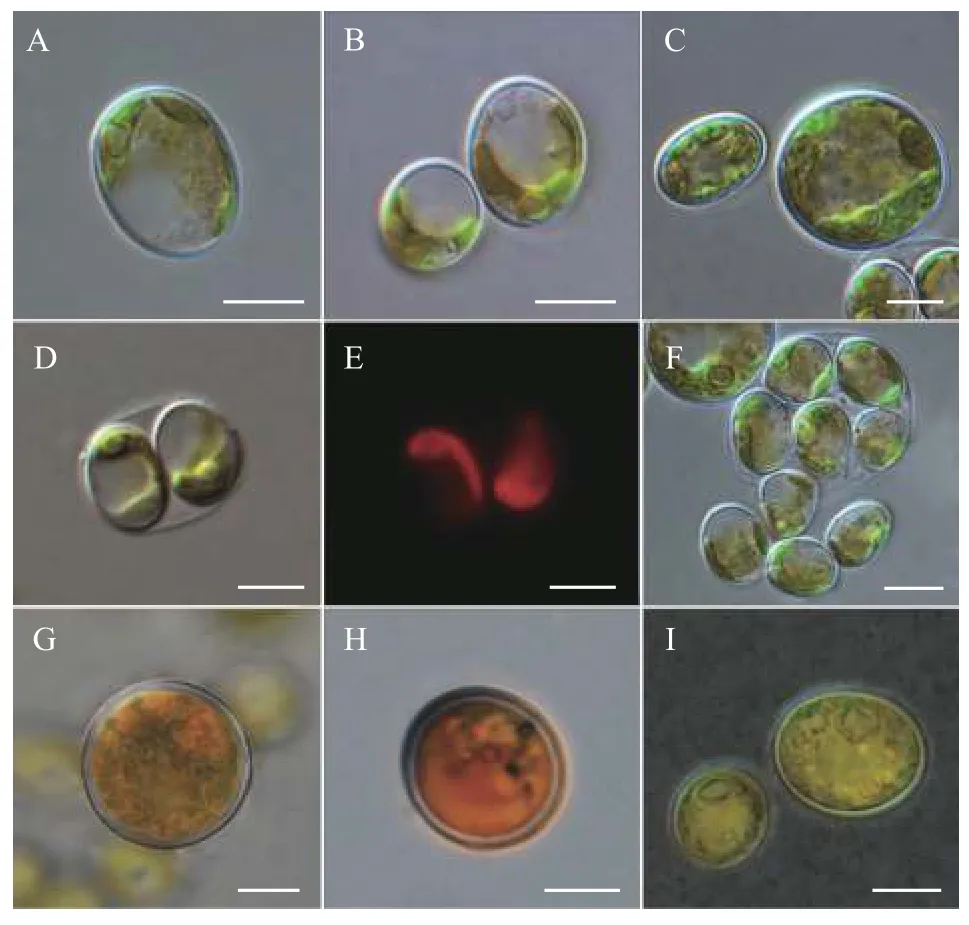
图1 重庆单星藻普通光学显微照片(标尺=5 μm)Fig. 1 Light micrographs of Coelastrella chongqingensis sp. nov.(Scale bar=5 μm)
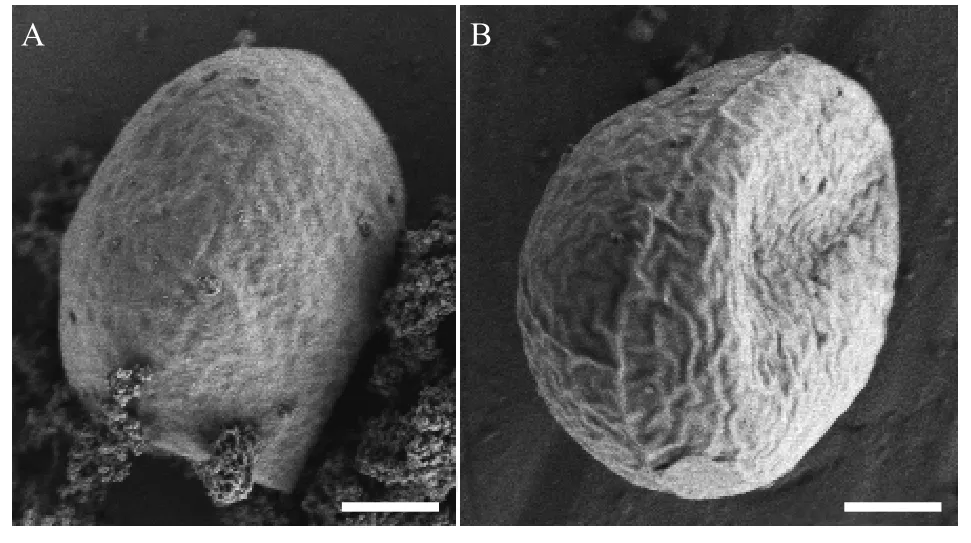
图2 重庆单星藻扫描电镜照片(标尺=2 μm)Fig. 2 The SEM images of Coelastrella chongqingensis sp. nov.(Scale bar=2 μm)
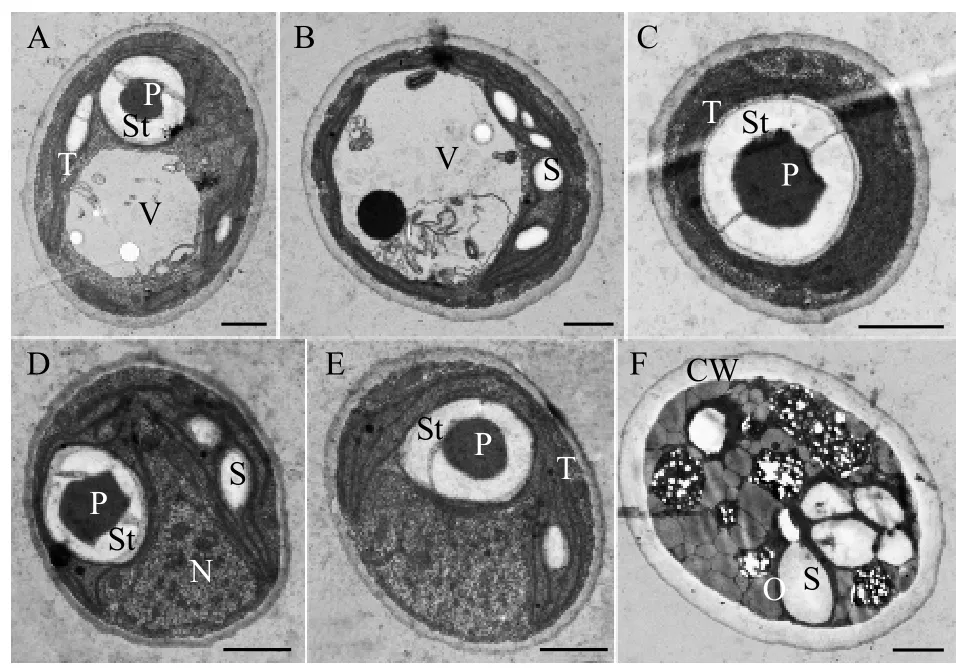
图3 重庆单星藻透射电镜照片(标尺=2 μm)Fig. 3 The TEM images of Coelastrella chongqingensis sp. nov.(Scale bar=2 μm)
Coelastrella chongqingensis Wang Q H, Song H Y& Liu G X sp. nov. Fig. 1—3.
Description.Vegetative cells are solitary, with approximately smooth cell walls or only slightly wrinkled. Young cells are mostly ellipsoidal or oval, a few near-spherical, blunt end and a parietal chloroplast,measure (6—9) μm×(5—7) μm. Mature cells are mostly spherical or ellipsoidal, 8—14—(18) μm. The chloroplast is parietal with a distinct pyrenoid (coated with 2 thick starch envelope), fragmenting as cells age. Cells usually have one or more vacuoles. Aged cells accumulate carotenoids and turn brick red.Asexual reproduction occurs by 2—4—8—16 autospores. Sexual reproduction was not observed.The SEM images explained the approximately smooth cell wall surface.
This species differs fromC. tenuithecaby the ellipsoidal and ovoid cell shape in young age, and differs fromC. vacuolataby the independent phylogenetic position based on 18S+ITS andtufAgene phylogeny.
Holotype.HBI SHY432, March 2014, growing on the surface of moist stone in the dark, leg. Huiyin Song.
Authentic culture.Culture strain FACHB-3315 is deposited at FACHB (http://algae.ihb.ac.cn/).
Type locality.Jinyun mountain, Chongqing Municipality (29°50′22″N—106°23′18″E).
Habitat.Aerial or sub-aerial habitat such as wet stone surfaces.
Distribution.Chongqing & Zhoukou, China.
Etymology.The species epithet ‘chongqingensis’(fem. adj.) refers to the type locality Chongqing Municipality
营养细胞多为单细胞, 细胞壁近似光滑, 不具有单星藻属典型的纵向分布的肋纹。幼期细胞多呈椭球型或卵形, 少数近似球形, 末端钝圆, 一个周生片状色素体, 细胞大小约(6—9) μm×(5—7) μm。成熟细胞多呈球形或椭球型, 直径约8—14—(18) μm。色素体周生具一个明显蛋白核, 蛋白核外裹有厚淀粉鞘, 色素体随细胞成熟逐渐碎片化。细胞通常具一至多个液泡。多通过形成2—4—8—16个似亲孢子进行无性生殖, 有性生殖未观察到。
该种与近缘种薄壁单星藻相比, 幼期细胞多呈现椭球型或卵形, 薄壁单星藻幼期细胞多呈圆球状。与液泡单星藻相比, 该种具有独立的系统发育学位置(基于18S+ITS及tufA序列)。
正模标本: 甲醛固定标本HBI SHY432保藏于中国科学院水生生物研究所, 标本采集于阴暗处潮湿石头表面, 采集人宋会银。
培养标本: 编号FACHB-3315, 保藏于中国科学院水生生物研究所淡水藻种库。
模式标本产地: 重庆缙云山(29°50′22″N—106°23′18″E)。
生境: 附生于潮湿石头表面等气生、亚气生环境。
分布: 中国重庆、河南周口等地。
词源学: 新种主要基于样品采集地命名。
2.2 系统发育学分析
基于18S+ITS序列系统发育分析结果示于图 4,序列比对产生包含53条序列的数据集, 经手动删除空位后得到长度1878 bp的矩阵, 其中包含保守位点1545 bp(82.27%), 可变位点332 bp(17.68%), 简约信息位点265 bp(14.11%)。碱基组成分析结果显示平均的碱基组成为A=25.44%, G=27.04%, C=21.33%,T=26.19%, AT含量(51.65%)。系统树重建选取4个水网藻科成员作为外类群。
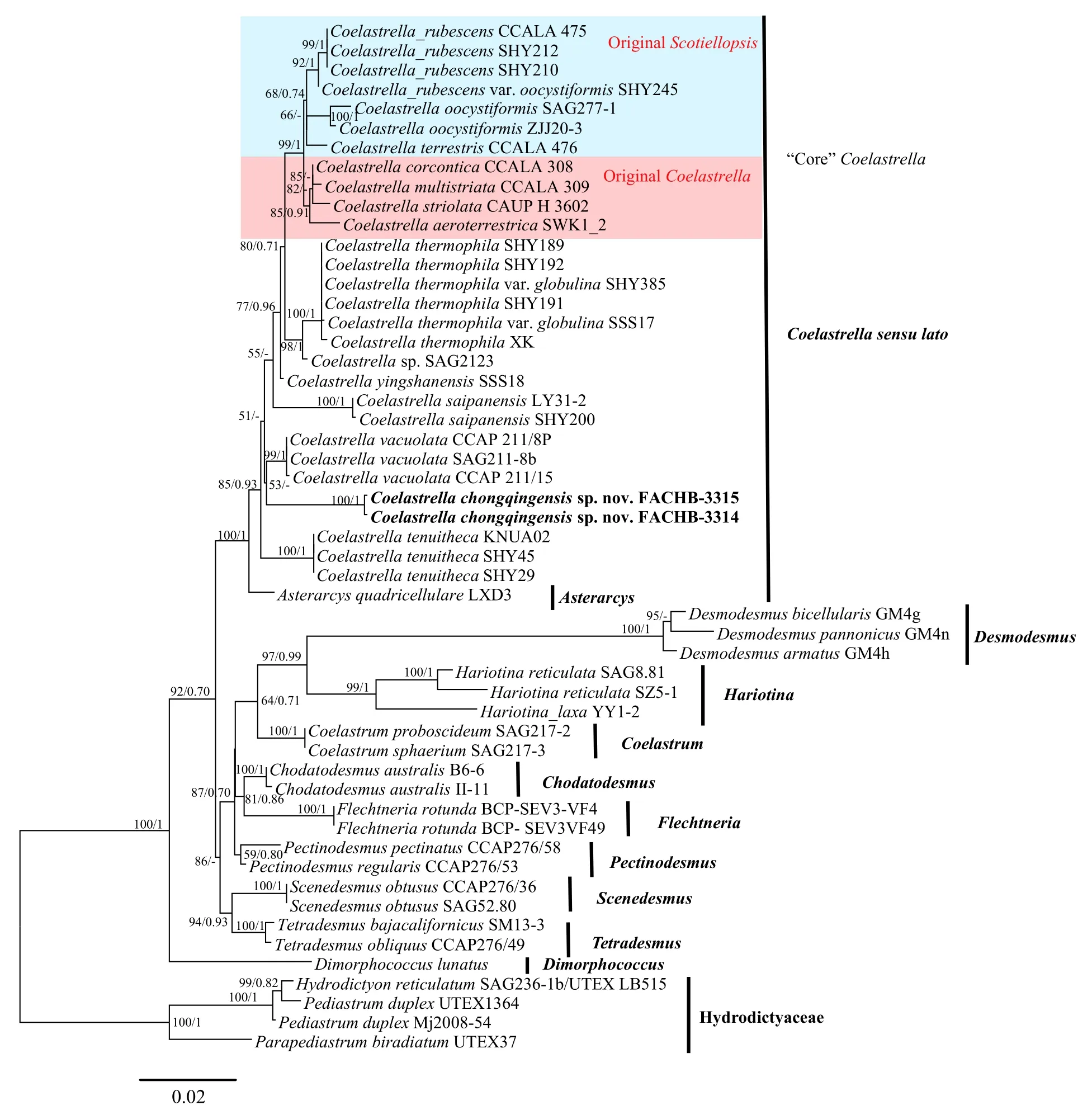
图4 基于18S rDNA和ITS序列联合构建的栅藻科系统树Fig. 4 Phylogenetic tree of Scenedesmaceae based on 18S+ITS sequences
基于tufA基因的系统发育分析结果示于图 5,序列比对产生包含40条序列的数据集, 经手动删除空位后得到长度736 bp的矩阵, 其中包含保守位点488 bp(66.3%), 可变位点248 bp(33.7%), 简约信息位点206 bp(27.99%)。碱基组成分析结果显示平均的碱基组成为A=36.68%, G=19.84%, C=13.86%,T=29.62%, AT含量(66.98%)高于GC含量(33.70%)。系统树重建选取2个水网藻科成员作为外类群。
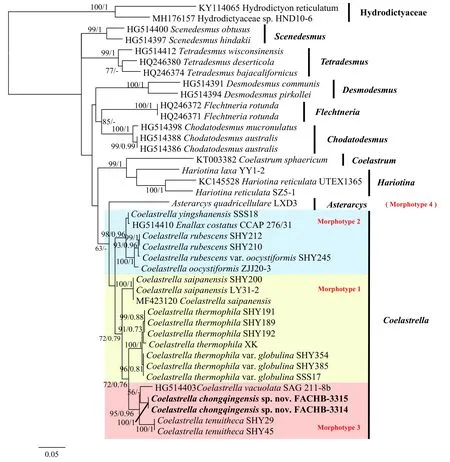
图5 基于叶绿体tufA基因构建的栅藻科系统树Fig. 5 Phylogenetic tree of Scenedesmaceae based on tufA gene
18S+ITS序列系统发育分析结果表明, 单星藻属与星网藻属AsterarcysComas (即广义单星藻分支Coelastrella sensu lato)在栅藻科内能够形成独立单系分支, 且分支获得较高的支持值(100/1)。原单星藻属OriginalCoelastrella与原拟螺翼藻属OriginalScotiellopsis聚为一支共同构成核心单星藻分支, 并获得较高的支持值(99/1)。本研究所提供2株重庆单星藻藻株(FACHB-3315和FACHB-3314)与液泡单星藻具有较近的亲缘关系, 且二者在形态学上也较为相似, 即细胞壁不具有核心单星藻类群典型的纵向肋纹。此外, 薄壁单星藻也具有类似的形态型, 但三者在系统树中并未形成单系分支, 而形成并系类群。基于叶绿体tufA基因的系统发育分析结果与18S+ITS序列分析结果基本一致, 同样表明单星藻属与星网藻属成姐妹类群, 星网藻属位于广义单星藻属分支基部。此外, 重庆单星藻与液泡单星藻具有最近的亲缘关系, 二者形成姐妹分支, 进一步与薄壁单星藻聚为一支且具有较高的分支支持值(95/0.96), 三者在单星藻属内形成单系分支并代表了单星藻属的第三种形态型, 因此, 基于tufA基因的系统发育研究结果与形态学特征更为吻合。
3 讨论
广义单星藻分支Coelastrella sensu lato概念最初是由捷克藻类学家Kaufnerová 和Eliáš基于18S rDNA序列的系统发育研究结果提出的[15]。其中主要包含核心单星藻分支“Core”Coelastrella及部分边界类群, 及星网藻属模式种四细胞星网藻Asterarcys quadricellulare。其中核心单星藻分支则主要包括原单星藻属OriginalCoelastrella和原拟螺翼藻属OriginalScotiellopsis。作者前期对广义单星藻分支的研究, 确定了该分支实际包含了原栅藻科内5个属的成员, 并对应了至少4种形态型。第一种形态型(Morphotype 1)主要指原单星藻属的形态型,细胞球形或宽椭球型, 没有或很少出现细胞顶点增厚, 细胞壁纵向肋纹多达16—40个; 第二种形态型(Morphotype 2)指原拟螺翼藻属和伊那藻属EnallaxPascher形态, 细胞纺锤形或柠檬状, 具顶点增厚, 肋纹数一般较少约4—12(20)个。第三种形态型(Morphotype 3)则主要指液泡单星藻、薄壁单星藻及重庆单星藻的形态, 细胞壁近似光滑或仅具细微网纹, 无单星藻属典型的纵向肋纹。第四种形态型指星网藻属形态型, 即四细胞群体, 群体外具胶被[17]。
重庆单星藻最明显的形态特征是细胞壁不具典型的纵向肋纹, 接近单星藻属的第三种形态型,扫描电镜中细胞壁出现的细密皱纹推测是由于制样过程的细胞壁失水皱缩形成的, 不作为典型特征予以讨论。重庆单星藻与近缘种薄壁单星藻的形态区别, 主要为薄壁单星藻幼期或成熟细胞均呈圆球状[17], 而重庆单星藻幼期细胞多呈椭球型或卵形,成熟细胞呈椭球形或圆球形。重庆单星藻与液泡单星藻的形态区别主要表现为, 液泡单星藻细胞壁具细微网纹[31,32], 而重庆单星藻未见规则网状细纹。
根据前人的研究, 星网藻属位于广义单星藻属分支内部[15], 因此星网藻属的成立一直以来都有所争议。本研究基于18S+ITS序列的系统发育研究结果表明, 单星藻属与星网藻属确实具有较近的亲缘关系, 与之前研究结果中单星藻属与星网藻属呈多系分布[15]略有不同的是, 在本研究中星网藻属与单星藻属互相分离形成独立分支, 该结果与tufA基因的系统发育研究结果更为一致, 与形态学特征也较为吻合(因星网藻为四细胞群体, 群体外具胶被, 而目前所发现的所有单星藻均不具胶被)。因此, 上述结果进一步支持四细胞星网藻从广义单星藻分支中独立成属。在18S+ITS系统树中重庆单星藻与另外两种细胞壁相对光滑的物种液泡单星藻、薄壁单星藻未形成单系分支, 而形成并系类群。但是在tufA基因的系统树中三者形成单系分支, 代表了单星藻属的第三种形态型。鉴于核基因18S rDNA和ITS序列在该类群系统发育研究中的局限性[17,33,34],推测近缘分支拓扑结构可能较易随序列增减而出现变动。因为, 对于栅藻类群, 18S序列往往过于保守, 所含有效系统发育信息位点较少, 而ITS序列变异度过高, 序列较易达到突变饱和, 也不适于科级别的系统发育分析, 但ITS序列在属及属以下水平具有较高的分辨率, 可作为区分种和亚种的有力证据。而叶绿体tufA基因因有效系统发生信号较多,系统树拓扑结构更为稳定, 可作为该类群更有效的系统发生重建手段。
基于以上形态学和系统发育研究结果, 本研究建议将采集于重庆缙云山的单星藻作为1个新种提出, 命名为重庆单星藻Coelastrella chongqingensissp. nov., 该新种的发现扩充了单星藻属第三种形态型的物种组成。鉴于利用形态特征鉴定此类单细胞球状绿藻时, 可供区分的特征较少且在不同培养状态下还存在一定的形态可塑性, 对于该类群的物种水平鉴定, 建议将ITS和tufA分子数据作为更可靠的鉴定依据。

