香蕉枯萎病菌细胞周期蛋白C1基因FocFCC1的鉴定、表型分析和作为内源报告基因的可行性评估
曾凡云 王艳玮 漆艳香 谢艺贤 张欣 彭军
摘 要:本研究克隆鑒定了香蕉枯萎病菌4号生理小种(Foc4)的细胞周期蛋白C1(Fusarium Cyclin C1,FCC1)基因FocFCC1,采用Split-marker同源重组技术获得基因敲除突变体ΔFocFCC1,通过比较突变体和野生菌株在生长速度、产孢量和致病力等方面的差异,探索了FocFCC1基因缺失对香蕉枯萎病菌生物学功能的影响,并评估了FocFCC1作为枯萎菌内源报告基因的可行性。结果表明:与Foc4野生型菌株相比,ΔFocFCC1菌丝生长缓慢、菌丝畸形及产孢量减少,对巴西蕉苗的致病力明显减弱,推测FocFCC1基因在Foc4的生长发育、产孢及致病力等方面具有重要作用。以FocFCC1为靶标基因,评估了两种基因敲除重组方法介导的基因敲除效率,利用红色表型作为判断依据,挑取再生板上有红色表型的转化子进行PCR检测,Split-marker重组方法获得阳性转化子比例为91.7%,而多片段装配融合方法获得阳性转化子的比例为64%。ΔFocFCC1出现典型红色菌落,红色表型与PCR检测的FocFCC1阳性敲除转化子一一对应,FocFCC1基因敲除后红色表型肉眼容易分辨,可作为香蕉枯萎病菌内源报告基因探索新的遗传操作技术在该菌上应用的可行性。
关键词:香蕉枯萎菌;细胞周期蛋白C1;基因敲除;表型分析;致病力
中图分类号:S668.1 文献标识码:A
Abstract: In this study, the Fusarium Cyclin C1 gene FocFCC1 in F. oxysporum f. sp. cubense race 4 (Foc4) was cloned and identified. The ΔFocFCC1 gene-knockout mutants were obtained by the Split-marker homologous recombination technique. The growth rate, sporulation, pathogenicity were studied to investigate the biological function of FocFCC1 in Foc4. Additionally, we evaluated whether the FocFCC1 could serve as an endogenous reporter gene applied in Foc4. The results demonstrated that ΔFocFCC1 showed slow growth rate, hyphal deformity, decreased conidium production, and significantly reduced pathogenicity to banana (Cavendish, AAA). Therefore, we hypothesized that FocFCC1 gene might play an important role in the growth, sporulation and pathogenicity of Foc4. Further, a comparative study of the efficiency of two different homologous DNA disruption construct methods was carried out, one is Split-marker recom-bination approach, another termed Multi-fragment assembly by In-fusion cloning, requires only one standard PCR reaction and one fragment assembly reaction. Using the red phenotype as the judging basis, the transformants with red phenotype on the regeneration plate were selected for PCR detection. The results showed the percentage of positive transformants of Split-marker recombination approach was 91.7%, while that of the Multi-fragment assembly by In-Fusion cloning method was 64%. Next, ΔFocFCC1 showed typical red colony distinguished with Foc4, and the red colony phenotypes coupled with the positive PCR amplification bands. It is important that positive transformants can pick up according to the red phenotype by eyes without PCR procedures, and can serve as endogenous reporter gene for further Foc4 molecular biology research.
Keywords: Fusarium. oxysporum f. sp. cubense; Fusarium Cyclin C1; gene knockout; phenotype analysis; patho-genicity test
DOI: 10.3969/j.issn.1000-2561.2021.11.011
香蕉枯萎病(Fusarium oxysporum f. sp. cu-bense,Foc)是破坏香蕉维管束导致植株死亡的毁灭性土传病害,是香蕉产业上最关注的焦点问题之一,也是热带地区植物病理学研究的热点之一。随着真菌遗传操作技术的发展和成熟,利用遗传操作技术研究香蕉枯萎病菌的基因功能也日趋成熟,但是相对模式病原菌而言,香蕉枯萎病菌的研究中很多新的分子生物学技术还没有被完全建立并应用,因此迫切需要鉴定内源报告基因并以此评估新技术应用的可行性。建立在遗传转化基础上的基因敲除(gene knockout)及沉默(gene silencing,RNAi)是研究Foc4基因功能的重要分子生物学手段[1]。目前香蕉枯萎病菌尚无内源报告基因的相关报道,而建立可靠的遗传转化技术并高效删除目的基因是进行基因功能分析的重要前提,选择重复性好、表型容易分辨的内源报告基因作为快速筛选标记,可评估遗传转化效率以及其他新技术在枯萎病菌上应用的可行性。
报告基因(reporter gene)是现代分子生物学研究领域中被广泛使用的一类重要工具,在植物基因功能研究中发挥重要作用。β-葡糖醛酸酶(GUS)基因具有很多优点,在细胞内表达稳定且半衰期长,检测方法简便多样,作为外源报告基因在植物功能基因研究中得到了广泛应用[2]。八氢番茄红素去饱和酶(phytoene desaturase,PDS)是类胡萝卜素生物合成过程中催化无色的八氢番茄红素形成有色的一类胡萝卜素的关键酶,沉默PDS基因后植物出现白化或者光漂白症状,Kumagai等[3]第一次将八氢番茄红素脱氢酶(PDS)克隆到烟草花叶病毒(TMV)中,利用病毒诱导基因沉默(virus induced gene silencing,VIGS)技术浸染烟草后植株表现白化表型,随后在拟南芥、烟草、番茄等多种植物上得到成功应用,PDS是目前植物分子生物学研究中应用最广泛的内源报告基因[4]。
细胞周期蛋白C1 (Fusarium cyclin C1,FCC1)2001年在轮枝镰刀菌(F. verticillioides)上首次被发现,参与次生代谢产物伏马菌素FB1(fumonisin B1,FB1)的生物合成以及孢子形成[5]。水稻恶苗病菌(F. fujikuroi)中FCC1基因敲除突变体出现红色或紫色菌落表型,与野生型的白色菌落表型差异明显,可作为内源报告基因评估基因敲除的效率[6]。通过生物信息学功能域分析软件SMART(Simple Modular Architecture Research Tool)(http://smart.embl.de)分析了Foc4菌株含有Cyclin Box功能域的FCC1同源基因FocFCC1(FOIG_04434),并以此为靶标基因开展基因敲除及表型分析,验证FocFCC1基因缺失突变体是否出现典型的红色菌落,用以确定FocFCC1可以用作Foc内源报告基因。然后以FocFCC1为内源报告基因,对比分析了2种主要的基因敲除重组技术:Split-marker重组方法(Split-marker re-combination approach)[7]和多片段装配融合方法(Multi-fragment assembly by In-Fusion cloning)[8-9]构建的重组片段介导的基因敲除效率,证实FocFCC1作为内源报告基因的可行性,并为后续开发新的适合香蕉枯萎菌分子生物学研究的遗传操作效率评估提供依据。
1 材料与方法
1.1 材料
1.1.1 试验菌株及香蕉品种 香蕉枯萎病菌4号生理小种(F. oxysporum f. sp. cubense race 4,Foc4),由实验室鉴定保存。试验接种的香蕉品种为巴西蕉(Cavendish cv. Brazil,AAA)。
1.1.2 试验试剂 Taq DNA 聚合酶、LA Taq DNA高保真酶等购自大连宝生物工程(TaKaRa)有限公司;引物由生工生物工程(上海)股份有限公司合成(HPLC纯化),其他试剂购自生工生物工程(上海)股份有限公司
1.2 方法
1.2.1 真菌DNA的制备 采用CTAB方法提取真菌的基因组DNA。将实验室保存的Foc4野生型菌株接种到PDA平板上,28 ℃培养3~5 d后,刮取新鲜的菌丝,按照CTAB方法提取菌丝DNA。其他突变体的DNA提取按照Foc4的操作进行。
1.2.2 FCC1蛋白结构域分析及基因敲除片段扩增 利用在线蛋白功能域预测分析软件SMART分析FocFCC1的功能域。参考FocFCC1的基因序列(FOIG_04434)和已发布的Foc4野生株基因组序列(JH658279.1),设计引物LBCK和LB- R,RB-F和RBCK(表1)扩增FocFCC1基因的上下游片段;设计NEO-F和NEO-R引物(表1)扩增新霉素片段;重组上下游片段则分别通过引物LB-F/NEO-R1和NEO-F1/RB-R(表1)來扩增。Outside引物检测靶标基因是否被重组片段替换,而Inside引物检测FocFCC1内源基因。
1.2.3 原生质体制备及转化 香蕉枯萎菌原生质体制备参照王飞燕等[10]的方法进行。PEG介导的原生质体转化参照徐齐君等[11]的方法。以培养3 d的Foc4野生株为原始菌株制备浓度为1×107个/mL的原生质体,参考戴蓬博等[12]的方法,分别取3~ 5 µg上下游片段回收产物与1 mL原生质体混匀,冰上放置30 min后;取2 mL 60% PTC分3次缓慢加入到混合液后,冰上放置15~20 min;将预冷的STC溶液加入到混合液至25 mL,4 ℃,5000 r/min离心15 min后去上清液;加入无抗性的SR液体培养基3 mL后,再加入含有200 µg/mL新霉素和50 µg/mL链霉素的SR固体培养基混匀后均匀倒在培养皿上,28 ℃培养箱中培养3~5 d后得到转化子,并连续培养3代得到稳定转化子。
1.2.4 ΔFocFCC1的PCR鑒定 采用CTAB方法提取真菌的基因组DNA。配制20 µL PCR反应体系,反应程序:94 ℃ 5 min,95 ℃ 40 s,58 ℃ 45 s,72 ℃ 2 min,72 ℃ 5 min,16 ℃ 5 min,35个循环扩增验证敲除体中的目标片段,其中引物Outside- F/Outside-R检测靶标基因是否敲除;而引物Inside- F/Inside-R对敲除体内源基因进行检测(表1)。
1.2.5 ΔFocFCC1生长特性分析 (1)生长形态和生长速率测定:挑选3个培养3~5 d的新鲜稳定转化子和Foc4野生株,分别取5 mm菌饼分别接种到无抗性的PDA平板上,28 ℃培养,并分别在培养1、3、5、7 d测量菌落直径并拍表型图,每次设置3个重复。第7天观察结束后从PDA平板上取少量菌丝,制成载玻片进行显微形态观察。
(2)产孢量分析:取ΔFocFCC1和Foc4野生株的5 mm新鲜菌饼分别加入到无抗性PDB中,28 ℃摇床摇培7 d,三层滤纸过滤后分生孢子借助血球计数板在显微镜观察并统计其孢子数量。
1.2.6 ΔFocFCC1致病力分析 取ΔFocFCC1和Foc4野生株的5 mm新鲜菌饼分别接种到100 mL PDB(无抗性)中,摇床28 ℃、150 r/min摇培5 d,用三层滤纸将菌丝过滤,收集分生孢子液,用无菌水将分生孢子液浓度调节到2×106个/mL。采用盆栽伤根灌淋法测定菌株致病性。其中突变体和野生株分别处理15株蕉苗,每株苗浇灌15 mL孢子液,以无菌水作为空白对照,3次重复,60 d后纵向切开蕉苗球茎,观察球茎褐变程度,参考陆小平等[13]的病情调查分级标准,记录每株苗的发病等级并对病情指数进行统计。
1.2.7 评估2种基因敲除重组方法构建的重组片段介导的基因敲除效率 以FocFCC1为报告基因评估2种敲除重组DNA方法的敲除效率。
(1)Split-marker重组方法:参考Wang等[7]的方法构建Split-marker基因敲除重组片段,包含2个重组DNA片段,具体分两步进行。第一轮PCR扩增3个片段:NEO-F/NEO-R扩增NEO抗性基因1.4 kb;Foc4基因组DNA为模板,引物FCC1-NEO-LBCK/FCC1-NEO-LB-R扩增左端LB1(2084 bp);Foc4基因组DNA为模板,引物
FCC1-NEO-RB-F/FCC1-NEO-RBCK扩增右端RB1 (2036 bp)。第二轮PCR扩增2个重组DNA片段:左端(5上游)重组DNA片段扩增(LB2+NE):FCC1-NEO-LB-F/NEO-R1为引物,FCC1-LB1+ NEO-1.4 kb为模板,扩增产物大小2398 bp;右端(3下游)重组DNA片段扩增(EO+RB2):NEO-F1/FCC1-NEO-RB-R为引物,NEO-1.4 kb+ FCC1-RB1为模板,扩增产物2606 bp。将5上游重组DNA和3下游重组DNA等体积混合后按照上述的原生质体转化方法进行转化。
(2)多片段装配融合方法重组方法:参考Zhu 等[8]、Raman等[9]的方法构建多片段组装、融合标记的敲除重组DNA片段。将上述Split Marker构建的2个重组DNA片段,5上游重组DNA片段(LB2+NE)、3下游重组DNA片段(EO+RB2),当做PCR模板混合,引物FCC1-NEO-LB-F/ FCC1-NEO-RB-R进行joint-PCR扩增,得到一条多片段组装、标记融合的重组DNA片段。将得到的一条多片段组装、标记融合的重组DNA片段
(3~5 µg)按照上述的原生质体转化方法进行转化。利用红色菌落表型作为判断依据,挑取再生板上有红色菌落表型的转化子进行PCR检测,分别统计2种重组方法获得的阳性转化子的占比,评估2种基因敲除重组方法构建的重组片段介导的基因敲除效率。
2 结果与分析
2.1 FCC1蛋白结构域分析及敲除突变体鉴定
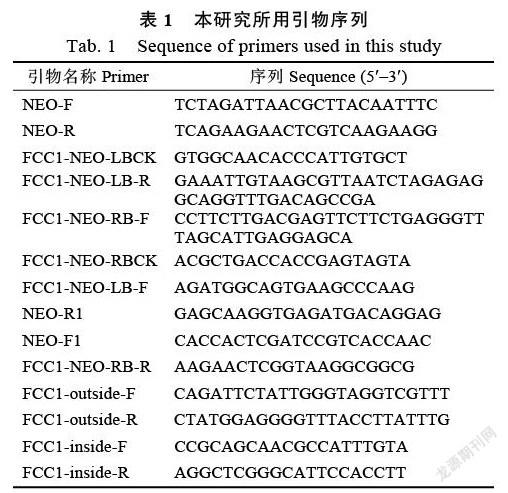
利用在线SMART软件分析FCC1蛋白功能域,结果显示,香蕉枯萎病菌FocFCC1与水稻恶苗病菌(F. fujikuroi)、玉米穗腐病菌(F. verticillioides)、粗糙脉孢菌(Neurospora crassa)以及酿酒酵母(Saccharomyces cerevisiae)等含有相同的蛋白功能域,除了含有典型的细胞周期蛋白表达框(Cyclin BOX)外,还含有RQKL功能域(the destruction box- like motif)、PEST-Rrich功能域(图1A、图1B)。
A:SMART预测的香蕉枯萎菌FocFCC1蛋白保守结构域。蛋白序列登录号为:FocFCC1,香蕉枯萎菌4号小种(EXM06030.1,本研究);FvFCC1,玉米穗腐病菌(AAK30047.1);FfFCC1,稻恶苗病菌(SCN64880.1);NcFCC1,粗糙脉孢菌(CAC18151.1);ScUME3,酿酒酵母(NP_014373.3)。B:FCC1蛋白氨基酸多序列比对。黑框所示位置为RQKL和PEST-rich结构域,实线所示位置为Cyclin Box结构域。
A: Schematic representation of the conserved domain of FocFCC1 by using SMART. Accession No.: FocFCC1, F. oxysporum f. sp. cubense race 4 (EXM06030.1, this study); FvFCC1, F. verticillioides (AAK30047.1); FfFCC1, F. fujikuroi (SCN64880.1); NcFCC1, Neurospora crassa (CAC18151.1); ScUME3, Saccharomyces cerevisiae S288C (NP_014373.3). B: Multiple alignment of FCC1. Black boxes indicate the region of RQKL and PEST-rich, respectively. Solid line indicates the region of Cyclin Box.
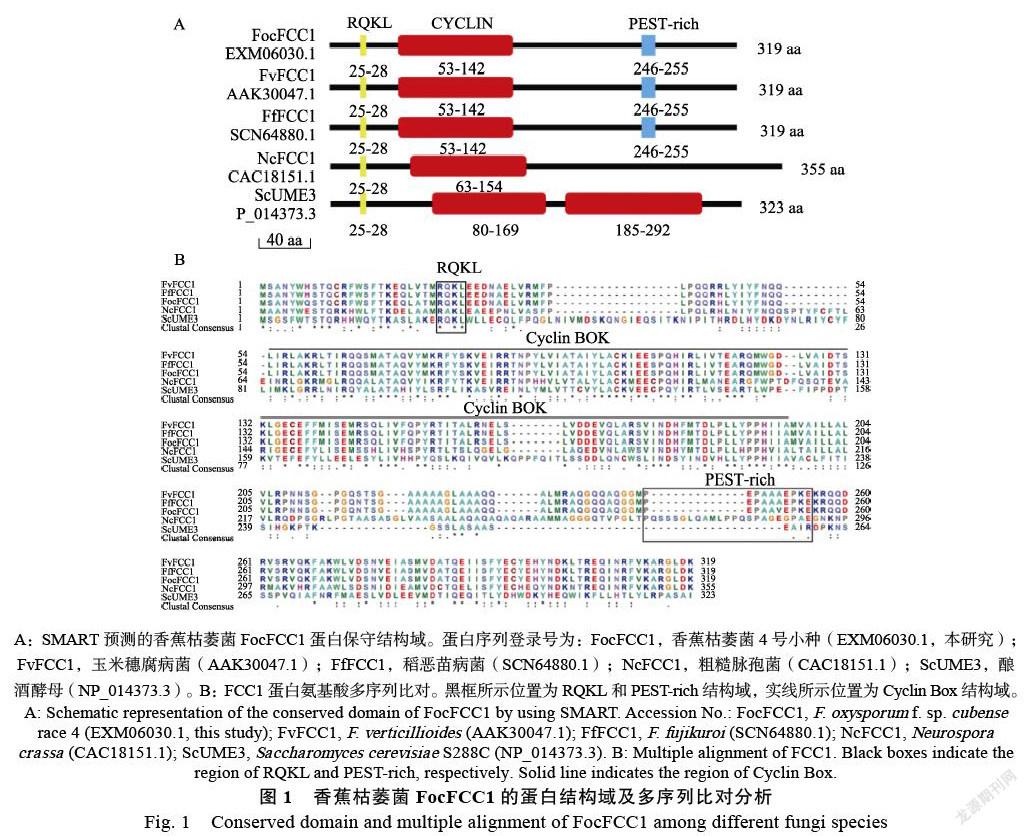
提取ΔFocFCC1和野生株Foc4的基因组DNA,作为PCR扩增模板验证阳性转化子,分别用Outside-F/Outside-R、Inside-F/Inside-R对这2对引物进行扩增。阳性敲除转化子Outside-F/ Outside-R引物扩增出1927 bp的重组片段,Foc4野生型扩增出1575 bp的FocFCC1基因组片段。Inside-F/Inside-R从Foc4野生型DNA中扩增出679 bp内源片段,阳性转化子无条带(图2B)。
2.2 ΔFocFCC1生长特性分析
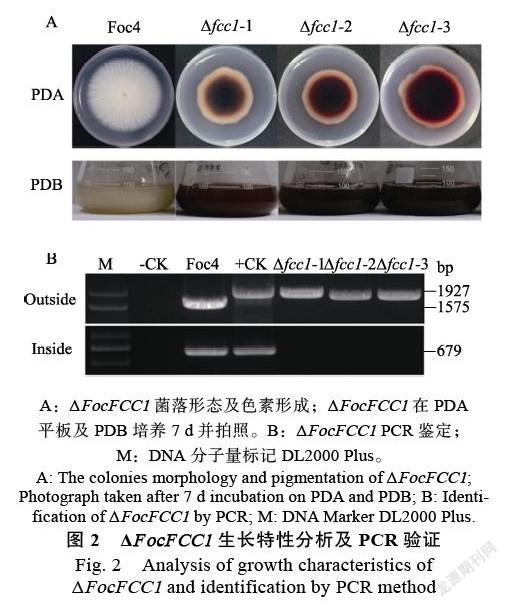
将Foc4和ΔFocFCC1接种于PDA培养基上,经过7 d的定期测量菌落直径大小,结果显示,ΔFocFCC1菌落呈现红色,Foc4野生株菌落无色素产生,菌落无色,PDB摇培7 d,同样观察到ΔFocFCC1发酵液呈现红色(图2A),ΔFocFCC1气生菌丝减少,菌落平滑,而野生菌株Foc4气生菌丝多,菌落绒毛状。ΔFocFCC1生长速度慢于野生株Foc4,其菌落直径为4.9 cm,野生株Foc4菌落直径7.5 cm,二者差异显著(图3A、图3B)。
2.3 ΔFocFCC1菌丝形态及产孢量分析
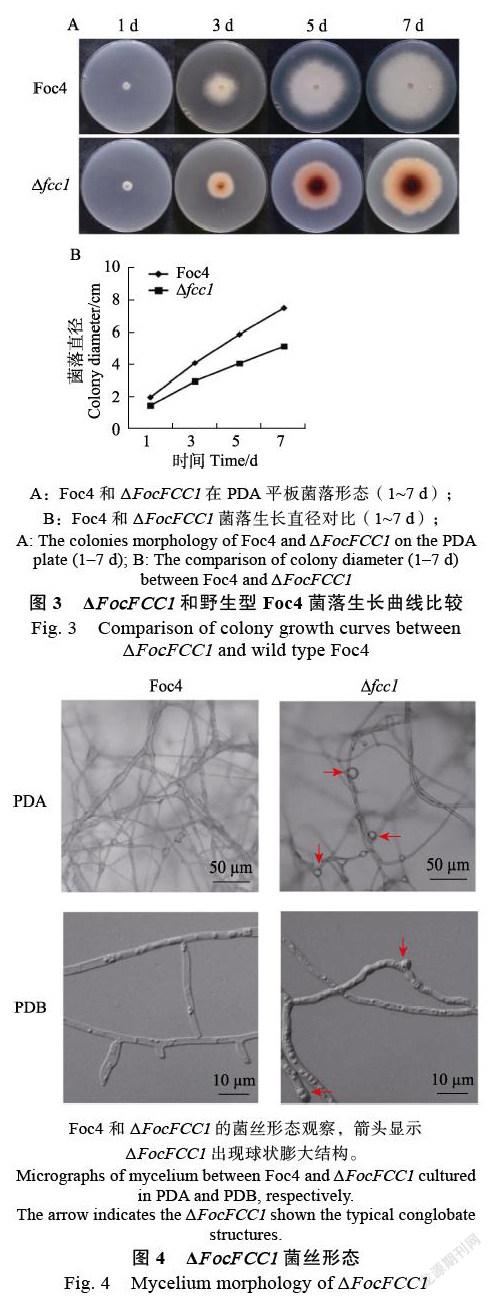
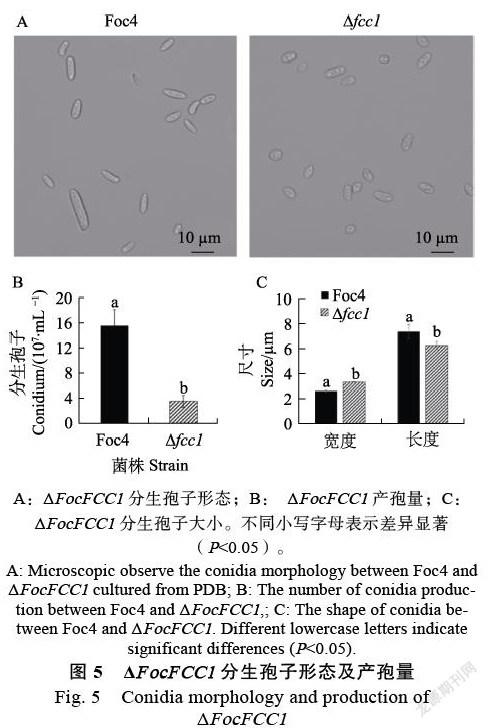
显微观察结果显示,与野生株对比,突变体的菌丝呈现不规则扭曲,不规则分支增多,且分支处呈现弧状,而不是Foc4典型的角状。ΔFocFCC1菌丝分叉多,节间缩短,菌丝膨大皱缩,出现典型的膨大球状体结构(图4)。
PDB摇培7 d后,ΔFocFCC1分生孢子形态和大小发生改变,野生菌株Foc4小型分生孢子卵圆形或肾型,无色,单胞或双胞,而ΔFocFCC1分生孢子长度变短,宽度变宽,卵圆形或近球形(图5A)。ΔFocFCC1分生孢子平均大小为(6.19± 0.33) μm×(3.28±0.05) μm,Foc4分生孢子平均大小为(7.29±0.58) μm×(2.57±0.09) μm(图5C)。统计其产孢量,结果显示,ΔFocFCC1产孢量为(3.5±0.93)×107个/mL,野生株Foc4产孢量为(15.5±2.58)×107个/mL,ΔFocFCC1产孢量显著降低(图5B)。
A:ΔFocFCC1分生孢子形态;B: ΔFocFCC1产孢量;C:ΔFocFCC1分生孢子大小。不同小写字母表示差异显著(P<0.05)。
A: Microscopic observe the conidia morphology between Foc4 and ΔFocFCC1 cultured from PDB; B: The number of conidia production between Foc4 and ΔFocFCC1,; C: The shape of conidia between Foc4 and ΔFocFCC1. Different lowercase letters indicate significant differences (P<0.05).
2.4 ΔFocFCC1致病力分析
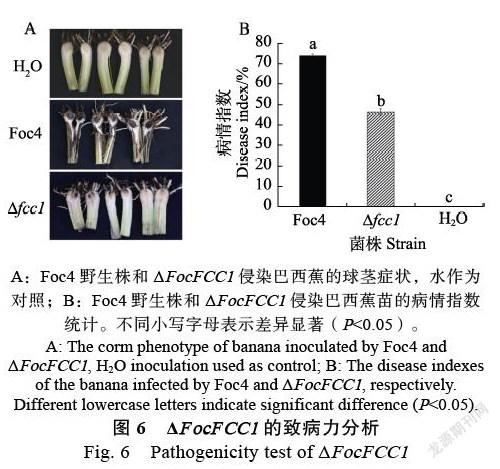
将Foc4野生株和ΔFocFCC1的孢子悬液分别接种到健康巴西蕉苗,60 d后观察接种的巴西蕉苗的叶片症状以及球茎褐化情况。以H2O作为空白对照的巴西蕉苗叶片嫩绿,叶片无病状出现,球茎无褐化现象。Foc4野生株接种的蕉苗叶片出现严重黄化甚至枯萎,球茎褐化明显;ΔFocFCC1接种的香蕉苗叶片轻微黄化,球茎也出现轻微褐化(图6A)。
统计发病植株的病情指数结果显示,Foc4野生株为74.5%,ΔFocFCC1为46.9%,虽然ΔFocFCC1的致病力显著下降,但是突变体仍然能够致病且球莖褐化,并未完全丧失致病力(图6B)
A:Foc4野生株和ΔFocFCC1侵染巴西蕉的球茎症状,水作为对照;B:Foc4野生株和ΔFocFCC1侵染巴西蕉苗的病情指数统计。不同小写字母表示差异显著(P<0.05)。
A: The corm phenotype of banana inoculated by Foc4 and ΔFocFCC1, H2O inoculation used as control; B: The disease indexes of the banana infected by Foc4 and ΔFocFCC1, respectively.
2.5 评估2种基因敲除重组方法构建的重组片段介导的基因敲除效率
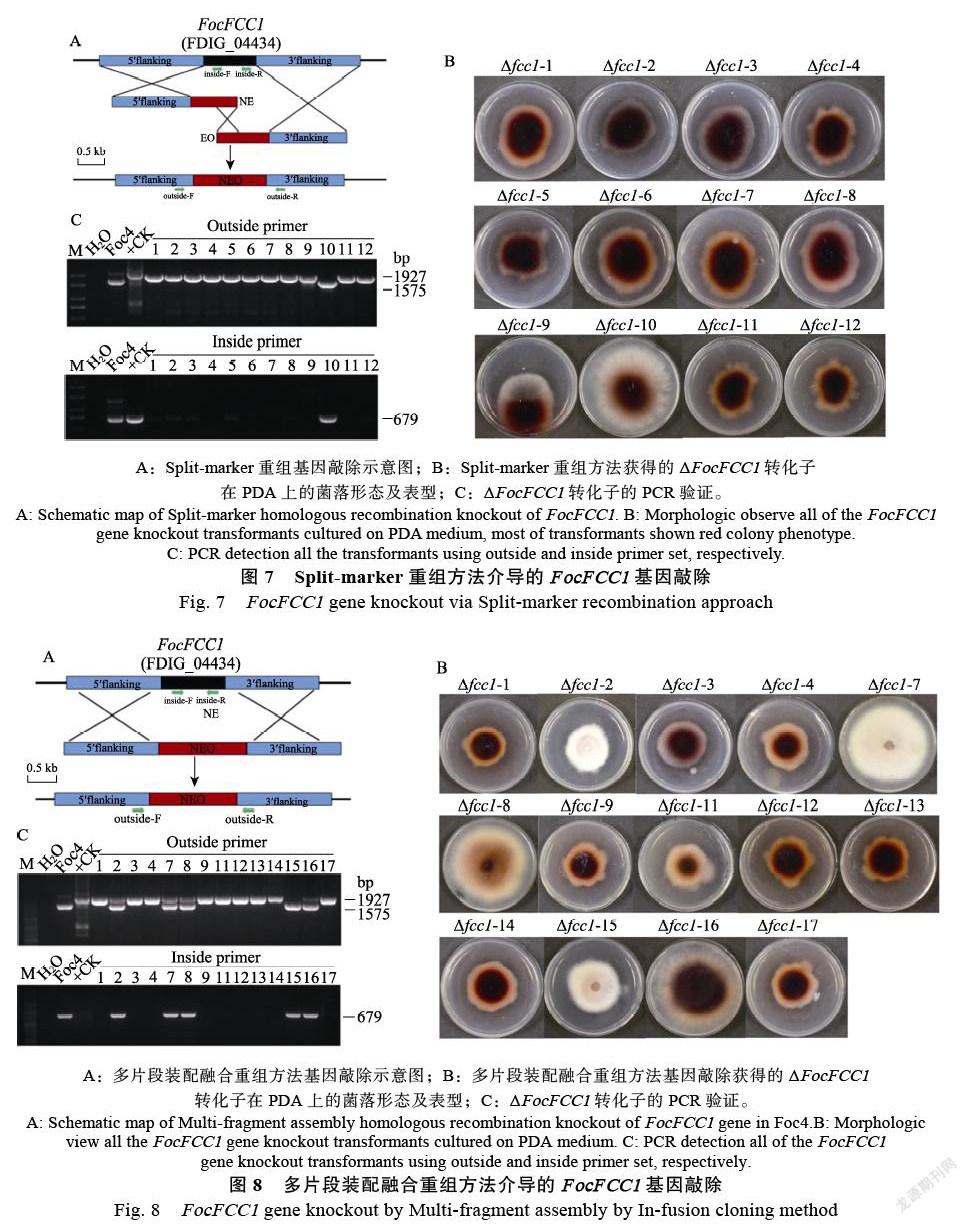
2.5.1 Split-marker重组方法介导的基因敲除 Split- marker重组方法的示意图如图7A,为了评估重组片段介导的基因敲除效率,通过PEG4000原生质体转化子将所有具有红色表型转化子挑取后在抗性PDA培养基上培养(图7B),CTAB法提取基因组DNA后分别用Outside和Inside引物检测所有转化子,结果显示12个转化子中,有11个转化子是阳性转化子,获得阳性转化子的比例为91.7%。
2.5.2 多片段装配融合方法介导的敲除效率 多片段装配融合方法的示意图如图8A,原生质体转化子将所有具有红色菌落表型的转化子挑取后在抗性PDA培养基上培养(图8B),CTAB法提取基因组DNA后分别用Outside和Inside引物检测所有转化子,结果显示14个转化子中,有9个转化子是阳性转化子,获得阳性转化子的比例为64%。
虽然2种重组方法获得阳性转化子比例存在差异,但是值得注意的是,所有阳性ΔFocFCC1突变体都出现红褐色的菌落表型,与PCR检测结果一致,这些结果说明ΔFocFCC1表型可以辅助阳性转化子的筛选。
3 讨论
香蕉枯萎菌FocFCC1含有典型的细胞周期蛋白表达框(Cyclin BOX)外,还含有RQKL功能域、PEST-Rrich功能域,与其他真菌FCC1蛋白序列高度同源。敲除FocFCC1基因后菌株生长缓慢,产孢量下降,致病力下降,菌落出现典型红色或红褐色表型,与F. fujikuroi上的报道结果一致[6],这些结果说明FCC1在进化过程中具有高度的序列和功能保守性,FCC1符合作为内源报告基因的条件:(1)全序列已测定且为单一拷贝基因;(2)重复性好、表型明确且容易分辨,菌落出现与野生株差异明显的红色表型;(3)其表达产物能够进行定量测定,FCC1调控伏马菌素(fumonisin)的生物合成,伏马菌素的含量与致病力一致[6]。
基因敲除是研究基因功能的手段之一,利用同源重组基因敲除,即利用基因两侧的同源臂在位点特异性DNA重组酶的作用下进行基因敲除是香蕉枯萎菌最常用的方法。构建基因敲除重组片段有2种方式,一种是Split-marker重组技术,将筛选标记基因分割到上、下游的同源臂序列上,转化后在体内可以再次重组交换,提高敲除的阳性率;另外一种是Multi-fragment assembly融合方法,通过In-Fusion cloning技术将上、下游同源臂序列和筛选标记基因等多片段融合的重组DNA片段。以FCC1为内源报告基因,评估这2种基因敲除重组片段介导的基因敲除效率。试验中,尽可能地挑取了所有的红色菌落表型的转化子进行检测分析减少误差。结果显示,二者再生板上的转化子数量差异不明显,Split-marker重组技术的阳性转化子比例为91.7%,而Multi- fragment assembly融合构建方法的阳性转化子比例达到了64%。此外,通过红色菌落表型和PCR条带一一对应分析,出现红色菌落表型的都是阳性转化子,也就是说,通过红色菌落表型即可辅助筛选判断阳性转化子,节省后续DNA提取以及PCR扩增电泳等诸多步骤和时间。
综上,FocFCC1基因在Foc4的生长发育、产孢及致病力等方面具有重要的作用。FocFCC1作为香蕉枯萎菌的内源报告基因,通过表型即可判断阳性转化子,为后续其他分子生物学技术的探索和建立提供了良好的靶标选择。
参考文献
[1] Liu S W, Li J, Zhang Y, et al. Fusaric acid instigates the invasion of banana by Fusarium oxysporum f. sp. cubense TR4[J]. New Phytologist, 2020, 225: 913-929.
[2] Jefferson R A, Kavanagh T A, Bevan M W. GUS fusions: beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J]. EMBO Journal, 1987, 6(13): 3901- 3907.
[3] Kumagai M H, Donson J, Della-Cioppa G, et al. Cytoplas-mic inhibition of carotenoid biosynthesis with virus-derived RNA[J]. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92(5): 1679-1683.
[4] Liu Y L, Schiff M D, Dinesh-Kumar S P. Virus-induced gene silencing in tomato[J]. The Plant Journal, 2002, 31: 777-786.
[5] Shim W B, Woloshuk C P. Regulation of fumonisin B1 biosynthesis and conidiation in Fusarium verticillioides by a cyclin-like (C-type) gene, FCC1[J]. Applied and Environ-mental Microbiology, 2001, 67(4): 1607-1612.
[6] Hwang I S, Ahn I P. Multi-homologous recombination- based gene manipulation in the rice pathogen Fusarium fuji-kuroi[J]. The Plant Pathology Journal, 2016, 32(3): 173-181.
[7] Wang W Q, Tang W H. Generation of Fusarium graminea-rum knockout mutants by the split-marker recombination approach[Z]. Bio-101, 2018, e2976. DOI: 10.21769/BioProtoc.2976.
[8] Zhu B G, Cai G F, Hall E O, et al. In-fusion assembly: seamless engineering of multidomain fusion proteins, mod-ular vectors, and mutations[J]. Biotechniques, 2007, 43(3): 354-359.
[9] Raman M, Martin K. One solution for cloning and mutage-nesis: In-Fusion® HD Cloning Plus[J]. Nature Methods, 2014, 11: 972.
[10] 王飛燕, 郭立佳, 杨腊英, 等. 尖孢镰刀菌古巴专化型4号生理小种fpd1基因敲除与表型分析[J]. 热带作物学报, 2015, 36(8): 1462-1468.
[11] 徐齐君, 胡小平, 陈 婷, 等. PEG介导的棉花枯萎病菌原生质体转化体系的建立[J]. 棉花学报, 2012, 24(3); 222-228.
[12] 戴蓬博, 梁晓飞, 张 荣, 等. 基于PEG介导原生质体转化构建粉红聚端孢荧光标记[J]. 菌物学报, 2019, 38(1): 90-97.
[13] 陆小平, 秦斌华, 陆志翔, 等. 香蕉枯萎病菌拮抗细菌的分离、鉴定及盆栽防治试验[J]. 中国热带农业, 2017, 74(1): 58-64.
责任编辑:沈德发

