大黄素对高脂饲料诱导ApoE-/-小鼠动脉粥样硬化的影响
夏 丽,田维毅*,王和生*,李妹娟,张 磊,赖陈岑
(1.贵州中医药大学,贵州 贵阳 550000;2.贵州中医药大学第一附属医院,贵州 贵阳 550000)
近年来,心血管疾病的发生及死亡呈日益年轻化、增长化趋势,作为其重要病理基础,动脉粥样硬化的预防与治疗已成为重点研究对象。作为一种慢性炎症疾病,从血管内脂质条纹产生到纤维斑块,再进展为动脉粥样斑块,到斑块不稳定和破裂,炎症反应贯穿于动脉粥样硬化发生发展的全过程[1],始终都能检测到各种炎症细胞和炎症介质,例如巨噬细胞和白细胞介素等炎症因子。经研究发现,制首乌中的大黄素具有抗心肌缺血、抗动脉粥样硬化、降低血脂的作用[2]。本研究旨在研究大黄素对单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)、干扰素γ(interferon gamma,IFN-γ)的影响,为今后防治动脉粥样硬化提供理论依据。
1 材料
1.1 动物与饲料 雄性SPF级C57BL/6 J小鼠12只,ApoE-/-小鼠60只,6周龄,体质量(20±2)g,购自贵州医科大学,实验动物生产许可证号SCXK(黔)2012-0001,实验操作符合伦理委员会要求。高脂饮食按照21%精炼猪油、0.15%胆固醇、78.85%基础饲料比例制作[3]。
1.2 药物、试剂与仪器 大黄素(黄色粉末,纯度98.7%,货号BH20150716,西安飞达生物技术有限公司);血脂康(批号Z10950029,北京北大维信生物科技有限公司)。小鼠MCP-1 ELISA试剂盒(货号EMC113)、小鼠IFN-γ ELISA试剂盒(货号EMC101)均购自欣博盛生物科技有限公司;脂多糖(货号L2880,美国Sigma公司)。实时荧光定量PCR仪(型号CFX96)、微电脑PCR仪(型号C1000)均购自美国Bio-Rad公司。
2 方法
2.1 动物模型建立及给药 将60只成年雄性ApoE-/-小鼠普通饲料喂养1周,随机分为模型组,大黄素高、中、低剂量组,阳性对照组,每组12只。正常对照组为ApoE-/-小鼠的背景鼠C57BL/6 J成年小鼠,健康雄性,共12只,以基础饲料常规饲养,灌胃生理盐水;给药组小鼠基于高脂饮食,大黄素高、中、低剂量组分别灌胃40、20、10 mg/kg药物,阳性对照组灌胃200 mg/kg血脂康,连续6周。
2.2 血液、心肌组织采集 给药6周后隔1 d,小鼠禁食12 h,眼球取血,3 000 r/min离心15 min,分离血清用于生化及ELISA检测,取小鼠心脏并纵向剪开,得到的心肌组织放入RNA保存液用于提取RNA。
2.3 生化指标检测 通过全自动酶标仪检测总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平。
2.4 RT-qPCR检测小鼠心肌组织MCP-1、IFN-γmRNA表达 按说明书提取心肌组织RNA,根据试剂盒说明书,冰上配制各组反应液,进行RT-qPCR分析,反应条件为预变性50 ℃,120 s;95 ℃,600 s;热循环,95 ℃,15 s;退火60 ℃,60 s,40次循环。采用2-△△CT法计算mRNA表达量,引物序列见表1。

表1 引物序列
2.5 ELISA法检测血清IFN-γ、MCP-1水平 于对照品孔内滴加梯度浓度对照品,样品孔内滴加待测样品,37 ℃水浴锅孵育90 min,洗板5次,甩净,于空白孔中滴加抗体稀释液,其余孔中滴加抗体工作液,37 ℃水浴锅孵育60 min,洗板5次,甩净,空白孔加酶结合物稀释液,其余孔加酶结合物工作液,37 ℃水浴锅孵育30 min,洗板5次,每孔滴加显色底物液,封板胶覆盖反应孔,37 ℃水浴锅孵育15 min,每孔滴加终止液后,置于酶标仪内,检测吸光度。

3 结果
3.1 各组小鼠血清中TC、TG、HDL-C、LDL-C水平变化 与正常对照组比较,模型组血清TC、TG、LDL-C水平升高(P<0.05),HDL-C水平降低(P<0.05);与模型组比较,大黄素各剂量组和阳性对照组TC、TG、LDL-C水平均降低(P<0.01),HDL-C水平均升高(P<0.01),见图1。

注:与正常对照组比较,#P<0.05;与模型组比较,**P<0.01。图1 各组小鼠血清中TC、TG、HDL-C、LDL-C水平
3.2 各组小鼠心肌组织MCP-1、IFN-γ的mRNA表达 与正常对照组比较,模型组MCP-1 mRNA表达升高(P<0.05),IFN-γmRNA表达降低(P<0.05);与模型组比较,大黄素各剂量组和阳性对照组MCP-1 mRNA表达降低(P<0.01),IFN-γmRNA表达升高(P<0.05,P<0.01),见图2。

注:与正常对照组比较,#P<0.05;与模型组比较,*P<0.05,**P<0.01。图2 各组小鼠心肌组织MCP-1、IFN-γ mRNA表达
3.3 各组小鼠血清MCP-1、IFN-γ水平 与正常对照组比较,模型组MCP-1水平升高(P<0.05),IFN-γ水平减低(P<0.05);与模型组比较,大黄素低、中剂量组和阳性对照组血清MCP-1水平降低(P<0.01),IFN-γ水平升高(P<0.01),大黄素高剂量组血清MCP-1、IFN-γ水平均降低(P<0.01),见图3。
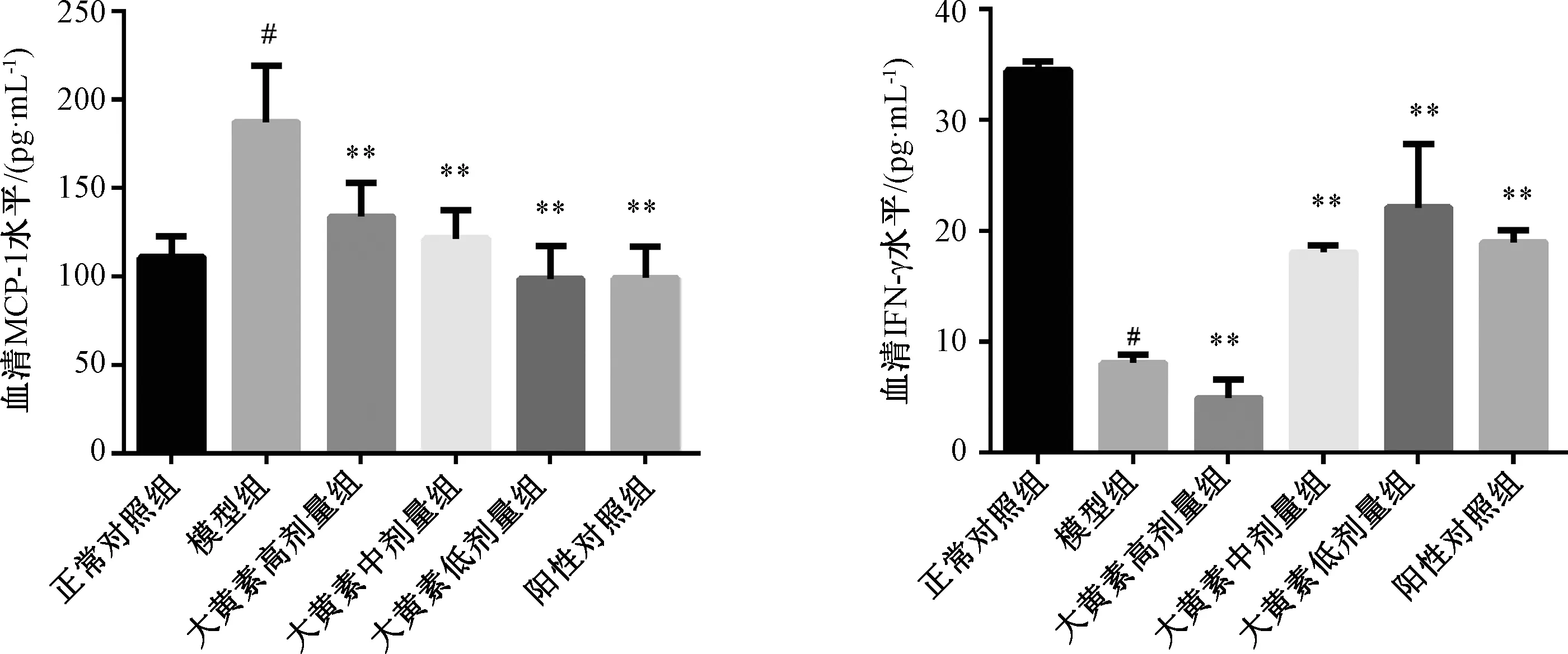
注:与正常对照组比较,#P<0.05;与模型组比较,**P<0.01。图3 各组小鼠血清MCP-1、IFN-γ水平
4 讨论
动脉粥样硬化作为心脑血管疾病的病理基础,主要涉及脂类代谢、炎症与氧化应激等。上世纪90年代动脉粥样硬化的炎症理论提出后[4],逐渐被世界广泛接受。血脂与动脉粥样硬化之间关系已是众所周知,现在大多数认可,TC、TG、LDL-C的发展诱导动脉粥样硬化,尤其ox-LDL刺激泡沫细胞生成从而释放出更多的炎症介质加重,而HDL-C则是帮助减少其发生发展[5]。MCP-1是巨噬细胞分泌的促炎症因子,是加速形成动脉粥样硬化的重要因素之一。临床研究发现,患有动脉粥样硬化内膜斑块的患者,体内血清MCP-1的水平高于正常组[6]。既往研究表明,MCP-1不仅可以趋使单核细胞聚集,加速泡沫细胞形成,还可以对白介素、肿瘤坏死因子等其余促炎症因子产生影响,促进血管内皮细胞的增殖,加速动脉粥样硬化斑块形成[7-8]。IFN-γ曾用名叫巨噬细胞活化因子,为水溶性二聚体,是Ⅱ型干扰素。研究发现,ApoE-/-小鼠建模成功后主动脉壁斑块免疫组化中可见IFN-γ呈现阳性,表达高于正常组[9]。IFN-γ是双向调节因子,在动脉粥样硬化发生发展过程中扮演重要角色。另有学者报道通过调控IFN-γ可以改善动脉粥样硬化的病变程度[10],在巨噬细胞中抑制极低密度脂蛋白受体表达,抑制泡沫细胞形成[11]。
大黄素作为制首乌游离蒽醌主要成分,具有抗炎、抗氧化、降低血脂等作用。本课题组前期研究发现,制首乌游离蒽醌抗动脉粥样硬化作用可能通过上调ABCA1,调控血脂,影响血清NO水平,降低NF-κB、IL-1β表达抑制炎症反应[12-14]。本研究结果显示,模型组TC、TG、LDL-C水平较正常对照组升高,提示动脉粥样硬化模型复制成功;与模型组比较,大黄素各剂量组和阳性对照组TC、TG、LDL-C均有不同程度的下降,提示大黄素可以加速TC、TG、LDL-C的分解,促进血清中HDL-C的合成,起到有良好的调脂作用。从基因表达上看,本研究模型组中MCP-1 mRNA表达升高,IFN-γmRNA表达降低,这与文献报道一致,进一步说明MCP-1伴随着动脉粥样硬化的发展。通过大黄素干预后,MCP-1 mRNA表达降低,IFN-γmRNA表达升高,提示大黄素可以降低MCP-1、升高IFN-γmRNA表达,抑制炎症反应。ELISA检测MCP-1水平变化趋势与基因表达基本一致。大黄素中、低剂量干预后IFN-γ水平升高,而高剂量组表现不同,考虑是大黄素高剂量组在转录过程中能升高IFN-γ的表达,但其翻译修饰等各种因素出现蛋白变化,具体表现差异有待进一步研究。
综上所述,本研究以ApoE-/-小鼠为对象,炎症与动脉粥样硬化的关系为切入点,观察大黄素对炎症因子MCP-1、IFN-γ的影响。结果表明,大黄素可以通过调控MCP-1、IFN-γ抑制动脉粥样硬化的炎症反应,具有抗炎及抗动脉粥样硬化的作用,为临床防治动脉粥样硬化及药物的开发提供了新思路。

