金属管道的腐蚀失效分析
吴祉睿*
(湖北大学,湖北 武汉 430062)
近年来,地下金属管道完成铺设后,为稳定地层压,常采用酸化工艺,导致管材对环境介质的要求更为苛刻,这是金属管出现失效的主要原因之一,常常造成巨大的经济损失和安全隐患[1,2]。本文主要研究了金属管道被腐蚀断裂失效原因,探讨此类金属管的失效规律,为预防和解决此类事故提供有效的理论支持。
1 分析方法
对失效母材和腐蚀产物进行分析,具体采用以下试验方法进行:
(1)对失效样件进行宏观形貌观察,测量几何尺寸。
(2)按照GB/T 16597-1996标准,使用荧光光谱仪对其材质进行化学分析。
(3)采用砂纸打磨和剖光再用酒精进行清理,观察其微观组织。依据API spec 5CT-2005标准,采用显微硬度计对金相样品进行硬度测定。
(4)对失效金属管腐蚀严重的部分取样,采用zeiss auriga 39-87 Gemini扫描电镜观察腐蚀产物形貌,配合eDS能谱对腐蚀产物进行成分分析。
2 理化分析及结果
2.1 宏观分析
样本规格为φ20mm,钢级为HL级,材质为35CrMoA,如图1所示,金属管外表面外圆部分已经看不到整个圆弧状的边缘形貌,式样磨平除去锈层后存在圆弧状和近似椭圆状腐蚀坑。金属管表面整体已经被腐蚀至凹凸不平、表面最大深度达3.13mm,表面局部覆盖棕黄色疏松锈层。管道连接部位腐蚀程度严重,间接表明其介质的强腐蚀性。

图1 金属管被腐蚀的宏观形貌图
2.2 化学成分分析
取被腐蚀失效金属管进行化学成分分析,按照ASTMA751-2008进行化学成分分析,由表1可见。金属管道连接部位的化学成分符合API SPeC 5CT-20011标准技术要求。研究样品的硬度为272.2~299.1 Hv,接箍处硬度为206~118 Hv。
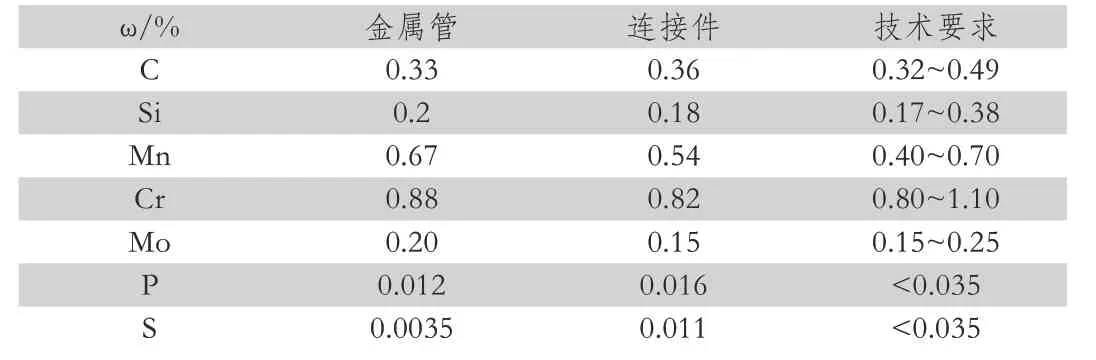
表1 失效样件化学成分分析结果
2.3 金相观察
金属管断裂显微组织图像如图3所示,金相组织为回火索氏体,无明显夹杂,并未出现金相组织的异常,因此可以确定失效金属管发生严重腐蚀行为与材料本身无关,应是服役环境中含有严重的腐蚀介质。

图2 金属管断裂的局部微观形貌

图3 金属管的断裂金相观察
2.4 腐蚀产物分析
取表面腐蚀产物进行分析;部分区域出现黄色产物,黄色产物下部暴露较为光亮的金属基体,表明黄色产物对基体存在一定的保护性。
选取图4中所示扫描电镜形貌观察图。

图4 金属管腐蚀部分的扫描电镜分析区域
3 腐蚀失效原因分析
综合以上分析,被腐蚀金属管材质化学成分符合技术协议要求,其主要金相结构为回火索氏体,不存在组织转变,材料性能变化造成失效。
金属管长期处在酸性溶液和氧环境中会发生严重的腐蚀破坏。其表面残存的大量Cl、Na残留物质。随着腐蚀不断的进行,金属管减薄,最后出现断脱失效开裂。
3.1 酸压腐蚀
金属管出现严重的腐蚀失效,由图所示的宏观腐蚀形貌观察,金属管长期处于强酸环境条件下。结合金属管在服役状态和各项检测分析结果,酸化返排液(乏酸)对金属管造成了严重的腐蚀。典型配方为:20%HCl+2.0%HS-6高温缓蚀剂+2.5%JN-2胶凝剂+1%LH-5铁离子稳定剂+1%FB-1助排剂+1%PR-7破乳剂+0.5%JM-4粘土稳定剂。
其具体操作是用高压泵将酸液注入地层,酸液与地层中的矿物、胶结物起化学反应,从而扩大地层中的裂缝和孔隙,提高地层渗透能力,起到增产作用[4];酸化工艺通常采用的是高浓度的盐酸或土酸(盐酸+氢氟酸)。酸化处理后的返排液(乏酸)通过管道及地面处理系统排出。返排液中往往含有一定浓度的残酸,同时还含有亚铁离子、各种阴阳离子及残留缓蚀剂等多种化学成分。
盐酸是强酸,在没有加入适合的缓蚀剂时,会对金属管产生强烈的腐蚀作用。因此,在进行酸化作业时,酸化液中要加入适合的酸化缓蚀剂。但如果酸化液中的缓蚀剂加量不足或缓蚀剂一旦失效时,会使酸化液的腐蚀性很强;另外,如果施工时酸液作用地层的时间不充分,反应不完全,以及能与酸液反应的地层矿物组份含量较低,都会使乏酸的浓度偏高;再有,如果施工过程中的顶替量不够,部分酸液残存于金属管内,因其未与地层矿物反应,H+没有得到正常消耗,乏酸浓度也会很高;所以如果发生了上述的几种情况,都会使金属被严重腐蚀。
酸对金属管的腐蚀是通过酸液中电离的氢离子,腐蚀导致铁在金属表面的阳极被氧化并溶解,同时氢离子在阴极被还原并生成氢气。
阳极反应:Fe→Fe2++2e
阴极反应:2H++2e→H2↑
出现腐蚀主要有以下表征:
(1)乏酸液的pH值。环境的pH值是控制腐蚀速度的一项重要的外部因素。资料表明,管道所处的环境pH值不大于5.5时,金属管被腐蚀速度通常很大;当pH值大于6.6时,腐蚀速度则很小。
(2)乏酸中的缓蚀剂性能。酸化施工过程中添加酸化缓蚀剂,通过其在金属管表面的吸附、成膜,阻断酸对钢铁的腐蚀,从而降低酸液对施工设施和金属管的腐蚀。随着酸化作业的完成,酸液与地层中岩石反应,酸液中缓蚀剂在地层表面吸附,有效浓度有所降低,返排的乏酸液与泵体、套管接触,易发生点蚀,造成局部腐蚀,严重时使套管破裂或脱落,所以乏酸中缓蚀剂是否还具有缓蚀效果至关重要;
(3)温度。通常腐蚀速率是随温度升高而增大。温度升高,扩散速度增大,同时电解液电阻下降,所以使腐蚀电池的反应加快,同时高温环境下,有一些有机缓蚀剂在酸环境中,会随时间的延长而降解,很难提供长时间的保护。
3.2 溶解氧腐蚀
地层液体中矿化度平均230000mg/L,氯离子浓度平均为140000mg/L,CO2含量约2.3%,H2S含量约为6000mg/L,使得注气过程中氧气进入地层液,形成高“CL--O-CO2-H2S”体系介质环境。地层液体中溶解氧含量为1.07mg/L,酸压和注气等增产工艺和生产过程中均含有盐水和氧,氧进一步会在水中溶解,发生电化学腐蚀,氧作为阴极发生极化反应,极易和阴极附近的氢离子结合,消耗掉阴极周围的电子进而加速电化学反应速率,通常随着温度的升高反应速率升高,当溶解氧浓度<1mg/L时,反应机理如下:
阳极反应:
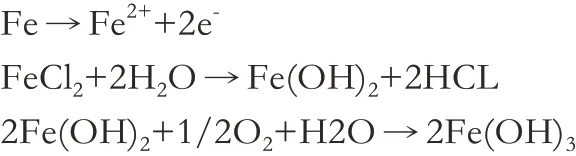
阴极反应:
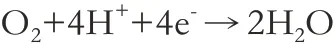
注气过程中气体流速高(>30MPa),地下下温度高(25-150℃),金属管道表面产生的腐蚀产物脱落,导致管道金属基体暴露在苛刻的介质环境中,使得金属管道腐蚀程度高于集输管道,此外由于高流速流体导致溶解氧含量上升,可达到1000mg/L。在冲刷和氧电化学腐蚀二者的作用下,导致腐蚀程度严重。
4 结语
(1)腐蚀管道的组织、化学成分均符合35CrMo材料的性能标准。
(2)地下金属管道所处环境为高“CL--O-CO2-H2S”体系介质环境,腐蚀产物主要成分为Fe、O、Na、Cl等元素,相比较单一腐蚀工况,本次研究的金属管道所处工况更加复杂苛刻,管道连接部位腐蚀脱断的主控因素为酸压导致pH过低和溶解氧电化学腐蚀。

