长链非编码RNA与胃癌发生发展、耐药及EBV感染的研究进展
卫美蓉,王笑峰,罗 兵
胃癌是常见的消化系统恶性肿瘤,病死率较高[1]。EBV相关胃癌(EBV-associated gastric carcinoma, EBVaGC)在胃癌中的占比较高,早期非侵入性诊断方法缺乏及胃癌细胞耐药性是引起胃癌患者病死率高的主要原因。因此,为了提高胃癌患者的早期诊断率,准确预测其治疗效果及预后,寻找有效的新型分子标志物成为亟需解决的问题。
长链非编码RNA(long non coding RNA, LncRNA)是一种不具有编码蛋白质的能力,且长度超过200个碱基的RNA分子[2]。其表达失调与人类多种肿瘤相关,是当前研究的热点[3-4]。通过微阵列基因芯片和RT-PCR等检测方法对胃癌组织进行分析,研究发现多种LncRNA均出现异常表达。在胃癌的恶性生物学行为方面,参与肿瘤基因调控及细胞耐药性的LncRNA倍受关注,有望成为胃癌诊断、预后评估的新型标志物和肿瘤治疗的潜在靶点。该文对与胃癌及EBVaGC关系密切的LncRNA研究进展作一综述,拟为临床胃癌的早期诊断、抑制转移、耐药性等提供新的思路。
1 胃癌相关LncRNA
近年研究发现,多种LncRNA在胃癌细胞中存在异常表达。其异常表达均可通过不同的途径实现改变生物遗传信息的目的:如LncRNA作为致癌或抑癌基因,通过参与microRNA信号传导途径,进而影响胃癌细胞的增殖、浸润和转移(表1)。
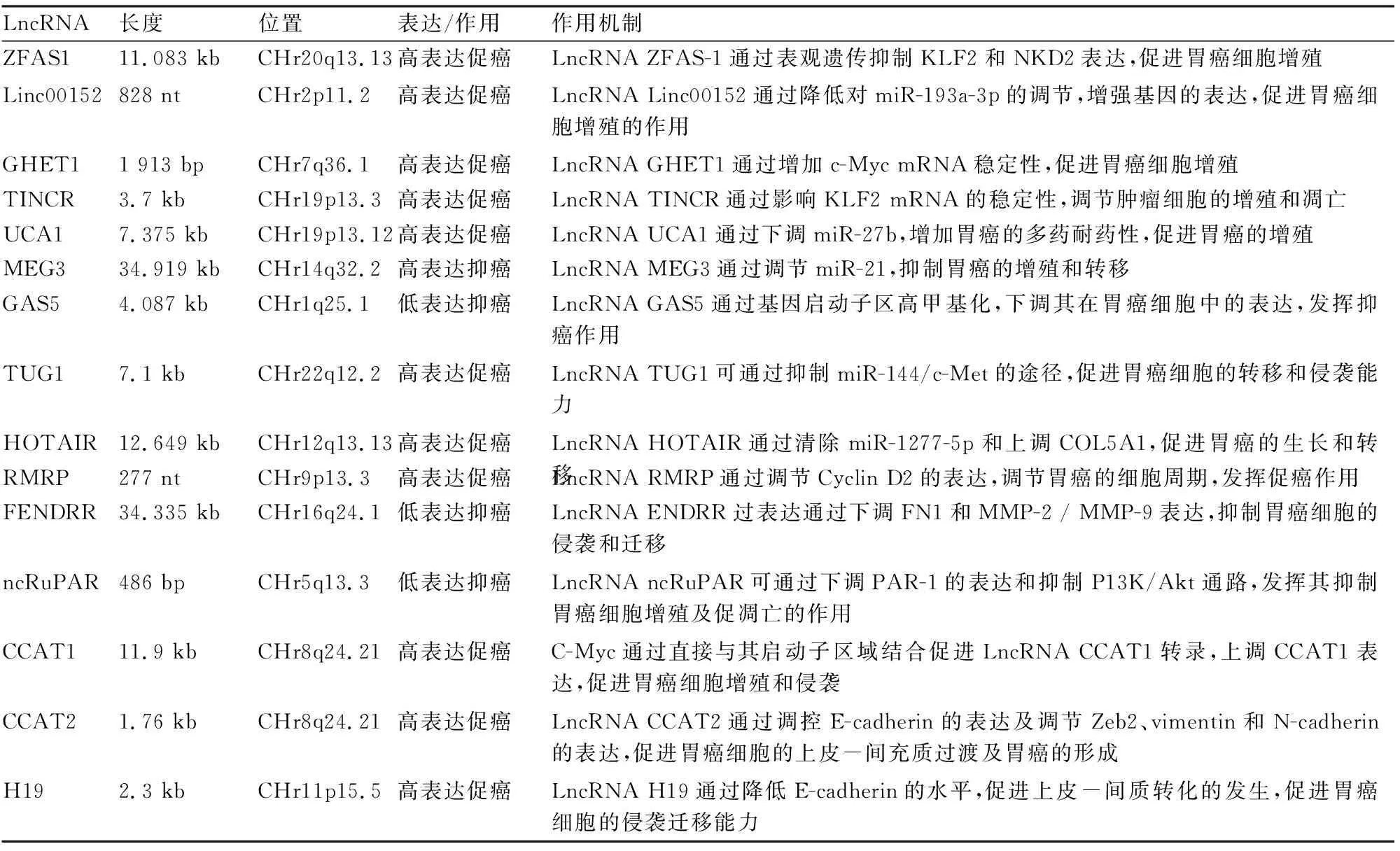
表1 胃癌相关LncRNA
1.1 促进胃癌细胞增殖与组织侵袭转移相关的LncRNA
1.1.1ZFAS1 锌指结构反义转录本1(zinc finger antisense 1, ZFAS1)是一个转录自蛋白质编码基因Znfx1 5′端附近反义链的LncRNA,位于染色体20q13.13上,最初被认为是乳腺肺泡发育和上皮细胞分化的调节因子。近期研究发现胃癌患者的细胞、血清、血清外切酶体、肿瘤组织中,均可出现ZFAS1高表达。高表达的ZFAS1可通过调控上皮-间质转化,促进胃癌细胞的增殖和迁移。同时,研究结果还发现ZFAS1可存在于血清外切酶体中,并通过外切酶体的传播,增强胃癌细胞的增殖和迁移[5]。
1.1.2Linc00152 最初在研究肝癌中发现的Linc00152基因位于Ch2p11.2,长度为828 nt,具有调控基因表达的功能,也被称为细胞骨架调节因子。Huang等[6]研究发现Linc00152在胃癌组织中的表达高于邻近正常组织,且下调Linc00152表达,胃癌细胞的增殖也受到抑制。进一步深入分析发现Linc00152通过降低对miR-193a-3p的调节,增强Mcl-1基因的表达,从而发挥促进胃癌细胞增殖的作用:提示Linc00152可能是预测胃癌预后新的生物学标志物。
1.1.3GHET1 胃癌中GHET1基因位于染色体7q36.1,长度为1 913 bp,于2013年最先被Yang等发现在胃癌中过表达,且其高表达对胃癌的进展有显著促进作用。然而,GHET1基因下调可通过下调相关周期蛋白,抑制细胞的增殖、入侵和迁移活动,最终增强细胞凋亡作用,即低表达的GHET1通过干扰胃癌细胞周期通路,最终影响胃癌的发生、发展[7]。
1.1.4TINCR TINCR基因位于人类第19号染色体上,长度为3.7 kb,具有促进表皮细胞分化的作用。近年,研究发现胃癌组织中TINCR的表达水平显著高于癌旁组织,且TINCR可通过转录后机制促进胃癌细胞的表皮分化。TINCR还与双链RNA结合蛋白STAU1有较强的结合力,其可形成1个含有25个核苷酸的“TINCR box”复合体,增强mRNA的稳定性,最终影响胃癌的形成。Chen等[8]研究发现TINCR通过与miR-375竞争性调控3-磷酸肌醇依赖性蛋白激酶-1,进而调控胃癌的发生、发展。
1.1.5UCA1 其是一种在胚胎组织中普遍表达的LncRNA,在成人心脏和脾脏组织中也有少量表达。有研究发现,在多种肿瘤组织中均可见UCA1过表达,且其表达水平与肿瘤的侵袭转移行为有关。如UCA1通过促进Cyclin D1的表达参与胃癌的增殖和细胞周期进程。Gu等[9]通过分析UCA1的功能学研究,也证实UCA1可通过负调控miR-590-3p的表达促进胃癌细胞的增殖。
1.1.6TUG1 其最初被发现为牛磺酸作用于小鼠视网膜细胞后,表达上调的基因。TUG1定位于人染色体22q12.2,由3个外显子组成,全长7.1 kb。有研究发现,TUG1能够通过调控组蛋白甲基化转移酶2介导的甲基化调节效应因子,沉默抑癌基因的表达,从而导致恶性肿瘤的发展。研究发现,胃癌组织中TUG1的表达明显高于相应正常组织。进一步分析发现胃癌组织中TUG1表达与p27表达呈负相关,而与Cyclin D1表达呈正相关。TUG1可能通过抑制p27的表达,增加Cyclin D1表达,从而促进胃癌细胞及组织的增殖、侵袭与转移[10]。
1.1.7HOTAIR 其只存在于哺乳动物中,参与基因组修饰,且位于HOXC11和HOXC12之间,是第一个被证实在肿瘤侵袭转移中发挥作用的LncRNA。HOTAIR在胃癌组织中表达显著高于癌旁组织,其高表达可能在胃癌细胞增殖、侵袭、转移过程中发挥重要作用。进一步研究表明,LncRNA HOTAIR通过清除miR-1277-5p和上调COL5A1的表达最终促进胃癌的生长和转移[11]。
1.1.8RMRP 其全长277 nt,位于人染色体9p13.3。在人组织中高表达的LncRNA分子中,RMRP最早是在研究人软骨、毛发发育不全时被发现的,其主要存在于细胞核和核仁中,少量存在于线粒体中。相关研究发现,胃癌患者的组织、血浆和胃液中RMRP的表达与对照组相比显著不同,且其表达水平与肿瘤的分型和转移密切相关。如RMRP可通过调节Cyclin D2的表达,调节胃癌细胞周期。过表达的RMRP可促进胃癌细胞的生长[12]。
1.1.9CCAT1 其在结肠癌的差异分析研究中被鉴定,其基因定位于染色体8q24.21,长度为11.9 kb。研究者利用实时荧光定量PCR对CCAT1的表达进行检测,并分析CCAT1的表达量与胃癌临床病理特征的关系。结果发现:CCAT1在胃癌患者血清中呈过表达,且表达强度与胃癌组织肿瘤大小、淋巴转移和TNM分期有关。深入研究还发现CCAT1通过对miR-219-1的负调节,可促进胃癌的侵袭与转移[13]。
1.1.10CCAT2 其定位于1个高度保守的富含调控元件标志物的染色体8p24扩增子区域,该区域是发生肿瘤易感性基因变异的重要区域。Wang等[14]研究发现胃癌组织中CCAT2的表达相比临近的非癌组织明显升高,且CCAT2高表达与肿瘤大小、TNM分期、淋巴结转移等呈正相关。这一结果表明:CCAT2可通过调控E-cadherin表达及调节Zeb2、vimentin和N-cadherin的表达,促进胃癌上皮细胞-间充质过渡,最终促进胃癌的形成。
1.1.11H19 其位于染色体11p15.5,全长约2.33 kb,由5个外显子和4个内含子组成。H19是最早发现与肿瘤关系密切的LncRNA,可通过调节CPT1C蛋白表达,增强胃癌组织的侵袭和迁移能力。Liu等[15]研究发现H19在胃癌患者的组织和胃液中呈高表达,且高表达的H19通过降低E-cadherin的水平,促进上皮-间质转化的发生,从而加剧胃癌组织的侵袭、迁移能力。H19派生的miR-675作为重要调节媒介,其表达水平与H19呈正相关。研究还发现由于H19在血浆中不易被内源性Rnase降解,其稳定性增加,可准确反映胃癌组织中H19水平[16]:提示H19作为胃癌早期诊断的分子标志物具有更大的优越性。
1.2 抑制胃癌细胞增殖及组织侵袭相关的LncRNA
1.2.1MEG3 其位于人类染色体14q32.3,在多种恶性肿瘤细胞的生物进程中发挥抑制作用。研究发现该基因在许多正常组织中表达,而在各种癌细胞系中表达丢失,通过表达调节影响机体细胞代谢的进程。越来越多的实验证明,MEG3在邻近正常组织中的表达水平显著升高,且过表达的MEG3可减少胃癌细胞的增殖和侵袭。如高表达的MEG3通过抑制miR-21的表达,发挥抑制胃癌细胞在体内生长和转移的作用[17]。
1.2.2GAS5 其是5′末端寡嘧啶类基因的成员,也是小核仁RNA宿主基因。GAS5编码的一部分转录本二级RNA结构,模仿糖皮质激素反应元件(glucocorticoid response element, GRE)。该转录物具有多种功能,包括调控细胞生长停滞和凋亡。因此,GAS5也被认为是潜在的肿瘤抑制因子,其下调与多种不同组织癌症的发生有关。研究发现GAS5在胃癌组织中的表达显著下调,其表达量与胃癌细胞的凋亡相关及通过负向调控miR-23a影响胃癌的恶性行为[18]。 该研究提示GAS5可能参与胃癌细胞的凋亡过程。
1.2.3FENDRR 2009年由Khail发现的FENDRR基因,定位于染色体16q24.1,是由4个外显子编码的长为34.3 kb的LncRNA。一项有关FENDRR在胃癌细胞中干预细胞增殖、伤口愈合,以及体外、体内环境下组织侵袭和迁移的生物学效应的研究显示:与正常胃上皮细胞和相邻非癌组织样本相比,FENDRR在胃癌细胞系和癌组织中表达量下调。FENDRR低表达意味更深的肿瘤侵袭、更高的肿瘤分期和淋巴转移。然而,FENDER过表达则通过下调FN1和MMP-2、MMP-9的表达,进而抑制体外胃癌细胞的侵袭和转移[19]。
1.2.4ncRuPAR 2002年由美国科学家Madamanchi发现ncRuPAR基因位于染色体5位置,其大小为486 bp。近年,研究发现其可以在胚胎生长过程中通过PAR-1抑制胃癌的进展。Liu等[20]研究发现胃癌组织中ncRuPAR的表达量显著下调,而PAR1和VEGF的mRNA水平均显著升高。深入分析发现ncRuPAR的表达与胃癌组织大小、肿瘤浸润深度、淋巴结转移和远处转移情况呈显著相关。同时,ncRuPAR表达与胃癌组织中PAR1和VEGF的表达强度呈负相关,提示ncRuPAR可能通过增加两者的表达抑制胃癌的发生、发展。
2 胃癌细胞耐药性相关的LncRNA
耐药性是胃癌患者化疗失败的重要原因之一,也是胃癌治疗研究领域的热点。异常表达的LncRNA可通过靶向调控药物外排泵分子、凋亡调节蛋白等不同途径介导调控肿瘤的耐药性。近年,有关LncRNA与胃癌细胞耐药性关系的研究也取得了较大进展。如LncRNA可通过干扰药物代谢的生理过程及细胞损伤修复的信号通路,最终干预肿瘤细胞的耐药性。研究发现对顺铂耐药的胃癌患者组织和细胞内LncRNA PVT1高表达。有学者在胃癌细胞耐药性试验中发现PVT1高表达,可加强胃癌细胞对紫杉醇药物的耐药性;同时应用薏苡仁油还可抑制PVT1的表达,降低多种耐药性分子MDR1和MRP1的表达,进而抑制胃癌细胞的耐药性。这一研究结果表明,高表达的PVT1可增强胃癌细胞对化疗药物的耐药性[21]。Wu等[22]发现LncRNA UCA1通过降低miR-27b的表达,增强胃癌对多药的耐药性。同时还发现LncRNA BLACAT1可通过调节多药耐药性蛋白的表达,达到改变细胞内药物浓度,从而促进胃癌细胞对奥沙利铂耐药的发生。然而,LncRNA在降低胃癌细胞耐药性方面也发挥一定作用,如LncRNA LEIDC可增加胃癌细胞对于5-氟尿嘧啶的化疗敏感性,通过增强化疗药物诱导的胃癌细胞凋亡,加强抗肿瘤效果,从而促进胃癌患者康复[23]。
研究表明,LncRNA参与调控胃癌细胞耐药性的主要作用:(1)通过促使药物代谢异常而发挥耐药性。(2)通过增强胃癌上皮-间质转化加强肿瘤细胞转移能力。(3)参与调控胃癌细胞凋亡过程诱导其产生耐药性。因此,对胃癌组织中异常表达的LncRNA进行干预,对与胃癌耐药性相关的LncRNA及其调控耐药的分子机制进行深入分析,则成为胃癌治疗领域研究的热点,也为探索胃癌耐药理论开辟新的研究领域。
3 EBVaGC中相关LncRNA
近年EBVaGC的发病率逐年上升,LncRNA与EBV感染的关系也成为人们研究的热点。有研究表明,H19在EBVaGC细胞系中的表达水平比EBV阴性胃癌(EBV negative gastric carcinomas, EBVnGC)细胞系低。EBV通过调控H19启动子区高甲基化,从而调控H19在胃癌组织中的表达水平,最终影响胃癌的发生。Wu等[24]研究发现EBV感染后,胃癌组织中NAPA的表达出现下调。即LMP1通过上调NF-KB亚单位p50,使其在NAPA启动子区形成二聚体,从而抑制NAPA的表达。同时,该蛋白能抵抗顺铂导致的细胞凋亡作用,从而增加胃癌细胞(BALB/c-3T3细胞)对顺铂诱导的细胞凋亡的敏感性。然而,敲除LMP1后,NAPA蛋白水平恢复,胃癌细胞则对顺铂产生耐药。He等[25]研究还发现LncRNA Loc553103在胃癌组织中的表达,可通过EBV-miR-BART6-3p下调,且Loc553103过表达可通过促进细胞上皮-间质转化,导致胃癌细胞迁移和侵袭。有研究发现EBVaGC中LncRNA SNHG8高表达。采用共表达和富集分析显示,SNHG8与EBV蛋白LF3、BHRF1和BNLF2a相互作用,且这些蛋白质还可以反过来作用于胃癌细胞DNA的修复,细胞上皮-间质转化和核糖体的功能,从而在胃癌发生的信号通路中发挥重要作用[26]。
以上研究均表明,LncRNA在EBVaGC致病机制中或EBV感染过程中发挥重要作用,且为EBVaGC的致病机制研究提供新思路。然而,目前有关LncRNA与EBV、LncRNA与EBVaGC的相关报道较少,尚需进一步分析。
4 小结与展望
目前,虽已有研究证明LncRNA在胃癌的早期诊断、侵袭转移、耐药、预后及治疗靶标中发挥重要作用,但相关研究仍处于起步阶段,未来仍面临较多的挑战。如LncRNA在组织中的研究较广泛,而其在血液、胃液中的研究却有限;LncRNA与EBVaGC关系的报道还较少;多数LncRNA与胃癌的致病机制尚不明确,且与胃癌的转移、耐药及EBV感染等机制相关LncRNA的研究尚不成熟。今后将在这些方面进行更加深入的分析,相信越来越多的LncRNA分子与胃癌及EBVaGC发生、发展的关系将被阐释;实现基础研究到临床应用的过渡,最终给胃癌患者带来新的希望。

