miR-185在弥漫大B细胞淋巴瘤细胞黏附介导耐药中的作用
缪小兵,张邢松,陈卓琳,尹海兵
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)是常见的恶性淋巴瘤[1],越来越多的证据表明,耐药是治疗DLBCL的重要挑战。现已证实,肿瘤细胞与纤连蛋白(fibronectin, FN)的黏附可导致耐药表型,称为细胞黏附介导的耐药(cell adhesion mediated-drug resistance, CAM-DR)[2-3]。据文献报道,miR-185在调节肿瘤耐药中具有重要作用。miRNA是18~24个核苷酸组成的非编码RNA,可在转录后调节基因表达[4]。Lin等[5]发现,过表达miR-185可提高酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)治疗无反应的慢性粒细胞白血病干细胞/祖细胞对TKI的敏感性。目前,miR-185在DLBCL CAM-DR中的作用尚不清楚。文献报道,PYK2在肿瘤微环境介导的多发性骨髓瘤耐药中发挥关键作用[6-7]。PYK2是由PTK2B编码的非受体酪氨酸激酶,参与感知细胞对细胞外基质的黏附。本研究通过生物信息学方法发现人PTK2B基因的3′非翻译区(untranslated region, UTR)含miR-185作用位点,采用慢病毒感染技术通过抑制或过表达miR-185,分析miR-185对PYK2的调节作用,并观察其对DLBCL CAM-DR的影响。
1 材料与方法
1.1 细胞株人DLBCL细胞OCI-Ly8由复旦大学附属肿瘤医院周晓燕教授惠赠,培养于含10%胎牛血清的RPMI 1640培养基中。人DLBCL细胞OCI-Ly10及人胚肾HEK-293T细胞购自南京科佰生物公司。OCI-Ly10细胞培养于含20%胎牛血清的RPMI 1640培养基中;HEK-293T细胞培养于含10%胎牛血清的DMEM培养基中。
1.2 主要试剂FN购自美国Sigma-Aldrich公司,Phospho-PYK2(Tyr402)抗体购自美国Cell Signaling Technology公司,PYK2抗体购自Santa Cruz Biotechnology公司,GAPDH抗体购自武汉Proteintech公司。Peroxidase AffiniPure Goat Anti-Rabbit IgG (H+L)及Peroxidase AffiniPure Goat Anti-Mouse IgG (H+L) 购自美国Jackson Immuno Research Laboratories公司,Trizol试剂购自美国Life Technologies公司,RevertAid第一链cDNA合成试剂盒购自美国Thermo Fisher Scientific公司。SuperReal PreMix(SYBR Green)试剂盒、miRcute miRNA 提取分离试剂盒、miRcute miRNA cDNA第一链合成试剂盒及miRcute Plus miRNA qPCR试剂盒购自北京天根生物公司。台盼蓝拒染试剂盒购自上海碧云天生物公司。FAK/PYK2激酶抑制剂PF-562271购自上海MedChemExpress公司,Dual-Glo荧光素酶系统购自美国Promega公司。
1.3 细胞黏附细胞培养板预先用50 μL FN(40 μg/mL)包被过夜,使用PBS洗涤2次,将DLBCL细胞轻轻重悬于无血清培养基中。随后将细胞接种于96孔板(每孔5×104个细胞)中,并在37 ℃ 5% CO2的培养箱中培养24 h。无血清培养基洗涤3次去除未黏附细胞。
1.4 慢病毒感染miR-185上调/下调慢病毒及PYK2过表达慢病毒购自上海吉凯基因公司,慢病毒感染严格按试剂盒说明书进行。
1.5 qPCR检测PTK2B mRNA分析:Trizol试剂分离总RNA后使用RevertAid First Strand cDNA Synthesis Kit将分离的RNA反转录为cDNA,使用SuperReal PreMix(SYBR Green)试剂盒进行扩增。miR-185分析:利用miRcute miRNA分离试剂盒分离RNA后,使用miRcute miRNA cDNA试剂盒将分离的RNA反转录为cDNA,使用miRcute miRNA qPCR试剂盒进行扩增。PTK2B引物序列:正向5′-GTCAGCCATGTTCTCAGCCT-3′;反向5′-ACTAGT CAGGACGCAAAGCC-3′;GAPDH引物序列:正向5′-TGACTTCAACAGCGACACCCA-3′;反向5′-CACCCT GTTGCTGTAGCCAAA-3′;miR-185引物序列:正向5′-ACACTCCAGCTGGGTGGAGAGAAAGGCAGT-3′;反向5′-TGGTGTCGTGGAGTCG-3′;U6引物序列:正向5′-CTCGCTTCGGCAGCACATATACT-3′;反向5′-ACGCTTCACGAATTTGCGTGTC-3′。
1.6 Western blot法收集细胞裂解后进行SDS-PAGE凝胶电泳实验,PVDF膜转印后用含5%脱脂奶粉的PBST封闭2 h。一抗4 ℃孵育过夜,PBST洗涤3次,二抗室温孵育2 h,PBST洗涤3次后ECL液显影。Phospho-PYK2(Tyr402)按1 ∶1 000比例稀释;PYK2按1 ∶500比例稀释;GAPDH按1 ∶5 000比例稀释;Peroxidase AffiniPure Goat Anti-Rabbit IgG (H+L)及Peroxidase AffiniPure Goat Anti-Mouse IgG (H+L) 均为1 ∶10 000比例稀释。
1.7 荧光素酶报告基因检测利用生物信息学方法预测miR-185与PTK2B的结合位点,将PTK2B 3′ UTR上的miR-185潜在结合位点克隆至GV272(SV40-firefly_Luciferase-MCS)载体中,构建野生型PTK2B 3′ UTR荧光素酶报告载体;将结合位点进行突变,构建结合位点突变型PTK2B 3′ UTR荧光素酶报告载体。将构建的3′ UTR载体与miR-185 mimics、Renilla 质粒共转染HEK-293T细胞转染48 h,收集细胞使用Dual-Glo荧光素酶系统检测萤火虫荧光素酶活性与海肾荧光素酶活性的比值。
1.8 台盼蓝拒染实验收集处理的细胞,用PBS洗涤2次,重悬于PBS中,将10 μL细胞悬液与10 μL 0.4%台盼蓝溶液混合1 min。使用血球计数板计数活细胞以及死亡细胞数目(死亡细胞被染成淡蓝色,活细胞为无色透明状),细胞死亡比例(%)=死亡细胞总数/(活细胞总数+死亡细胞总数)×100%。
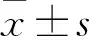
2 结果
2.1 DLBCL细胞与FN黏附对miR-185及PYK2表达的影响采用qPCR检测发现,OCI-Ly8与FN黏附培养组、悬浮培养组中miR-185的表达:(0.17±0.07)vs(1.01±0.11)(t=9.05,P<0.001);OCI-Ly10细胞与FN黏附培养组、悬浮培养组中miR-185表达:(0.35±0.15)vs(1.01±0.15)(t=4.50,P=0.011);提示OCI-Ly8及OCI-Ly10细胞与FN黏附培养可下调miR-185表达(图1A)。Western blot检测发现,OCI-Ly8及OCI-Ly10细胞与FN黏附培养可上调PYK2总蛋白及pPYK2(Tyr402)表达水平(图1B)。

图1 A. qPCR检测悬浮及黏附培养状态下miR-185的表达,*P<0.05,***P<0.001;B. Western blot法检测悬浮及黏附培养状态下PYK2总蛋白及pPYK2(Tyr402)的表达
2.2 miR-185对PYK2表达的影响Western blot法检测发现,在悬浮及FN黏附培养状态下,敲低miR-185可上调PYK2总蛋白及pPYK2(Tyr402)表达水平(图2A、B)。OCI-Ly8细胞悬浮培养状态Ctrl组与miR-185组中PTK2B mRNA的表达:(1.01±0.21)vs(0.95±0.36)(t=0.24,P=0.819);OCI-Ly8细胞黏附培养状态Ctrl组与miR-185组中PTK2B mRNA的表达:(1.33±0.10)vs(1.36±0.21)(t=0.23,P=0.833,图2C)。OCI-Ly10细胞悬浮培养状态Ctrl组与miR-185组中PTK2B mRNA的表达:(1.01±0.19)vs(0.98±0.16)(t=0.21,P=0.844);OCI-Ly10细胞黏附培养状态Ctrl组与miR-185组中PTK2B mRNA的表达:(1.31±0.10)vs(1.20±0.21)(t=0.79,P=0.472,图2D);提示过表达miR-185并不显著影响悬浮及FN黏附培养状态下PTK2B mRNA的表达水平。在HEK-293T细胞中过表达miR-185后,3′UTR空载体组与野生型PTK2B 3′UTR组的相对荧光素酶报告基因活性:(1.00±0.06)vs(0.49±0.04)(t=9.54,P<0.001);3′UTR空载体组与突变型PTK2B 3′UTR组的相对荧光素酶报告基因活性:(1.00±0.06)vs(0.94±0.06)(t=1.01,P=0.371);野生型PTK2B 3′UTR组与突变型PTK2B 3′UTR组的相对荧光素酶报告基因活性:(0.49±0.04)vs(0.94±0.06)(t=8.65,P<0.001);提示过表达miR-185可降低野生型PTK2B 3′UTR荧光素酶报告基因活性,但并不显著影响突变型PTK2B 3′UTR荧光素酶报告基因活性(图2E)。上述结果表明miR-185可靶向调节PYK2。
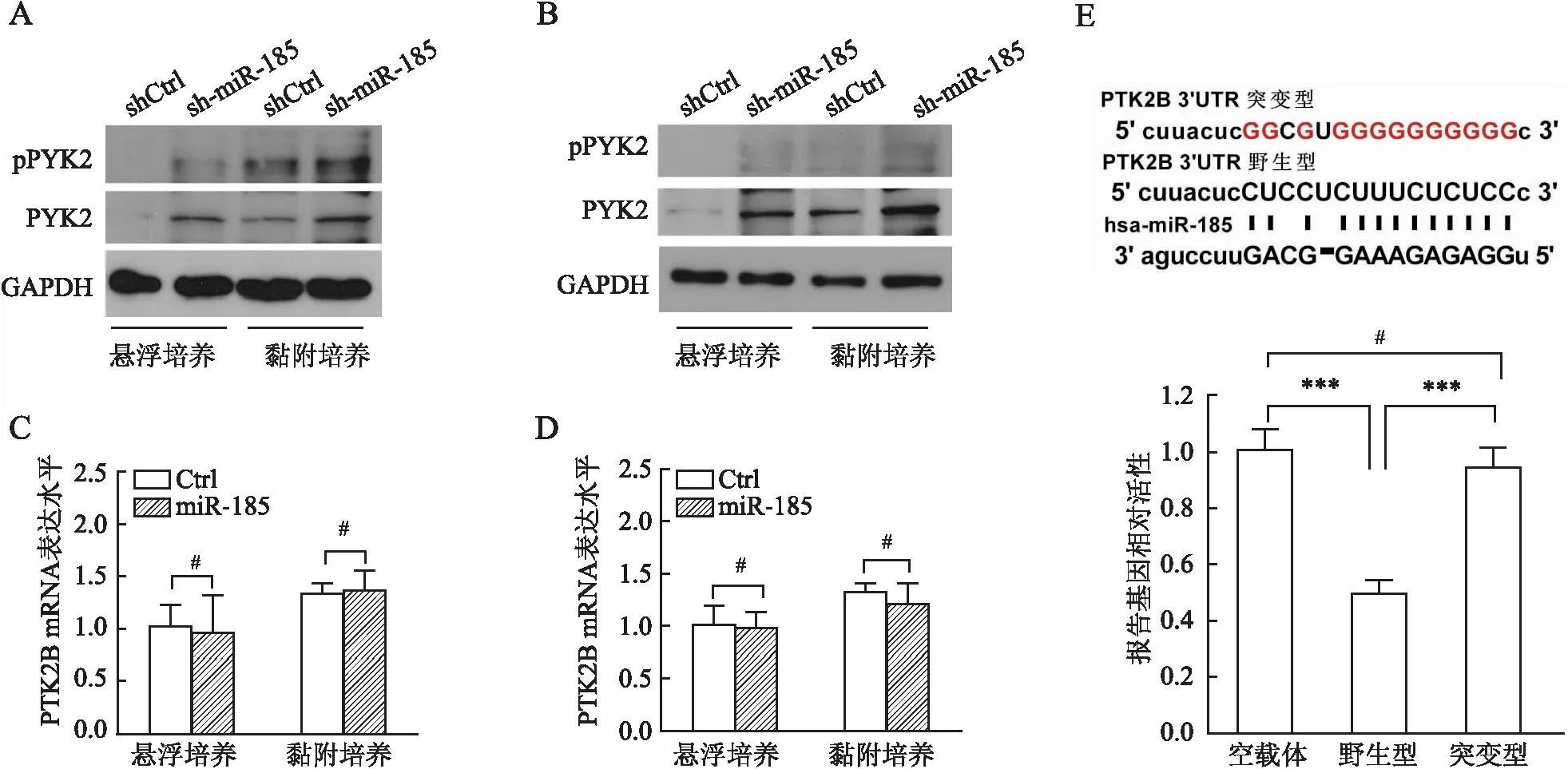
图2 miR-185对PYK2表达的影响:A. Western blot法检测OCI-Ly8细胞中PYK2总蛋白及pPYK2(Tyr402)表达水平:shCtrl.对照慢病毒;sh-miR-185.miR-185下调慢病毒; B. Western blot检测OCI-Ly10细胞中PYK2总蛋白及pPYK2(Tyr402)表达水平:shCtrl.对照慢病毒;sh-miR-185.miR-185下调慢病毒;C. qPCR检测OCI-Ly8细胞中PTK2B mRNA表达水平:Ctrl.对照慢病毒;miR-185.miR-185上调慢病毒;D. qPCR检测OCI-Ly10细胞中PTK2B mRNA表达水平:Ctrl.对照慢病毒;miR-185.miR-185上调慢病毒;E.荧光素酶报告基因实验分析miR-185对PTK2B 3′UTR活性的影响:空载体. 3′UTR空载质粒;野生型.野生型PTK2B 3′UTR报告基因质粒;突变型.突变型PTK2B 3′UTR报告基因质粒,***P<0.001,#P>0.05
2.3 miR-185、PYK2对DLBCL细胞CAM-DR的影响台盼蓝拒染实验显示,OCI-Ly8细胞悬浮培养状态下shCtrl+Doxo(多柔比星)组与sh-miR-185+Doxo组细胞死亡比例:(76.33±12.08)%vs(41.40±14.05)%(t=3.27,P=0.031)。OCI-Ly10细胞悬浮培养状态下shCtrl+Doxo组与sh-miR-185+Doxo组细胞死亡比例:(69.90±6.61)%vs(43.77±8.19)%(t=4.30,P=0.013)。OCI-Ly8细胞黏附培养状态下shCtrl+Doxo组与sh-miR-185+Doxo组细胞死亡比例:(39.43±3.94)%vs(26.93±6.25)%(t=2.93,P=0.043)。OCI-Ly10细胞黏附培养状态下shCtrl+Doxo组与sh-miR-185+Doxo组细胞死亡比例:(43.67±9.66)%vs(16.10±3.42)%(t=4.66,P=0.009,)。结果显示,在OCI-Ly8及OCI-Ly10细胞中敲低miR-185可抑制悬浮及黏附培养状态下Doxo诱导的细胞死亡(图3A、B)。OCI-Ly8细胞悬浮培养状态下Ctrl+Doxo组与PYK2+Doxo组细胞死亡比例:(58.73±8.55)%vs(39.97±3.19)%(t=3.56,P=0.024)。OCI-Ly10细胞悬浮培养状态下Ctrl+Doxo组与PYK2+Doxo组细胞死亡比例:(59.33±8.73)%vs(33.30±6.50)%(t=4.14,P=0.014)。OCI-Ly8细胞黏附培养状态下Ctrl+Doxo组与PYK2+Doxo组细胞死亡比例:(37.70±7.64)%vs(20.07±7.59)%(t=2.84,P=0.047)。OCI-Ly10细胞黏附培养状态下Ctrl+Doxo组与PYK2+Doxo组细胞死亡比例:(34.00±5.46)%vs(14.37±3.46)%(t=5.26,P=0.006)。结果显示,过表达PYK2可抑制悬浮及黏附培养状态下Doxo诱导的细胞死亡(图3C、D)。上述结果表明,细胞黏附介导的miR-185下调和PYK2表达增加,可促进CAM-DR。
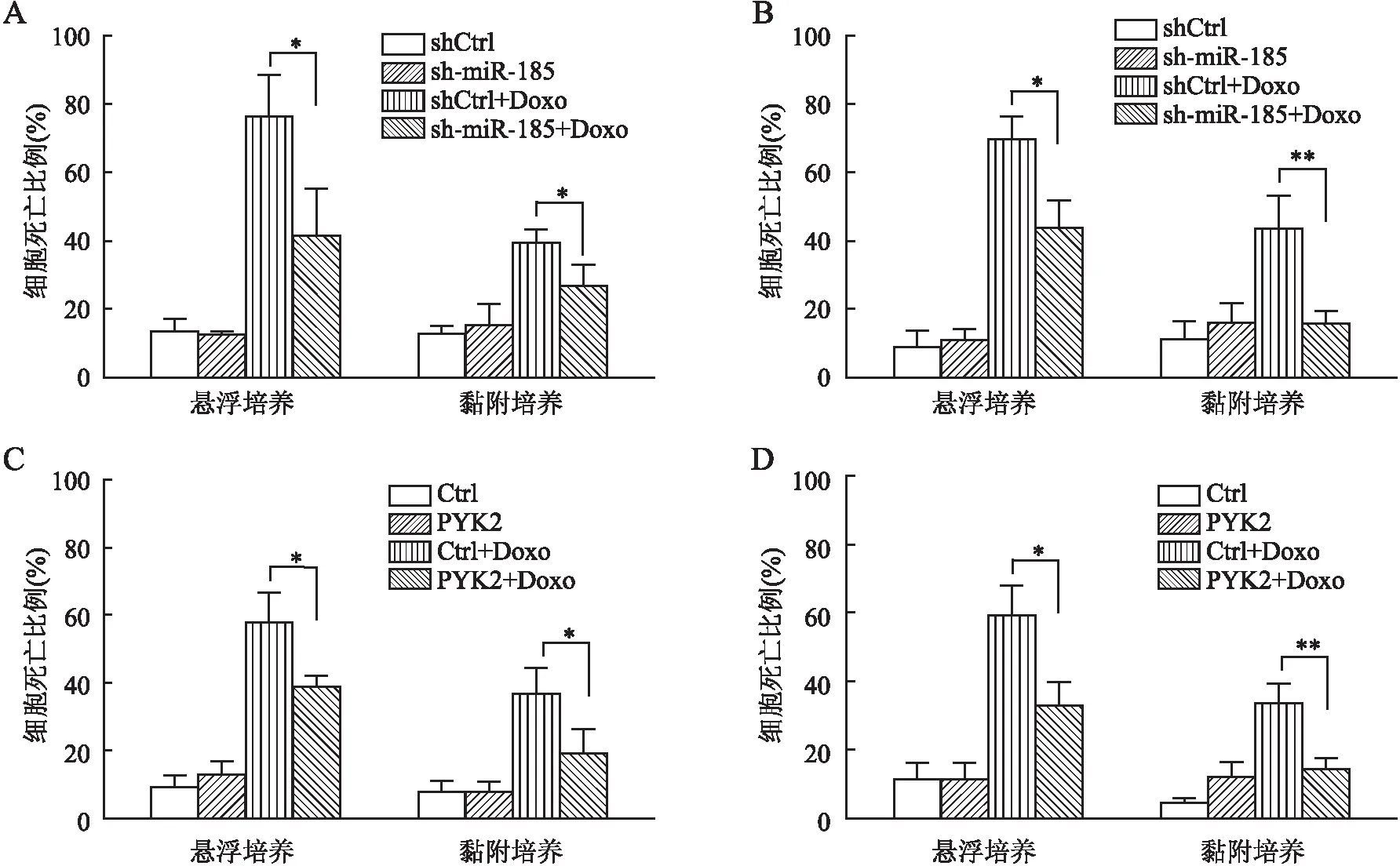
图3 miR-185、PYK2对DLBCL细胞CAM-DR的影响:A.台盼蓝拒染实验检测敲低miR-185对OCI-Ly8细胞CAM-DR的影响:shCtrl.对照慢病毒;sh-miR-185.miR-185下调慢病毒;shCtrl+Doxo.对照慢病毒+1.0 μmol/L多柔比星;sh-miR-185+Doxo.miR-185下调慢病毒+1.0 μmol/L多柔比星;B.台盼蓝拒染实验检测敲低miR-185对OCI-Ly10细胞CAM-DR的影响:shCtrl.对照慢病毒;sh-miR-185.miR-185下调慢病毒;shCtrl+Doxo.对照慢病毒+1.0 μmol/L多柔比星;sh-miR-185+Doxo.miR-185下调慢病毒+1.0 μmol/L多柔比星;C.台盼蓝拒染实验检测过表达PYK2对OCI-Ly8细胞CAM-DR的影响:Ctrl.对照慢病毒;PYK2. PYK2过表达慢病毒;Ctrl+Doxo.对照慢病毒+1.0 μmol/L多柔比星;PYK2+Doxo.PYK2过表达慢病毒+1.0 μmol/L多柔比星;D.台盼蓝拒染实验检测过表达PYK2对OCI-Ly10细胞CAM-DR的影响:Ctrl.对照慢病毒;PYK2. PYK2过表达慢病毒;Ctrl+Doxo.对照慢病毒+1.0 μmol/L多柔比星;PYK2+Doxo.PYK2过表达慢病毒+1.0 μmol/L多柔比星;*P<0.05,**P<0.01
2.4 PF-562271对DLBCL细胞CAM-DR的影响台盼蓝拒染实验显示,OCI-Ly8细胞悬浮培养状态下shCtrl+Doxo组与sh-miR-185+Doxo组细胞死亡比例:(54.03±5.21)%vs(40.33±3.15)%(t=3.90,P=0.018);OCI-Ly10细胞悬浮培养状态下shCtrl+Doxo组与sh-miR-185+Doxo组细胞死亡比例:(60.87±6.26)%vs(39.70±5.12)%(t=4.53,P=0.011)。OCI-Ly8细胞悬浮培养状态下sh-miR-185+Doxo组与sh-miR-185+Doxo+PF-562271组细胞死亡比例:(40.33±3.15)%vs(58.13±5.59)%(t=4.81,P=0.009);OCI-Ly10细胞悬浮培养状态下sh-miR-185+Doxo组与sh-miR-185+Doxo+PF-562271组细胞死亡比例:(39.70±5.12)%vs(55.07±7.43)%(t=2.95,P=0.042)。OCI-Ly8细胞黏附培养状态下shCtrl+Doxo组与sh-miR-185+Doxo组细胞死亡比例:(34.37±3.72)%vs(25.03±3.30)%(t=3.25,P=0.031);OCI-Ly10细胞黏附培养状态下shCtrl+Doxo组与sh-miR-185+Doxo组细胞死亡比例:(40.50±3.63)%vs(27.50±6.52)%(t=3.02,P=0.039)。OCI-Ly8细胞黏附培养状态下sh-miR-185+Doxo组与sh-miR-185+Doxo+PF-562271组细胞死亡比例:(25.03±3.30)%vs(39.37±5.06)%(t=4.11,P=0.015);OCI-Ly10细胞黏附培养状态下sh-miR-185+Doxo组与sh-miR-185+Doxo+PF-562271组细胞死亡比例:(27.50±6.52)%vs(47.53±9.43)%(t=3.03,P=0.039)。结果显示,FAK/PYK2双重抑制剂PF-562271可显著增加悬浮及黏附培养状态下Doxo诱导的细胞死亡(图4A、B)。上述研究结果提示PF-562271可抑制miR-185下调介导的CAM-DR表型。在DLBCL中miR-185下调,可能通过介导PYK2 表达增加来促进CAM-DR。
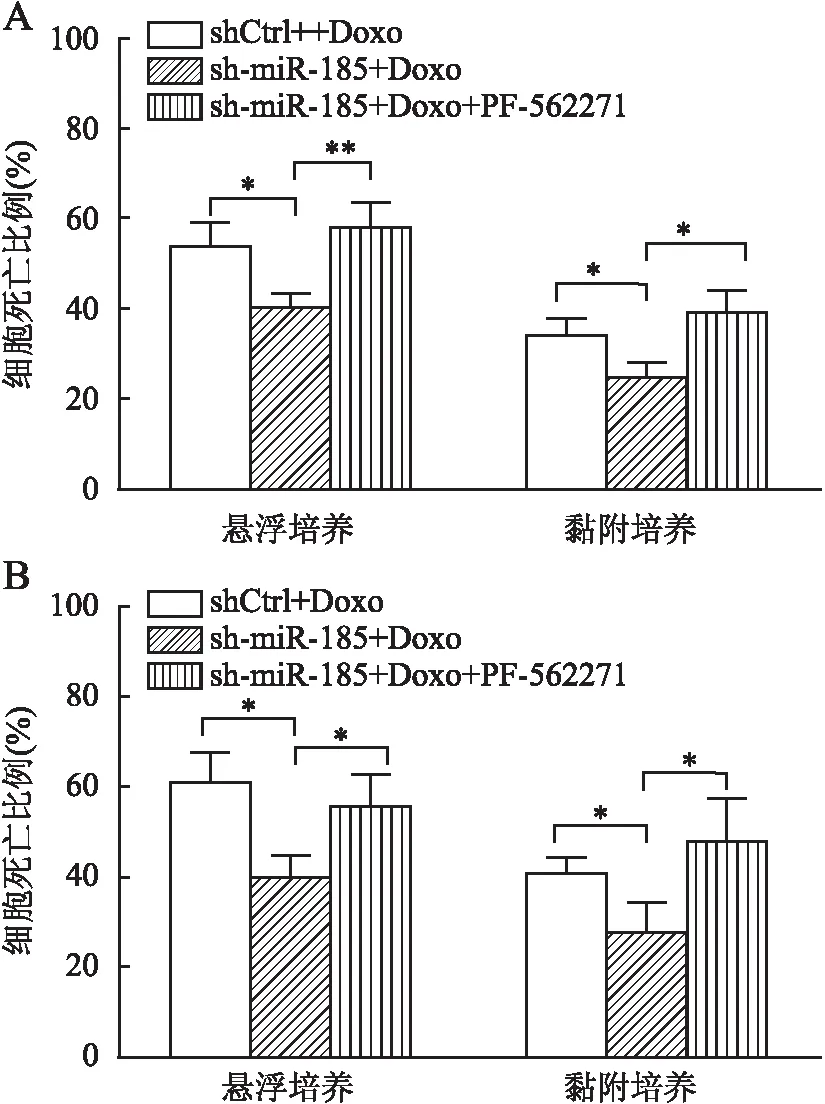
图4 台盼蓝拒染实验检测PF-562271对DLBCL细胞CAM-DR的影响:A.OCI-Ly8细胞;B. OCI-Ly10细胞;shCtrl+Doxo.对照慢病毒+1.0 μmol/L多柔比星;sh-miR-185+Doxo.miR-185下调慢病毒+1.0 μmol/L多柔比星;sh-miR-185+Doxo+PF-562271.miR-185下调慢病毒+1.0 μmol/L多柔比星+4.0 μmol/L PF-562271;*P<0.05,**P<0.01
3 讨论
miR-185表达异常与多种造血和非造血系统恶性肿瘤的发生、发展有关。Ni等[8]报道,miR-185在胶质瘤中下调,敲低miR-185可增强U251和U87细胞的迁移能力,并显著抑制细胞凋亡。此外,有研究发现miR-185在结直肠癌中的表达低于正常肠黏膜组织;miR-185低表达与结直肠癌转移相关。 miR-185可通过靶向树突状细胞特异C型凝集素DC-SIGN降低MMP-9和VEGF的表达。miR-185/DC-SIGN通过使PI3K/Akt/GSK-3β信号通路失活抑制β-catenin的核转位[9]。Afshar等[10]报道,上调miR-185的表达可增强结直肠癌细胞的放疗敏感性。Wang等[11]研究发现,过表达miR-185可抑制A549和H460肺癌细胞的增殖和转移,并促进肿瘤细胞凋亡。在肺鳞癌H520细胞中,过表达miR-185可以部分逆转lncRNA PART1(prostate androgen regulated transcript 1)对细胞的增殖、迁移、侵袭和凋亡影响[12]。现已证实,miR-185在调节肿瘤耐药中发挥重要作用。过表达miR-185可增强胃癌细胞对低剂量化疗药物的敏感性;而敲低miR-185可降低大剂量化疗诱导的细胞凋亡[13]。最新一项研究报道,在TKI治疗无反应的慢性粒细胞白血病干细胞/祖细胞中过表达miR-185可以下调PAK6的表达,进而抑制细胞存活并增强TKI的敏感性[5]。本组结果显示,与悬浮培养相比,OCI-Ly8及OCI-Ly10细胞与FN黏附培养可显著下调miR-185的表达水平,细胞黏附介导的miR-185下调可促进CAM-DR。
PYK2属于FAK激酶家族,在调控细胞生长、存活、迁移和侵袭中发挥重要作用[14]。文献报道,PYK2在多种肿瘤如乳腺癌、肝细胞癌、肺癌、白血病、结肠癌、卵巢癌中表达增加[15]。PYK2表达异常与多种肿瘤的增殖相关,如三阴型乳腺癌[16]、多发性骨髓瘤[6]、小细胞肺癌[17]。有研究报道,PYK2在调控肿瘤耐药中发挥关键作用。Verma等[16]报道,在三阴型乳腺癌中,敲低PYK2可通过抑制HER-3上调,继而抑制HER-3相关耐药。Meads等[6]研究发现,在多发性骨髓瘤中肿瘤细胞与FN黏附可引起PYK2磷酸化,继而促进STAT3磷酸化;在骨髓微环境中,靶向PYK2可诱导肿瘤细胞的死亡,并抑制肿瘤细胞的生长。本组实验发现,OCI-Ly8及OCI-Ly10细胞与FN黏附可上调PYK2总蛋白及pPYK2(Tyr402)表达水平。PYK2上调可促进CAM-DR。此外,实验还发现PF-562271可显著增加悬浮及黏附培养状态下Doxo诱导的OCI-Ly8和OCI-Ly10细胞死亡,抑制miR-185下调介导的CAM-DR表型。
综上所述,本实验发现DLBCL细胞与FN黏附培养可下调miR-185表达,并上调PYK2总蛋白及pPYK2(Tyr402)表达水平。在DLBCL中miR-185可靶向抑制PYK2,细胞黏附介导的miR-185下调,可能通过诱导PYK2表达增加促进CAM-DR。FAK/PYK2双重抑制剂PF-562271,可抑制miR-185下调介导的CAM-DR表型。本实验仅通过体外实验初步分析miR-185和PYK2在DLBCL CAM-DR中的作用,体内实验中两者是否影响DLBCL耐药仍有待进一步验证。因此,深入探讨miR-185和PYK2在DLBCL中的作用及分子机制,可为后续逆转肿瘤细胞耐药的研究提供实验数据。

