脓毒症患者TAT、TM、PIC和t-PAIC水平与病情程度的关系
曾镇桦,高海闽,黄绍生,陈贵平,吴阿阳,韩贤良
脓毒症属于致病微生物感染导致的全身炎性反应综合征,具有发病率高、病死率高的特征,也是导致重症医学科患者死亡的重要原因之一。脓毒症发病的主要因素是人体免疫功能紊乱,同时体内炎性介质失衡,随着病情进展患者微血管系统损伤,凝血机制异常,容易形成微循环障碍,影响患者预后[1]。近年来研究发现,血浆凝血酶抗凝酶复合物(TAT)、血栓调节蛋白(TM)、纤溶酶—抗纤溶酶复合物(PIC)和组织型纤溶酶原激活抑制复合物(t-PAIC)已成为新一代的凝血机制诊断因子,同传统的生物学分子标志物相比更具有诊断价值,但是在脓毒症患者体内变化的研究较少[2]。现分析凝血机制诊断因子在脓毒症患者体内水平及其与患者病情严重程度的关系,以期为临床提供指导和依据,报道如下。
1 资料与方法
1.1 临床资料 选取2018年1月—2020年3月福建省漳州市医院感染科治疗脓毒症患者82例,其中男51例,女31例,年龄23~72(55.40±8.20)岁;感染部位:呼吸系统50例,消化系统22例,泌尿系统10例;均无家族遗传疾病史。按照患者28 d预后情况,分成生存组(n=59)和死亡组(n=23)。本研究经医院伦理委员会审核批准(漳伦审字2021LWB059号),患者或家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①诊断符合“中国脓毒症/脓毒性休克急诊治疗指南(2018)”[3]中相关标准;②年龄>18岁;③诊断脓毒症至转入ICU时间<6 h 。(2)排除标准:①慢性肝功能不全、恶性肿瘤、先天性凝血功能障碍者;②服用影响凝血功能及血小板减少药物者;③有精神疾病者;④妊娠期或哺乳期妇女。
1.3 观测指标与方法
1.3.1 凝血机制诊断因子检测:患者入院后2 h内,以枸橼酸抗凝真空负压管采集患者静脉血10 ml,以4℃条件下离心分离血浆,在-20℃冰箱保存待检,如果样本检测超过24 h,需保存于-80℃环境,防止反复样本冻融。采用自动化学发光免疫分析仪(希森美康公司生产,型号 HISCL-800),以发光强度进行电化学发光酶免疫测定TAT、TM、PIC和t-PAIC,按照ROC曲线计算各标志物浓度。健康人群正常参考范围:TAT<4 ng/ml,TM 3.8~13.3 U/ml,PIC <0.8 μg/ml,t-PAIC 男性<17 ng/ml、女性 <10.5 ng/ml。
1.3.2 凝血指标检测:上述血浆5 ml采用全自动血凝分析仪(Werfen公司生产,型号 ACL-TOP700)以凝固法检测活化凝血酶时间(APTT)、纤维蛋白原(Fib)、凝血酶时间(TT)、凝血酶原时间(PT);免疫比浊法检测纤维蛋白降解物(FDP)、D二聚体(DD)。
2 结 果
2.1 2组临床资料比较 2组患者在性别、体质量指数、感染部位、休克发生率、血红蛋白及红细胞计数比较差异无统计学意义(P>0.05);死亡组患者年龄、APACHEⅡ评分、弥散性血管内凝血比例、SOFA评分及乳酸水平均高于生存组(P<0.05),见表1。
表1 2组脓毒症患者临床资料比较
2.2 2组血浆TAT、TM、PIC和t-PAIC比较 死亡组患者血浆TAT、TM、PIC和t-PAIC水平均高于生存组(P<0.05),见表2。
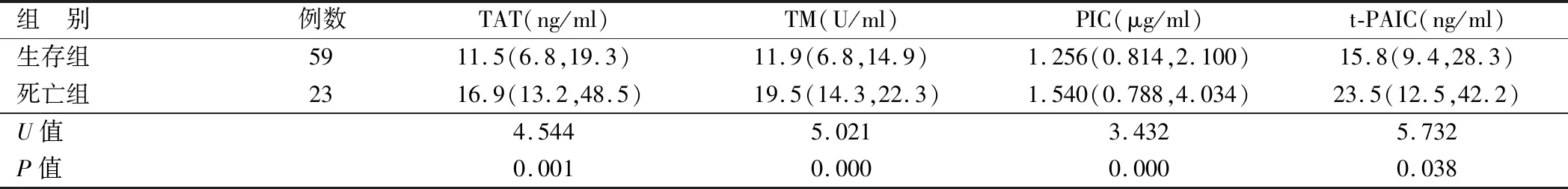
表2 2组脓毒症患者血浆TAT、TM、PIC和t-PAIC水平比较 [M(Q1,Q3)]
2.3 2组凝血功能比较 2组APTT、Fib、TT及PLT水平比较差异均无统计学意义(P>0.05);死亡组的PT、FDP、DD高于生存组(P<0.05),见表3。

表3 2组脓毒症患者凝血功能比较
2.4 血浆TAT、TM、PIC和t-PAIC水平判断脓毒症预后的价值 绘制血浆TAT、TM、PIC和t-PAIC受试者ROC工作曲线预测28 d死亡价值,并计算 AUC分别为0.746、0.701、0.522和0.720。截断值分别为37.50 ng/ml、31.50 U/ml、3.80 μg/ml和28.50 ng/ml,敏感度分别为0.614、0.550、0.520和0.570,特异度分别为0.850、0.760、0.650和0.800,而四者联合检测的AUC优于各自单独者的预测价值(z=3.011、3.833、5.832、0.283,P均=0.000),见图1、表4。
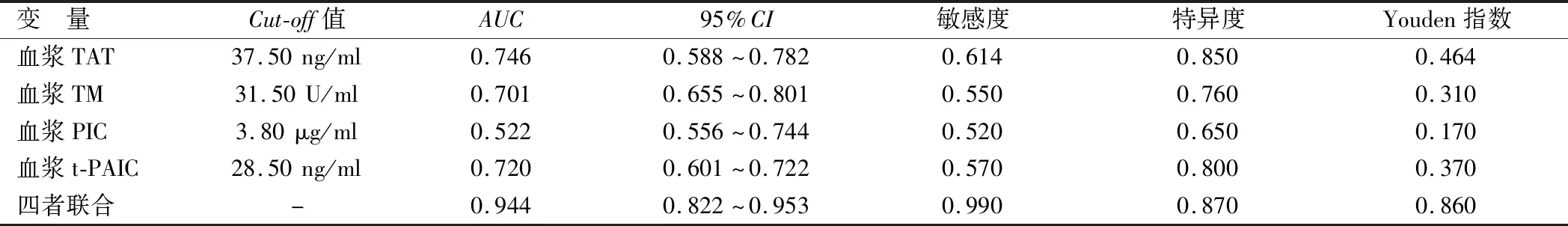
表4 血浆TAT、TM、PIC和t-PAIC水平判断脓毒症预后价值比较
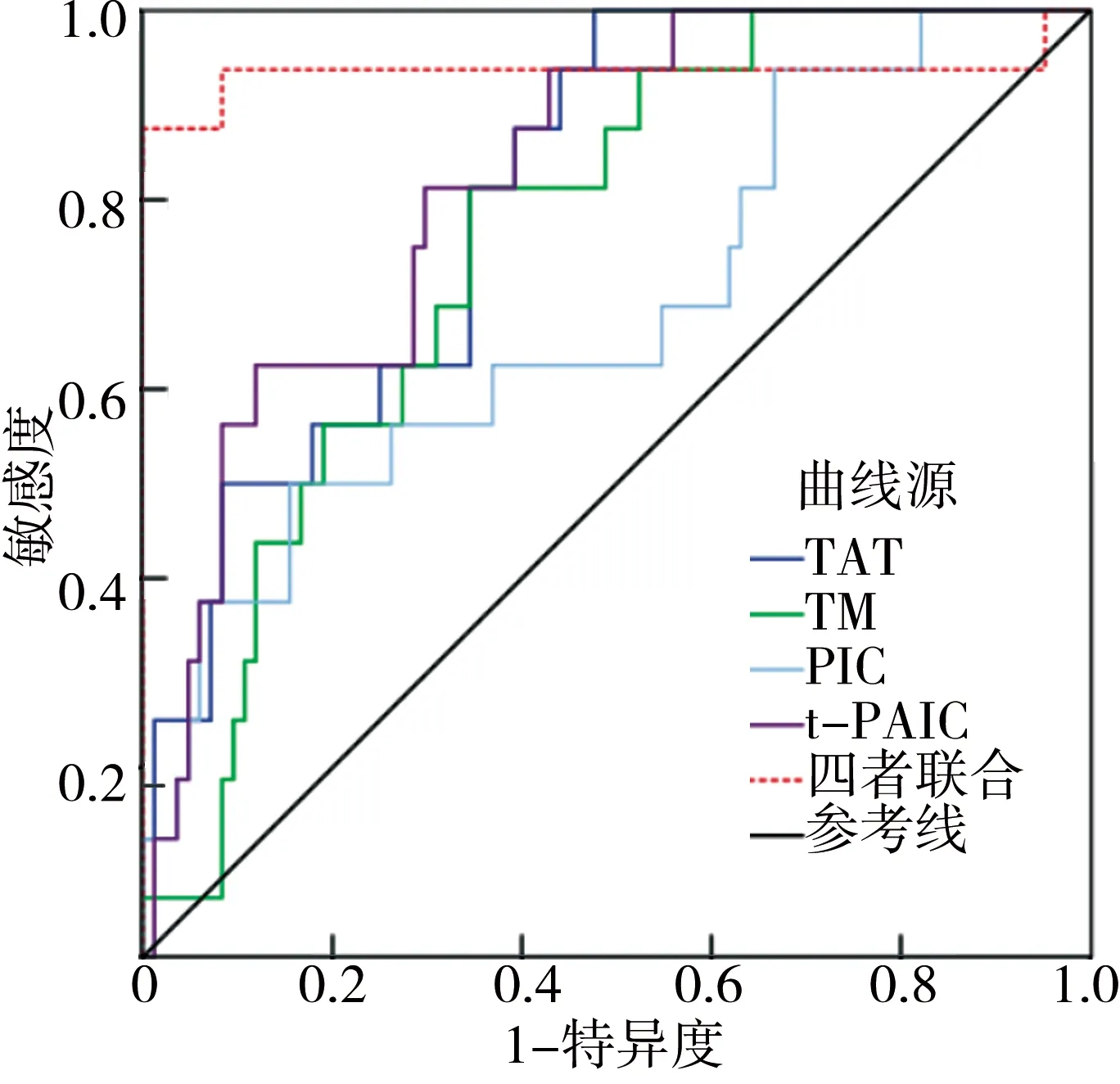
图1 血浆TAT、TM、PIC和t-PAIC水平判断脓毒症预后的ROC曲线
3 讨 论
脓毒症是由各种病原菌或者毒素在人体血液中引发的全身炎性反应综合征,患者临床多出现器官功能障碍综合征、脓毒性休克及多脏器功能衰竭,危及患者生命安全[4]。有研究发现[5-6],脓毒症患者体内大量炎性因子释放增多会造成血管内皮细胞损伤,内毒素、白介素、肿瘤坏死因子等物质表达上调,体内外源性凝血系统被激活,而且消耗了大量的抗凝血因子,人体处在持续的高凝状态,严重时会造成疾病进展为弥散性血管内凝血,患者预后变差[7-8]。本研究结果显示,入院后,死亡组APACHEⅡ评分、SOFA评分、弥散性血管内凝血比例及乳酸水平均高于生存组,提示死亡组患者入院时病情严重程度已高于生存组患者。此外,死亡组虽然在DD、FDP水平表现异常,但由于DD、FDP敏感度较高,特异度较低,因此作为凝血异常判断指标的作用并不明显。
生物学指标对于早期诊断脓毒症疾病有着重要意义,但是选取哪种指标及是否存在足够的敏感度与特异度临床报道不一[9-10]。TAT属于凝血酶与抗凝血酶Ⅲ形成的复合物,在正常人体中含有极少量的凝血酶,一旦形成会被抗凝血中和形成TAT,TAT降解一般是与肝细胞表面特异受体结合而被清除,通过血管内皮细胞被降解[11]。有学者研究发现,血浆TAT水平升高是凝血酶形成过多及其抑制剂抗凝血酶Ⅲ消耗所致,TAT升高程度能够帮助判断疾病严重程度[12]。有临床研究发现[13],脓毒症患者发生DIC后血浆TAT水平较未发生DIC患者升高,联合血浆纤溶酶原激活物抑制剂-1(PAI-1)和PT可以提高诊断脓毒症DIC的效能,提示可以用血浆TAT持续升高水平预测脓毒症DIC患者不良预后。TM属于内皮细胞表面凝血酶膜受体,可同凝血酶结合激活蛋白C起到抗凝作用,一旦血管内皮损伤后内皮细胞表面TM就会遭到水解进入血液,导致血浆中水平升高,近年来认为,TM属于血管内皮损伤敏感性与特异性标志物,但是并不能作为单一的预测因子[14]。PIC属于纤溶酶和α2抗纤溶酶相结合的复合物,反映了人体纤溶酶状况,能够对人体纤溶激活的程度进行评价[15]。脓毒症患者体内炎性反应强烈,随着病情进展内皮细胞成为内毒素靶细胞,释放氧自由基和溶媒导致内皮细胞发生损伤,通过单核细胞与内皮细胞表达并释放出组织因子,刺激人体形成大量的炎性因子与细胞因子,导致体内组织因子表达,抑制了抗凝物质发生活化性抑制纤溶过程[16]。当内皮细胞发生损伤,组织型纤溶酶原激活剂进入血液,在肝脏将释放至血液的纤溶酶原变为纤溶酶,血液中的组织型纤溶酶原激活剂同生理性抑制因子结合形成了组织型纤溶酶原激活抑制复合物,因此其升高表示了内皮细胞出现损伤[17]。本研究结果显示,死亡组血浆TAT、TM、PIC、t-PAIC水平明显高于生存组,提示随着病情加重,体内凝血功能异常越为严重。绘制ROC曲线分析发现,四者联合预测28 d死亡的敏感度、特异度分别为0.990和0.870,提示通过上述指标联合检测,对于预测患者预后具有较高的价值。
综上所述,脓毒症患者血浆TAT、TM、PIC和t-PAIC水平升高,对于判断脓毒症患者病情严重程度有着重要的作用,尤其在预测患者28 d死亡方面,具有一定的参考价值。但是,由于入组患者数量有限,而且未能进行动态监测,还需要进一步深入论证分析。
利益冲突:所有作者声明无利益冲突
作者贡献声明
曾镇桦:设计研究方案,实施研究过程,论文撰写;高海闽:论文修改;黄绍生:实施研究过程,分析试验数据;陈贵平:资料搜集整理,论文修改;吴阿阳:提出研究思路,分析试验数据,论文审核,进行统计学分析;韩贤良:课题设计,规划等

