血清IL-6、SDF-1水平与急性脑梗死患者rt-PA静脉溶栓治疗短期预后的相关性
晏立娜,李佳艳,陈奕菲,聂曦明
重组组织型纤溶酶原激活物(recombinant tissue plasminogen activator,rt-PA)静脉溶栓是治疗急性脑梗死(acute cerebral infarction,ACI)的有效方法,可恢复脑梗死区域的血液供应,减轻脑缺血程度,减少脑细胞死亡及功能损害,在治疗ACI中获得满意的效果[1]。ACI致残致死率较高,尽管ACI患者在接受rt-PA静脉溶栓治疗可获得满意的效果,但仍有部分患者在治疗后短期内预后不良[2]。因此,寻找可预测ACI患者rt-PA静脉溶栓治疗短期预后的相关指标十分必要。文献指出,缺血损伤、炎性反应是ACI疾病进展的重要原因,其中炎性介质可激活脑血管内皮细胞,促进白细胞释放促炎介质,如趋化因子、细胞因子等,可加重神经元损伤[3]。基质细胞衍生因子-1(stromal cell derived factor-1,SDF-1)是一类细胞因子,可调控多种生物学过程,包括血管形成、炎性反应、神经发育等[4]。研究指出,在脑组织出现缺血损伤时血清SDF-1水平显著升高[5]。白介素-6(interleukin-6,IL-6)作为一种细胞因子,其主要成分为多肽,当脑组织受伤时大量分泌IL-6,是参与免疫调节和炎性反应的重要细胞因子之一[6]。由此,猜测血清IL-6、SDF-1水平可能与ACI患者rt-PA静脉溶栓治疗短期预后有关。基于此,现分析血清IL-6、SDF-1水平与ACI患者rt-PA静脉溶栓治疗短期预后的关系,报道如下。
1 资料与方法
1.1 临床资料 选取2019年1月—2021年1月北京市平谷区医院神经内科接受rt-PA静脉溶栓治疗的ACI患者128例,治疗3个月时,评估预后情况,根据改良Rankin量表(modified Rankin scale,mRS)评分结果分为不良组42例(mRS评分>2分)与良好组86例(mRS评分≤2分)。不良组NIHSS评分高于良好组(P<0.01),2组性别、年龄、发病至溶栓时间、大面积脑梗死、合并高血压、合并糖尿病、心房颤动、梗死部位、Killip分级比较差异均无统计学意义(P>0.05),见表1。本研究经医院医学伦理委员会审核通过(伦申字第201811号),患者家属均知情同意并签署知情同意书。
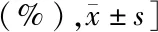
表1 不良组与良好组ACI患者临床资料比较 [例
1.2 病例选择标准 (1)纳入标准:①符合关于ACI的诊断标准[7];②首发脑梗死;③发病至溶栓时间<4.5 h。(2)排除标准:①合并精神疾病;②合并恶性肿瘤;③存在全身感染性疾病;④合并癫痫;⑤近2个月使用过促红细胞生成素或他汀类药物;⑥肝肾功能或凝血功能异常。
1.3 观测指标与方法
1.3.1 预后评估:治疗3个月时,评估患者预后,采用改良Rankin量表(mRS)[8]评分,Cronbach's α系数为0.810,各维度相关系数为0.740~0.890,其中病死6分,重度残疾5分,中重度残疾4分,生活需他人帮助3分,需部分帮助/中度残疾2分,轻度残疾/无法照料自身日常1分,可完成日常工作、生活/完全无症状0分。其中mRS评分≤2分为预后良好组,>2分则纳入不良组。
1.3.2 血清IL-6、SDF-1水平检测:患者入院时取肘静脉血3 ml,离心分离上层血清,采用酶联免疫吸附法测定血清IL-6、SDF-1水平。

2 结 果
2.1 预后情况 128例ACI患者接受rt-PA静脉溶栓治疗3个月时,mRS评分0分5例,1分38例,2分43例,纳入良好组(86例);mRS评分3分24例,4分12例,5分6例,纳入不良组(42例)。
2.2 2组血清IL-6、SDF-1水平比较 不良组血清IL-6、SDF-1水平均高于良好组[(5.38±1.53)pg/ml vs.(3.29±0.95)pg/ml,(83.35±10.73)μg/L vs.(74.53±12.69)μg/L],差异均有统计学意义(t=9.484、3.876,P均<0.001)。
2.3 ACI患者接受rt-PA静脉溶栓治疗短期预后影响因素的Logistic回归分析 将ACI患者rt-PA静脉溶栓治疗短期预后情况作为因变量(1=不良,0=良好),将上述结果中差异有统计学意义的变量作为自变量,建立多元回归模型,结果显示,NIHSS评分高,治疗前血清IL-6、SDF-1高表达可能是ACI患者接受rt-PA静脉溶栓治疗短期预后不良的风险因子(OR>1,P<0.05),见表2。

表2 ACI患者接受rt-PA静脉溶栓治疗短期预后影响因素的Logistic回归分析
2.4 血清IL-6、SDF-1水平预测ACI患者接受rt-PA静脉溶栓治疗短期预后不良风险价值 将ACI患者接受rt-PA静脉溶栓治疗短期预后情况作为状态变量(1=不良,0=良好),将治疗前血清IL-6、SDF-1水平作为检验变量,绘制ROC曲线结果显示,治疗前血清IL-6、SDF-1水平预测ACI患者接受rt-PA静脉溶栓治疗短期预后不良风险的AUC均>0.80,预测价值均较良好,见图1、表3。

表3 血清IL-6、SDF-1水平预测ACI患者接受rt-PA静脉溶栓治疗短期预后不良风险价值
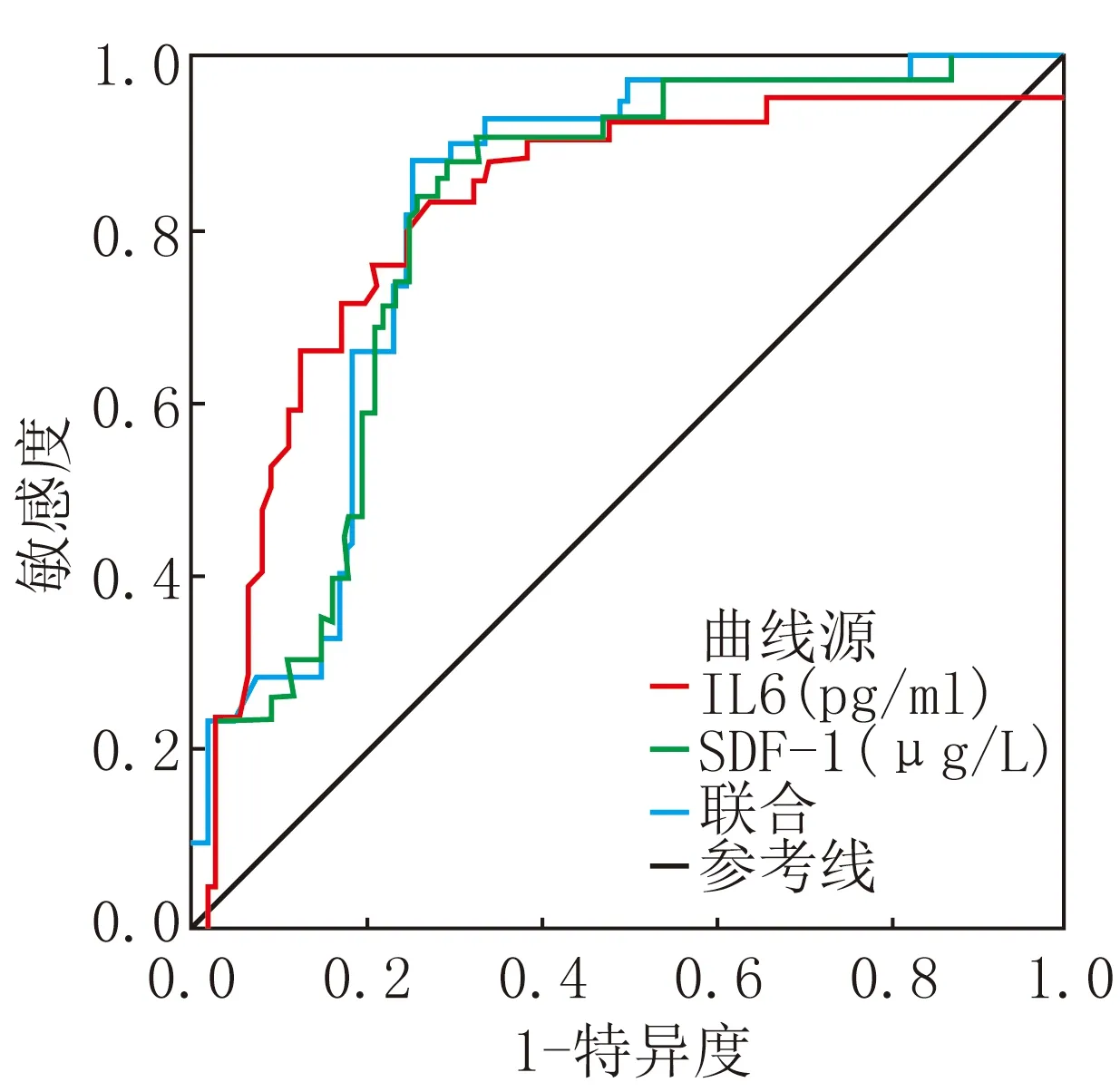
图1 血清IL-6、SDF-1水平预测ACI患者接受rt-PA静脉溶栓治疗短期预后不良风险价值的ROC曲线
3 讨 论
ACI经rt-PA静脉溶栓治疗后可溶解血栓,恢复血供,使脑组织损伤减少,对患者的脑功能恢复有利,但仍有部分ACI患者经rt-PA静脉溶栓治疗后短期内病死,或即使幸存也伴有不同程度的功能障碍,给家庭和社会造成严重的负担[9]。李佳艳等[10]对39例ACI患者进行观察,结果39例患者在接受溶栓治疗后有21例患者预后不良,占53.85%。而本研究结果显示,128例ACI患者经rt-PA静脉溶栓治疗3个月时,预后不良42例,占32.81%(42/128),较上述研究结果低,但仍说明ACI患者经rt-PA静脉溶栓治疗短期内有较高的预后不良风险。因此,寻找ACI经rt-PA静脉溶栓治疗短期预后不良的预测指标,对治疗方案的合理调整,改善患者预后十分必要。NIHSS评分是评估ACI患者神经缺损情况的指标,研究指出,NIHSS评分越高表示ACI患者的神经功能缺失症状越明显,且一般为大血管病变,梗死面积较大,易出现梗死后并发症,预后较差[11-13]。本次研究中也证实了NIHSS评分高是ACI患者接受rt-PA静脉溶栓治疗短期预后不良的危险因子。但因NIHSS评分具有一定的主观性,易受医生主观判断产生偏倚,在临床应用受限[14-15]。
研究指出,炎性反应、缺血损伤是ACI病情进展的重要原因[16-18]。作为免疫应答、炎性反应的调节因子,IL-6可促进巨噬细胞表面LDL受体合成、巨噬细胞对LDL的摄取,使其加速直至沉积,利于粥样斑块的形成[19]。SDF-1是趋化因子家族成员之一,表达于大脑、内皮细胞、外周血干细胞、心脏等体内多种细胞和组织中,在机体血管内皮发生损伤、血小板活化时,SDF-1表达会上调[20]。研究发现,在ACI后中枢神经系统损伤中SDF-1起到一定的修复作用[21]。并有研究指出,SDF-1可促进血管生成,迅速动员内皮前体细胞和造血干细胞,改善脑损伤[22]。基于IL-6与SDF-1在ACI中的作用机制,猜测二者可能与ACI患者rt-PA静脉溶栓治疗短期预后有关。本研究通过比较不良组与良好组患者的血清IL-6、SDF-1水平,说明血清IL-6、SDF-1的异常过表达可能与ACI患者rt-PA静脉溶栓治疗短期预后不良有关。分析可能的原因:ACI患者溶栓前IL-6过表达可诱导肝细胞产生血浆纤溶酶原激活物抑制物,影响凝血/纤溶功能及rt-PA静脉溶栓治疗效果;同时IL-6过表达可调节黏附分子及其他细胞因子如IL-1、TNF-α表达,促进炎性反应,加重患者的病情,进一步影响rt-PA静脉溶栓治疗效果,增加预后不良风险[23]。SDF-1可与其特异性受体趋化因子4结合,形成SDF-1—趋化因子4生物学轴,诱导炎性因子到达缺血损伤区域,加重该区域的组织损伤,影响rt-PA静脉溶栓治疗效果,增加短期内预后不良风险[24]。
本研究作Logistic回归分析并绘制ROC曲线,进一步证实血清IL-6、SDF-1水平与ACI患者rt-PA静脉溶栓治疗短期预后有关,早期测定二者水平可用于ACI患者rt-PA静脉溶栓治疗短期预后不良的预测。对此,为未来ACI患者rt-PA静脉溶栓治疗提出建议,在ACI患者rt-PA静脉溶栓治疗前可重点监测血清IL-6、SDF-1水平,若二者异常表达,提示短期预后不良高风险,可采取积极的抗炎措施,以改善患者的预后。
综上所述,ACI患者rt-PA静脉溶栓治疗前血清IL-6、SDF-1过表达与溶栓治疗后短期预后不良有关,尽早检测ACI患者血清IL-6、SDF-1水平,以指导早期治疗方案的合理调整,可能对改善患者的预后有积极意义。
利益冲突:所有作者声明无利益冲突
作者贡献声明
晏立娜:设计研究方案,实施研究过程,论文撰写;李佳艳:提出研究思路,分析试验数据,论文审核;陈奕菲、聂曦明:课题设计,资料搜集整理,进行统计学分析

