ARTP技术选育米曲霉氨肽酶高产菌株
张艳芳,孟广超,2,王选年,2*
(1.新乡学院 生物技术研究中心,河南 新乡 453003;2.郑州大学 生命科学技术学院,郑州 450001)
对微生物进行高质量与高生产能力的改造,是当前发酵生产行业的核心,前人对米曲霉菌株的诱变方法主要有紫外诱变、DES复合诱变和离子注入诱变等,这些方法均能有效地提高米曲霉产各类蛋白酶的活性[1-3]。但是这些方法效率低、盲目性大、工作量高,不适合当今迅速发展的社会,正逐渐被社会淘汰。近几年,新兴起的常压室温等离子体(ARTP)诱变技术对米曲霉菌株进行诱变育种,与传统的诱变方法相比,它具有操作简便、可行性高、安全无污染等特点,逐渐取代传统的育种方式,成为育种界新的传统,国内的科研工作者利用ARTP技术进行诱变育种,且均取得了不错的成绩[4-5]。本实验以米曲霉CICC2066为氨肽酶的来源菌株,因为该菌株性能稳定,产蛋、白酶活性高,广泛运用于工业生产中。采用ARTP诱变技术,旨在获得高产突变的产氨肽酶菌株。
1 材料与方法
1.1 材料
1.1.1 菌种
米曲霉(Aspergillusoryzae)CICC2066:本实验室保存。
1.1.2 主要试剂与仪器
L-亮氨酸-4-硝基苯胺(分析纯):索莱宝公司;72s分光光度计:美国IBAK公司;ARTP诱变育种仪:无锡天幕源生物有限公司;其他有机试剂:均为分析纯。
1.1.3 培养基
米曲霉斜面培养基:PDA培养基,将土豆清洗干净、切片、去皮,在沸水中煮20 min,用4层纱布过滤掉滤渣,加入15 g琼脂,于121 ℃灭菌20 min。
初筛培养基:蔗糖30 g/L,L-亮氨酸对硝基苯0.5 g/L,七水硫酸镁0.5 g/L,磷酸氢二钾10 g/L,琼脂粉17 g/L,无菌水1000 mL,pH 6.4,于121 ℃灭菌20 min。
制曲培养基:将16 g麸皮、4 g豆粕共20 g置于250 mL三角瓶中,加入16 g的水,用玻璃棒搅拌均匀,于121 ℃灭菌20 min。
1.2 方法
1.2.1 诱变材料的选择
选取米曲霉培养72 h时嫩绿色的孢子为诱变材料,因为这个时期的孢子活跃度高,更易突变,且孢子为单倍体,与菌丝体相比更容易发生突变且能获得稳定遗传的突变菌株[6]。
1.2.2 孢子悬液的制备
用于诱变的米曲酶孢子数目要足够多,因为诱变是不定向的,诱变以后的米曲霉孢子死亡率在70%以上,剩余的孢子中部分没有突变,部分发生负突变,正突变孢子数目很少,所以孢子数目要足够多,否则很难选择需要的菌株[7]。将斜面保存的米曲酶CICC2066菌株置于35 ℃的培养箱中活化,用无菌水洗脱斜面上的孢子,用转子将洗下的孢子振荡打散,在显微镜下用血球计数板计数,将孢子液的浓度调整为1×107个/mL备用。
1.2.3 致死率的确定
将制备好的孢子液均匀地涂在ARTP诱变仪的玻片上,调整好功率为120 W 气流量为10 SLM,以30 s为时间间隔在等离子诱变仪上分别处理0,30,60,90,120,150,180,210,240,270,300 s,将诱变后的菌落分别稀释10-3,10-4,10-5进行涂布培养72 h,计算菌落的致死率。
致死率=(诱变前菌落数-诱变后菌落数)/诱变前菌落数×100%。
1.2.4 ARTP诱变后的筛选
LNA被氨肽酶水解生成pNA而留下黄色的水解圈,根据HE值(水解圈直径/菌落直径)的测定进行初次筛选,与对照组相比,HE值增大的菌株记为正突变株,做好标记,并移入PDA培养基,在35 ℃条件下培养,为复筛做准备。
复筛以氨肽酶活性为筛选标准,在初次筛选的基础上将初筛获得的菌株接种到制曲培养基中35 ℃培养72 h,分别检测氨肽酶活性,与对照菌株比较,并记录生长情况。
1.2.5 粗酶液的获取
称取1 g固体干曲,用pH为7.2的PBS浸泡,并于4 ℃过夜,用4层纱布过滤得到氨肽酶的粗酶液。
1.2.6 氨肽酶活性检测
采用L-亮氨酸对硝基苯胺法检测氨肽酶活性[8]:将获得的粗酶液在4 ℃,8000×g的条件下离心5 min,取上清液,用pH值为7.2的PBS稀释10倍。取100 μL稀释后的氨肽酶粗液在100 ℃水浴灭活20 min,用作对照。分别取灭活的酶液与未灭活的酶液,加入1.5 mL的PBS,在40 ℃条件下恒温10 min,使其温度稳定,向EP管中加入浓度为25 mmol/L的对硝基苯胺乙醇溶液100 μL,在水浴中40 ℃反应10 min,在405 nm下测定其吸光值。
酶活定义:在40 ℃、pH 7.2时,氨肽酶每1 min水解亮氨酸对硝基苯胺生成1 μg对硝基苯胺(p-NA)所需的酶量为一个酶活力单位。
酶活力计算公式:U=A×V1×D÷(K×t×V2)。
式中:U为氨肽酶活性(U/mL),A为405 nm下的吸光值,V1为反应总体积1.7 mL,D为酶液的稀释倍数10,t为反应时间10 min,K为消光系数倍数,V2为酶液体积100 μL。
亮氨酸对硝基苯胺标准曲线的制作:以无水乙醇为空白对照,配制浓度梯度为0,0.5,1.5,2.5,3.5,4.5,5.5,6.5,7.5 μg/mL的对硝基苯胺溶液,用紫外分光光度计在405 nm波长下测定其吸光值,以对硝基苯胺的浓度(μg/mL)为横坐标,以不同浓度对硝基苯胺的吸光值为纵坐标,建立标准曲线。
1.2.7 诱变后菌株的遗传稳定性检测
将筛选得到的诱变后的米曲霉菌株在PDA斜面培养基上连续传代5次,每代都检测其氨肽酶活性,并记录其菌落生长状况(菌落颜色、菌落大小、产孢子时间等)并与对照菌株(CICC2066)进行对比。
2 结果与分析
2.1 L-亮氨酸对硝基苯胺标准曲线
根据1.2.6中不同浓度的对硝基苯胺吸光值的检测建立L-亮氨酸的标准曲线,见图1。
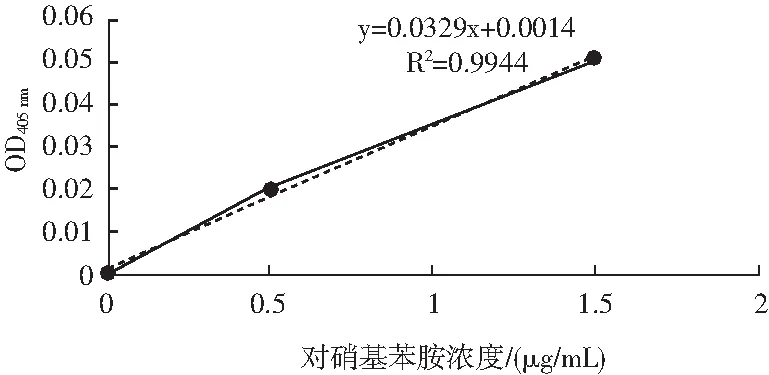
图1 对硝基苯胺标准曲线Fig.1 The standard curve of p-NA
由图1可知,L-亮氨酸标准曲线的方程为y=0.0329x+0.0014,其中R2为0.9944,证明该曲线可用,同时根据标准曲线可以求得消光系数K=0.0329。
2.2 ARTP诱变条件的确定
2.2.1 ARTP诱变时间的确定
在ARTP诱变功率为120 W、气流量为10 SLM、孢子液浓度为1×107个/mL的条件下对米曲霉孢子进行诱变处理,将诱变过后的孢子梯度稀释并涂布培养,通过确定菌落的致死率进而确定诱变时间,菌落致死率随时间变化的关系见图2。
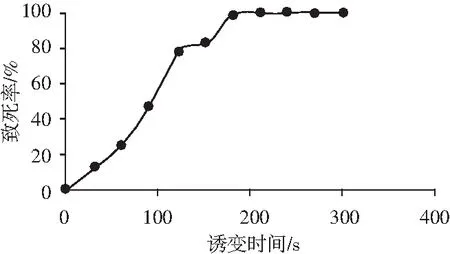
图2 诱变时间与致死率的关系Fig.2 The relationship between mutagenesis time and lethality rate
由图2可知,随着诱变时间的增加,米曲霉菌落的致死率也逐渐增加,在时间为0~120 s时,菌落致死率增加较快,120~160 s时菌落致死率增加较慢,在诱变时间达到200 s时,致死率达到100%,查阅文献可知,米曲霉在致死率达到75%左右时正突变率最高[9],在实验中120~150 s以后菌落致死率曲线较为平缓,因此本实验采用的诱变时间为120 s,在此条件下菌落的致死率为75%。
2.2.2 ARTP孢子浓度的确定
为确定ARTP诱变技术中孢子液的浓度(初始孢子液的浓度为1×107个/mL),采用梯度稀释法对初始孢子液的浓度分别稀释10-3,10-4,10-5倍,将稀释后的孢子悬液在35 ℃下培养72 h,根据平板菌落计数法确定菌落数量,进而确定ARTP技术中孢子液的浓度。
由表1可知,在诱变时间为120 s时,当稀释倍数为10-3时,菌落生长太过密集,无法计数,在稀释倍数为10-5时,经诱变后菌落数只有8个,在稀释倍数为10-4时,经诱变后菌落数为33个,参考GB 4789.2-2016 《食品卫生微生物学检验 菌落总数测定》菌落数在30~100具有计数意义[10],所以最终确定稀释倍数为10-4,即ARTP诱变技术中孢子液的浓度为1×103个/mL。
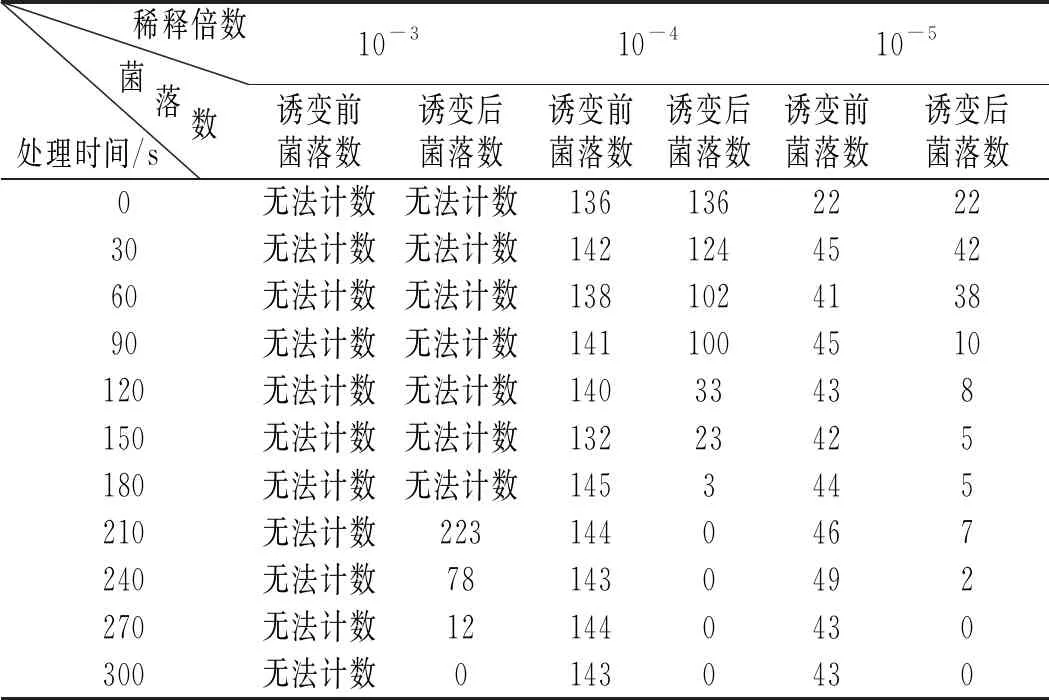
表1 不同稀释倍数下的菌落计数Table 1 The colony count under different dilution multiples
2.3 ARTP筛选结果
在诱变时间120 s、仪器气流量10 SLM、功率120 W、孢子悬液浓度为1×103个/mL时,对米曲霉CICC2066进行ARTP诱变处理,将处理过的孢子悬液均匀涂布到氨肽酶活力筛选培养基上,以CICC2066为对照,挑取HE值较CICC2066增大的20菌株进行培养,诱变菌株HE值见表2。
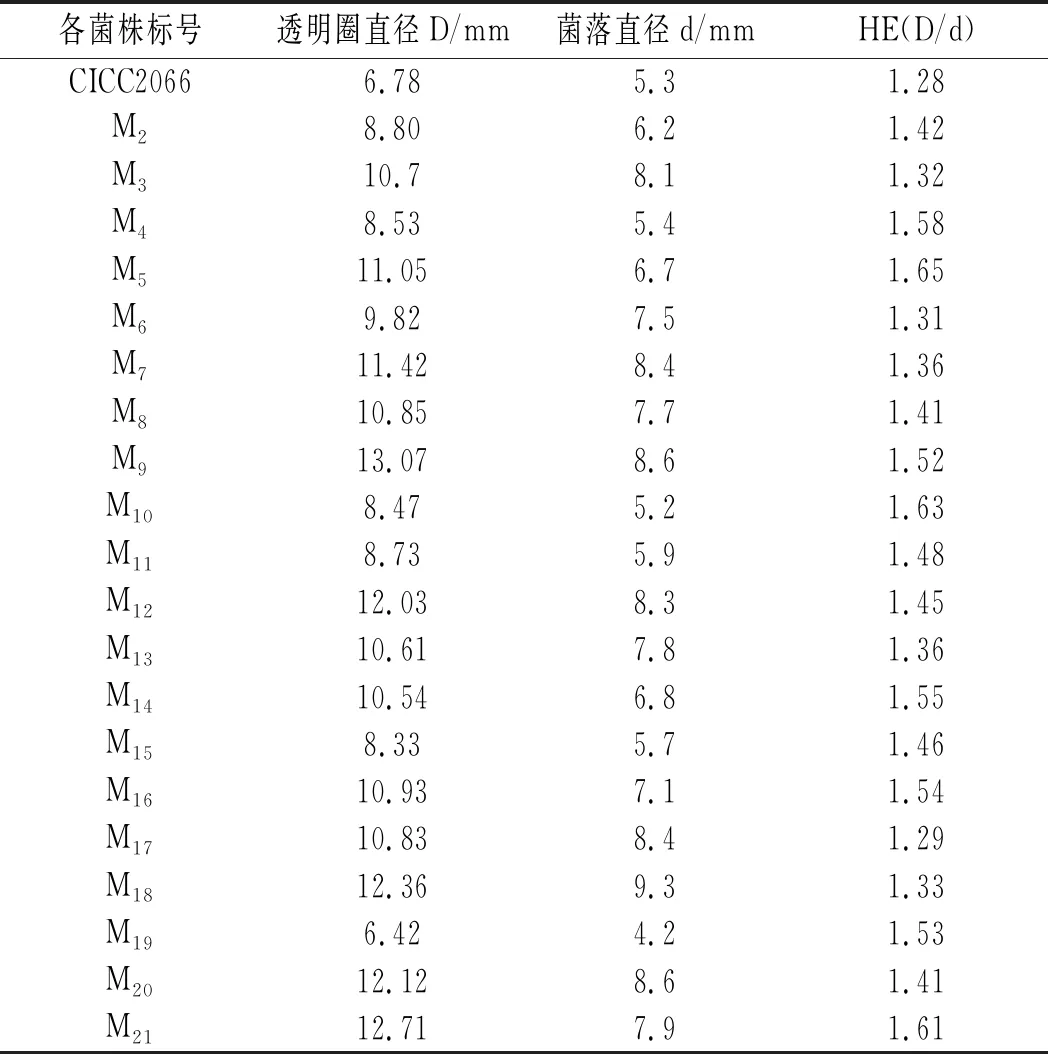
表2 出发菌株和各诱变菌株的HE值Table 2 The HE values of original strains and mutagenic strains
由表2可知,CICC2066的HE值为1.28,M5的HE值最大,为1.65,比CICC2066高1.23倍,初步说明该菌株的产酶能力较其他菌株强,在培养过程中,M5菌株在48 h左右菌落颜色就变成黄绿色,产生大量孢子,此时其他菌落为白色,或者刚有孢子出现,说明M5菌株较其他菌株生长更快。将初次筛选得到的20株诱变菌株保存到PDA斜面上备用以及进行下一步的复筛实验。
将初筛得到的20株米曲霉菌株接种到制曲培养基中,在培养温度35 ℃、接种量1%(浓度为1×107个/mL)的条件下制曲62 h时分别检测其氨肽酶的活性,结果见图3。
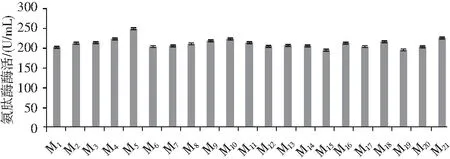
图3 复筛时氨肽酶在62 h的活性Fig.3 The aminopeptidase activity at 62 h during rescreening
由图3可知,CICC2066氨肽酶活性为201.4 U/mL,在诱变处理后的菌株中,M5菌株氨肽酶的活性最大,达到246.3 U/mL,较出发菌株提高了1.21倍,其他诱变菌株中,比CICC2066氨肽酶活性高的菌株有M2、M3、M4、M5、M8、M9、M10、M11、M12、M13、M14、M16、M17、M18、M20、M21,比CICC2066氨肽酶活性低的有M6、M7、M15、M19。在ARTP诱变的初次筛选中,选取的HE值均大于CICC2066,制曲培养结果表明米曲霉产氨肽酶的稳定性存在差异,造成氨肽酶活性降低的原因可能是在培养过程中培养条件对米曲霉代谢能力产生影响,导致米曲霉产氨肽酶的活性发生变化,而M5菌落在初筛时HE值最大,制曲培养后氨肽酶活性也最大,说明M5菌株不仅产氨肽酶能力高,而且具有一定的产酶稳定性。将M5菌株培养一段时间后,用冻存管收集其孢子并用20%的甘油于-80 ℃保存。
2.4 ARTP技术诱变后遗传稳定性检测
生产菌种容易出现退化、连续传代引起菌株产酶能力下降等问题,因此检测菌种遗传稳定性很有必要。将M5菌株连续培养5代,在温度35 ℃、接种量1%(浓度为1×107个/mL)、制曲培养62 h的条件下检测其遗传稳定性,结果见图4。
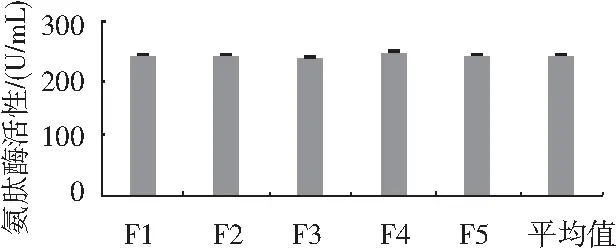
图4 诱变菌株遗传稳定性检测Fig.4 The detection results of genetic stability of mutagenic strains
由图4可知,第1代M5产氨肽酶活性为243.1 U/mL,第5代氨肽酶活性为245.3 U/mL,最高氨肽酶活性为249.3 U/mL。氨肽酶活性维持在241.2~249.3 U/mL,氨肽酶活性差异不大,表明M5菌株具有遗传的稳定性。
2.5 常压室温等离子诱变筛选的M5菌株与出发菌株CICC2066的对比
将M5菌株与CICC2066菌株在培养温度为35 ℃、接种量为1%(浓度为1×107个/mL)的条件下接种到制曲培养基中,分别测定不同时间段的氨肽酶活性,检测结果见图5。
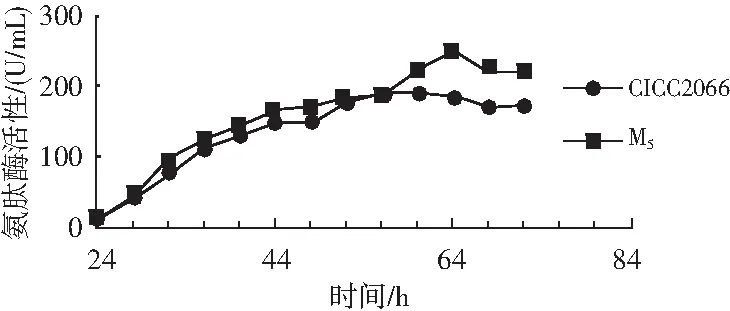
图5 不同时间段M5菌株与CICC2066菌株的氨肽酶活性Fig.5 The aminopeptidase activity of M5 and CICC2066 strains at different time periods
由图5可知,M5菌株在培养时间24~50 h内氨肽酶活性上升平缓,在64 h时氨肽酶活性达到峰值,为246.1 U/mL,随着发酵时间的继续上升,氨肽酶活性开始下降,在培养72 h时发酵结束,氨肽酶活性为220.3 U/mL。CICC2066菌株在培养时间24~42 h内氨肽酶活性变化平缓,在42~62 h内氨肽酶活性上升快,在60 h时氨肽酶活性达到峰值190.1 U/mL,随后开始下降,在72 h发酵结束时氨肽酶活性为171.2 U/mL。
孢子指标的检测是考察米曲霉菌株优良性的一项重要指标,孢子的生长决定米曲霉长势进而影响其代谢能力,在培养条件为时间62 h、培养温度35 ℃、孢子液浓度1×107个/mL、PDA平板培养条件下对M5和CICC2066孢子的生长情况进行比较,结果见图6。

图6 CICC2066和M5的孢子扫描电镜对比图(250×)Fig.6 The scanning electron microscope comparison of spores of CICC2066 and M5(250×)
由图6可知,M5菌株孢子直径Δd=4.02 μm,CICC2066直径Δd=3 μm,M5孢子直径比CICC2066大1.02 μm,从外观来看,经ARTP技术处理后孢子生理形态发生变化,M5孢子中间较为凹陷,形状多接近于椭球形,孢子生理形态的变化对米曲霉代谢能力是否存在关联还需进一步研究。
在培养温度为35 ℃,孢子液浓度为1×107个/mL,PDA平板培养62 h后,对M5菌株和CICC2066菌株的菌落生长状况进行对比,见图7。
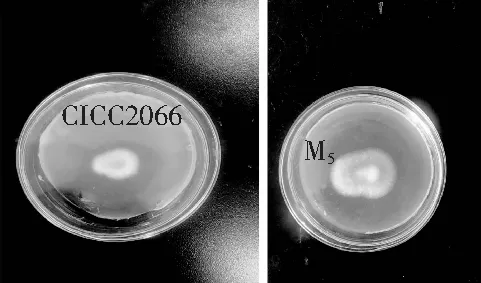
图7 CICC2066和M5的菌落生长对比图Fig.7 The colony growth comparison of CICC2066 and M5
由图7可知,在相同培养的条件下,M5菌株菌落更大,颜色为黄绿色,说明有大量孢子产生,菌落密集且连续,而同时期培养的CICC2066菌落较小,颜色多为白色,少数为黄绿色或者浅黄色,说明M5菌株生长更快,表明ARTP技术对米曲霉菌落生长速度产生影响。
在培养温度为35 ℃,孢子接种量为1%(浓度为1×107个/mL)的条件下制曲培养62 h,对M5和CICC2066成曲进行比较,结果见图8。由图8可知,M5菌株所成的成曲较CICC2066蓬松,成曲颜色为黄绿色,表明有大量孢子产生,同时期CICC2066多为白色,少数成曲呈淡黄色,且CICC2066存在大量白色的菌丝体,表明M5比CICC2066生长更快,与平板培养结果一致。

图8 CICC2066和M5成曲对比图Fig.8 The comparison of CICC2066 and M5 finished kojis
3 结论
采用ARTP诱变技术,通过平板初筛、制曲复筛等方法成功筛选到一株氨肽酶酶活提高的米曲霉菌株,其氨肽酶活性比出发菌株CICC2066高1.21倍。将M5菌株传代5次,其氨肽酶活性在241.2~249.3 U/mL,表明该菌株具有良好的遗传性。M5在产酶能力上相比于CICC2066,在64 h时其酶活性达到峰值246.1 U/mL,比CICC2066酶活性峰值190.1 U/mL高出1.21倍,在72 h发酵结束后,其氨肽酶的活性仍比CICC2066高1.13倍,说明ARTP技术提高了CICC2066的产酶能力。经扫描电镜检测,M5菌落的孢子直径较CICC2066更大,且孢子生理形态发生变化,经过PDA平板培养和制曲培养发现,M5较CICC2066在生长状态上存在差异,表明孢子生理形态对菌落生长产生一定影响,但孢子生理形态的改变对产酶能力是否有影响还需进一步研究。

