磷酸化53BP1在乳腺癌中的表达及其意义
范明江,闫鲁霞,徐 蕾,张 园,熊廷川,朱长军
(1.新疆喀什地区第一人民医院,新疆维吾尔自治区 喀什844000;2.天津师范大学生命科学学院,天津300387;3.天津师范大学 天津市动植物抗性重点实验室,天津300387;4.新疆医科大学第三临床医院(附属肿瘤医院)肿瘤防治研究所,乌鲁木齐830011)
基因组不稳定是肿瘤细胞的重要标志,引起基因组不稳定的原因是细胞周期调控、DNA复制以及DNA损伤修复分子通路中的相关蛋白发生突变或者错误表达导致的基因功能异常[1].P53基因是一种广谱的肿瘤抑制基因,其产物P53具有调节细胞生长、凋亡和DNA修复的作用.P53结合蛋白1(p53 binging protein,53BP1)能够与P53相互结合,其基因定位在人15号染色体长臂1区5带~2区1带,全长6.6 kb,编码1 972个氨基酸,蛋白相对分子质量为217×103[2].53BP1可在修复DNA双链断裂损伤(DSB)途径中发挥重要作用.Li等[3]研究发现,在DSB发生后第一时间53BP1可被蛋白激酶ATM磷酸化且聚集在DNA损伤处,ATM磷酸化的53BP1持续聚集在DNA损伤位点,能够阻止DNA双链损伤的正常同源重组修复,最终引起细胞基因组不稳定,导致肿瘤发生.
乳腺癌是一种常发生于乳腺上皮组织的的妇科恶性肿瘤[4].按照乳腺癌细胞表面雌激素受体(ER)、孕激素受体(PR)、表皮生长因子2受体(HER-2)等表达的不同,可将乳腺癌分为Luminal A、Luminal B、HER2阳性和三阴性等类型.Luminal A型乳腺癌的特点为:ER+、和/或PR+、HER2-,与其他类型乳腺癌相比较,Luminal A型乳腺癌预后相对较好.Luminal B型乳腺癌的特点为:ER+、和/或PR+、HER2+,Luminal B型乳腺癌肿块大,组织学分级高,易发生脉管转移和淋巴结转移.HER2过表达型乳腺癌的特点为:ER-、PR-、HER2+,该亚型乳腺癌所占比例约为20%.三阴性乳腺癌(triple-negative breast cancer,TNBC)的特点为:ER-、PR-、HER2-,该亚型乳腺癌所占比例为15%~20%[5].乳腺癌种类繁多,危害极大,但目前临床上仍缺少特异性早期分子诊断的方法.
本研究通过制备特异性抗磷酸化53BP1血清,应用免疫共沉淀技术结合蛋白免疫印迹杂交实验、细胞免疫荧光染色等方法,对抗磷酸化53BP1抗体的特异性进行检测验证,以期揭示磷酸化53BP1抗体与乳腺癌发生发展的关系.
1 材料与方法
1.1 主要材料与试剂
根据磷酸化53BP1蛋白分子一级结构中的第25位和第29位氨基酸设计制备磷酸化53BP1抗体的抗原多肽CIEDpSQPEpSQVLEDD,由杭州丹港生物科技有限公司合成;通用型免疫组化试剂盒,武汉博士德生物公司;乳腺癌组织芯片,上海卓灏医药科技有限公司(芯片编号:BRC2281).
1.2 实验方法
1.2.1 磷酸化53BP1抗体制备
磷酸化53BP1抗体由实验室自主制备,经蛋白免疫共沉淀(IP)、免疫印迹杂交(WB)、免疫荧光染色(IF)验证了抗体的特异性[6].
1.2.2 免疫组化染色检测
应用通用型免疫组化试剂盒进行免疫组化染色实验.首先是烘片,将石蜡切片放置在60℃烘箱中烘片至少60 min,之后在二甲苯中进行脱蜡处理,将脱蜡好的石蜡切片依次完全浸入不同浓度的乙醇中进行水化处理,然后使用EDTA修复液进行修复,用PBS漂洗修复好的石蜡切片3次,每次5 min.使用3%的双氧水完全浸没石蜡切片,室温下避光封闭30 min,再加PBS漂洗石蜡切片3次,每次5 min.使用0.1%PBST配制的5%BSA抗原封闭液,室温封闭60 min,封闭内源性抗原.接着一抗孵育,加适量磷酸化53BP1抗血清(1∶1000)于组织切片上,4℃条件下过夜,然后用PBS漂洗3次,每次5 min.滴加适量HRP标记过的二抗工作液,室温孵育60 min.将DAB显色液滴加至甩干的石蜡组织上,苏木精复染,将润洗过的石蜡切片没入苏木精染液中.之后按下列步骤进行组织脱水:70%乙醇5 min,85%乙醇5 min,90%乙醇5 min,95%乙醇5 min,100%乙醇10 min,100%乙醇10 min.最后滴加适量的中性树脂封片,扫描石蜡组织切片并保留样品染色图像.
1.2.3 免疫组化染色结果分析
利用Image scope X64软件采集免疫组化的图像,应用Image-Pro Plus荧光分析软件对图像进行分析.根据荧光染色的深浅,即光密度值(OD)以及分布面积大小来确定目标蛋白的量,将图片上各点的光密度值累加起来,除以目标分布区域的面积,得到平均光密度值(IOD).通过计算IOD值的大小,对各样品的图像进行定量分析.与人工计数法相比,该方法不仅能够提高定量分析的精确度,还可以避免观察者主观因素的干扰,重复性好,可信度高[7].
1.2.4 生物统计结果分析
采用SPSS17.0软件对数据进行统计分析,通过独立样本T检验,差异具有高度统计学意义(P<0.001).
2 结果与分析
2.1 磷酸化53BP1在乳腺癌组织芯片中的免疫组织化学染色
通过免疫组织化学染色技术,应用特异性磷酸化53BP1抗血清对乳腺癌组织芯片进行免疫组织化学染色,染色结果如图1所示.其中,A1~A8是8例非恶性癌的乳腺组织(non-cancer,NC),其余为220例乳腺癌组织(tumour).由于A19、F15、F19、I6、K8样本严重脱片,没有采集到满意图像,因此这5例病例均未放入结果统计范围中.
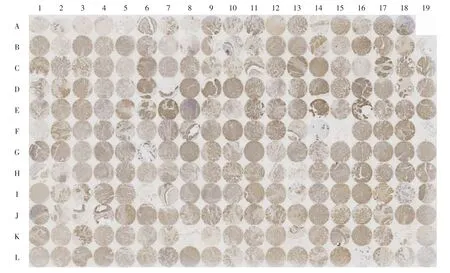
图1 磷酸化53BP1在乳腺癌组织芯片中的免疫组织化学染色Fig.1 Immunohistochemical staining of phosphorylated 53BP1 in breast cancer tissue microarrays
2.2 磷酸化53BP1在乳腺癌组织与非癌乳腺组织中表达情况的比较
利用Image-Pro Plus分别计算抗磷酸化53BP1抗体在220个乳腺癌组织和8例非癌乳腺组织中染色的平均光密度值,IOD大小代表组织标本中磷酸化53BP1的表达量.采用独立样本T检验分析数据,结果如图2(a)所示,磷酸化53BP1在乳腺癌组织标本中的平均表达量为(0.079±0.027),显著高于非癌乳腺组织标本中的平均表达量(0.036±0.007).通过独立样本T检验证实,差异具有高度统计学意义(P<0.001).随机选取非癌乳腺组织与癌组织染色结果进行比较,如图2(b)所示,癌组织中目标蛋白的棕色颜色更加明显.

图2 磷酸化53BP1在乳腺癌组织与非癌乳腺组织中的表达Fig.2 Expression of phosphorylated 53BP1 in breast cancer tissues and non-cancer tissues
2.3 磷酸化53BP1在不同TNM分期乳腺癌组织与非癌乳腺组织中表达情况的比较
利用上述磷酸化53BP1的染色结果并结合病例的TNM分期资料(Ⅰ期的病例数目为20例,Ⅱ期的病例数目为141例,Ⅲ期的病例数目为37例,无Ⅳ期的病例),分析不同TNM分期中磷酸化53BP1在乳腺癌组织与非癌乳腺组织中的表达差异,结果如图3(a)所示.选取TNM分期中典型乳腺癌组织与非癌乳腺组织的染色图片进行观察比较,结果如图3(b)所示.磷酸化53BP1在Ⅰ期、Ⅱ期和Ⅲ期癌组织标本中的平均表达量分别为(0.080±0.019)、(0.078±0.025)和(0.084±0.035),在非癌组织标本中的平均表达量为(0.036±0.007).经独立样本T检验证实,磷酸化53BP1在Ⅰ期、Ⅱ期和Ⅲ期癌组织中的平均表达量均显著高于非癌组织中的平均表达量,差异具有高度统计学意义(P<0.001).
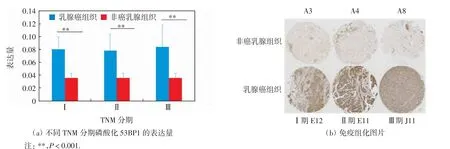
图3 磷酸化53BP1在不同TNM分期乳腺癌组织与非癌乳腺组织中的表达Fig.3 Expression of phosphorylated 53BP1 in different TNM stages of breast cancer tissues and non-cancer tissues
2.4 磷酸化53BP1在不同病理分级乳腺癌组织与非癌乳腺组织中表达情况的比较
乳腺癌组织芯片中组织病理分级:I级的病例数目为7例,Ⅰ-Ⅱ级的病例数目为8例,Ⅱ级的病例数目为82例,Ⅱ-Ⅲ级的病例数目为89例,Ⅲ级的病例数目为22例,因Ⅰ级、Ⅰ-Ⅱ级的病例数目较少,将其合并分析.不同病理分级乳腺癌组织中磷酸化53BP1的表达与非癌乳腺组织中的表达差异如图4(a)所示.选取典型的不同病理分级乳腺癌组织染色图像与非癌组织的图像进行比较,结果如图4(b)所示.在Ⅰ和Ⅰ-Ⅱ级癌组织标本中磷酸化53BP1的平均表达量为(0.072±0.029),在Ⅱ级癌组织标本中表达量为(0.081±0.023),在Ⅱ-Ⅲ级癌组织标本中的表达量为(0.079±0.028),在Ⅲ级癌组织标本中的表达量为(0.082±0.025);非癌组织中的表达量为(0.036±0.007).经独立样本T检验,在Ⅰ和Ⅰ-Ⅱ级、Ⅱ级、Ⅱ-Ⅲ级和Ⅲ级癌组织中,磷酸化53BP1的平均表达量均显著高于非癌组织中的表达量,差异具有高度统计学意义(P<0.001).
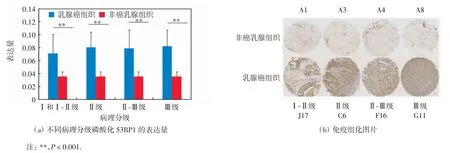
图4 磷酸化53BP1在不同病理分级乳腺癌组织与非癌乳腺组织中的表达Fig.4 Expression of phosphorylated 53BP1 in different pathological grades of breast cancer and non-cancer tissues
2.5 磷酸化53BP1在不同类型乳腺癌组织与非癌乳腺组织中表达情况的比较
按照乳腺癌组织中雌激素受体、孕激素受体、表皮生长因子2受体等表达的不同,可将乳腺癌分为Luminal A、Luminal B、HER2阳性和三阴性乳腺癌,将不符合ER、PR、HER-2表达检测指标的乳腺癌患者归结为其他类型.结合病历资料分析可知,220例乳腺癌组织中,Luminal A病例数目为55例,Luminal B病例数目为25例,HER2阳性病例数目为48例,三阴性乳腺癌病例数目为26例,其他类型的乳腺癌病例数目为66例.利用磷酸化53BP1的染色结果并结合病例资料,分析不同类型的乳腺癌组织与非癌组织中磷酸化53BP1的表达,结果如图5(a)所示.选取典型的不同类型乳腺癌组织染色图片与非癌组织染色图片进行对比,结果如图5(b)所示.磷酸化53BP1蛋白在Luminal A型、Luminal B型、HER2阳性、三阴性以及其他类型乳腺癌组织标本中的平均表达量分别为(0.086±0.029)、(0.078±0.028)、(0.077±0.020)、(0.079±0.031)、(0.074±0.027);在非癌组织中的平均表达量为(0.036±0.007).经独立样本T检验证实,磷酸化53BP1在不同类型的乳腺癌组织中的表达量均显著高于非癌组织中的表达量,差异具有高度统计学意义(P<0.001).
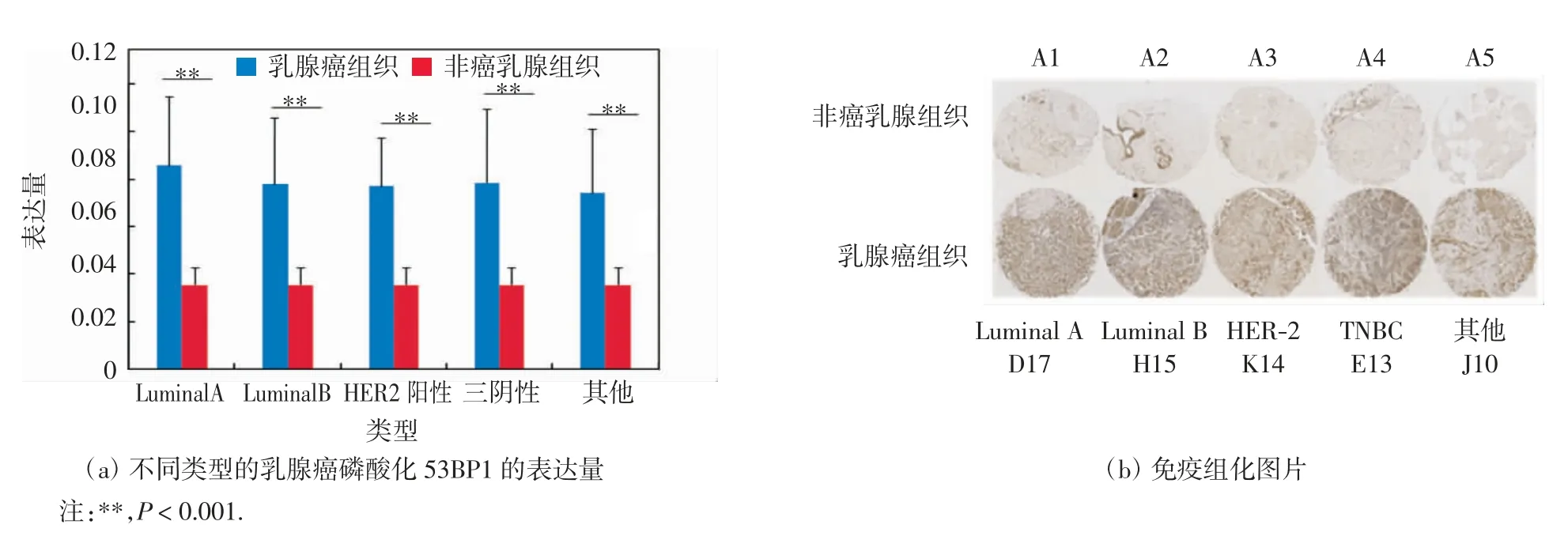
图5 磷酸化53BP1在不同类型乳腺癌组织与非癌乳腺组织中的表达Fig.5 Expression of phosphorylated 53BP1 in different types of breast cancer tissues and non-cancer tissues
3 讨论与结论
细胞在生长增殖等正常生命活动过程中,常常发生遗传物质DNA的双链断裂损伤(DSB).如果DSB不能正常修复,除引起细胞死亡外,还可能引起细胞基因组不稳定,导致肿瘤的发生发展.真核细胞有2种主要的修复途径应对DSB损伤:同源重组修复(homologous recombination,HR)和非同源末端连接(non-homologous end-joining,NHEJ).HR需要同源DNA序列作为模板进行修复,而NHEJ直接连接被切断的DNA受损的末端[8].当细胞发生DSB时,在DNA损伤位点处蛋白激酶ATM被活化,进而使聚集在此区域的53BP1发生磷酸化.磷酸化的53BP1与RIF1结合形成复合物聚集在DSB处,抑制细胞进行同源重组修复[9].此时,乳腺癌易感基因1(breast cancer susceptibility gene 1,BRCA1)通过激活下游底物PP4C(protein phosphatase 4 catalytic subunit)等促进磷酸化的53BP1发生去磷酸化.去磷酸化的53BP1蛋白与RIF1分离,促使断裂的DNA以未损伤的姐妹染色单体的同源序列作为修复模板,进行DNA同源重组修复,最终保证细胞基因组的完整性[10].如果由各种原因导致DSB位点的53BP1持续处于磷酸化状态,将抑制细胞同源重组修复的正常进行,导致细胞基因组不稳定,引起肿瘤发生.
本研究通过对220例乳腺癌组织中53BP1蛋白的磷酸化水平进行免疫组化检测,利用Image-Pro Plus荧光分析软件对图像进行分析,发现磷酸化53BP1在乳腺癌组织中的表达水平显著高于非癌对照乳腺组织中的表达水平,在不同TNM分期、病理分级以及不同类型的乳腺癌组织中的平均表达量均显著高于非癌对照乳腺组织中的表达量(P<0.001).这些结果表明,磷酸化53BP1与乳腺癌的发生、发展密切相关,是一个潜在的能反映乳腺癌发生、发展的分子标志物,可应用于早期乳腺癌的筛查和诊断.

