盐胁迫下不同玉米自交系的耐盐生理差异分析
王丽红,豆昕桐,王英杰,王华忠,韩立森,岳洁瑜
(1.天津师范大学天津市动植物抗性重点实验室,天津300387;2.中国民航大学,天津300300)
农业生产过程中由于施肥和土壤灌溉不当等导致土地污染严重,盐渍化问题日益突出.预计到2050年全球耕地将有50%发生盐渍化[1-2].土壤盐渍化会导致植物在生长发育过程中受到离子毒害、渗透胁迫、氧化胁迫等危害,进而使细胞膜受损、根系脱水、代谢紊乱,植物光合作用下降,植物生长受到严重影响[3].宋阳等[4]研究发现,番茄遭受NaCl胁迫时,茎、叶中的Na+含量显著增加,根、茎中的K+含量减少,叶片中的K+含量增加;Jiang等[5]研究发现,盐胁迫下棉花幼苗生长受到严重抑制,叶片产生过量的过氧化氢(H2O2)、超氧阴离子(O2.-)和丙二醛(malondialdehyde,MDA);豆昕桐等[6]在研究小麦响应不同浓度NaCl胁迫时发现,根和叶中的Na+、K+和Ca2+含量失衡,活性氧增加,叶绿素荧光参数随NaCl处理浓度和处理时间的延长发生显著变化.植物也会通过一系列的生理反应缓解盐胁迫造成的损伤.如Abdelgawad等[7]研究发现,高盐胁迫下玉米根和叶片可通过提高超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)等抗氧化酶的活性增强耐盐性;齐琪等[8]指出,在高Na+浓度的环境中维持胞质中稳定的K+浓度、增强自身保护酶活性是植物抵御盐胁迫的重要措施;万雪等[9]研究发现,盐胁迫下甜菜可通过增加可溶性蛋白、脯氨酸等渗透调节物质的含量以增强植株对盐胁迫的适应性.
玉米耐盐性是一个复杂的数量性状,涉及诸多基因和多种耐盐机制的协调作用[10-11].本研究对比分析了2种不同基因型玉米自交系PH4CV(盐敏感型)和PH6WC(耐盐型)在盐胁迫下的生长生理、光合生理和逆境生理的变化规律,探讨玉米响应盐胁迫的生理机制.研究结果可为玉米耐盐育种和筛选提供科学依据.
1 材料与方法
1.1 幼苗培养与盐处理
以田间实验耐盐性差异较大的2个玉米自交系(盐敏感型PH4CV和耐盐型PH6WC)种子为材料.选择健康的玉米种子用蒸馏水浸泡12 h后,将种子摆放于铺有双层湿润纱布的培养盆中,室温培养,每隔2 d换一次蒸馏水.幼苗生长至一叶期时,用1/10 Hoagland营养液继续培养,每隔2 d更换一次营养液.培养幼苗至三叶一心期,平均分组后,分别用不同浓度的NaCl(0、10、25、50和100 mmol/L)进行处理,每个处理重复3次.共处理9 d,每隔2 d取样一次.
1.2 离子质量分数的测定
分别随机选取2个品种的对照组和处理组玉米幼苗,依次用自来水、蒸馏水和去离子水清洗后,分别截取根、茎、叶,置于108℃烘箱中杀青10 min,85℃烘干至恒重,研磨成粉末.用浓硝酸消化后,采用电感耦合等离子发射光谱法测定玉米幼苗的根、茎、叶中Na+、K+、Ca2+的质量分数(ωNa+、ωK+、ωCa2+).
1.3 MDA含量的测定
称取0.2 g叶片或根,使用液氮研磨成粉末,转移至2 mL离心管中,加入9倍体积的匀浆介质,4℃、4 500 r/min下离心10 min,取上清液待测.使用植物丙二醛测试盒(A003-3,南京建成生物工程研究所)测定MDA含量,用酶标仪(Infinite M200 Pro,瑞士Tecan公司)测定530 nm下的吸光度值,每个处理重复3次.
1.4 SOD和POD活性的测定
称取0.3 g玉米叶片或根尖组织,置于研钵中,加入液氮研磨成粉末,转移至2 mL离心管中,加入4倍体积的匀浆介质,4℃、4 500 r/min条件下离心10 min,取上清液待测.用植物组织铜锌-超氧化物歧化酶测定试剂盒(A004-1,南京建成生物工程研究所)测定SOD活性,使用酶标仪测定550 nm下的吸光度值,每个处理重复3次.
称取0.2 g玉米叶片或根尖组织,置于研钵中,加入液氮研磨成粉末,转移至2 mL离心管中,按照鲜质量(g)∶匀浆液体积(mL)=1∶9的比例加入pH值为7.2的磷酸盐缓冲液(0.1 mol/L),4℃、4 500 r/min条件下离心10 min,取上清液待测.采用愈创木酚法(A084-3过氧化物酶测定试剂盒,南京建成生物工程研究所)测定POD活性,测405 nm下的吸光度值,每个处理重复3次.
1.5 叶绿素荧光参数的测定
使用双通道调制叶绿素荧光仪(Dual-PAM-100,上海泽泉科技股份有限公司),对不同浓度NaCl处理的玉米叶片进行叶绿素荧光参数的测定,包括初始荧光(Fo)、最大荧光(Fm)、PSⅡ原初光能转化效率(Fv/Fm)、PSⅡ有效光化学量子产量(Fv′/Fm′)、光化学猝灭系数(qP)、非光化学猝灭系数(NPQ)、表观电子传递速率(ETRⅡ)、PSⅡ实际光化学量子产量(Y(Ⅱ))等[5-7].测定时间为8:30-11:30.实验前对玉米幼苗进行20 min暗处理,选择叶片中上部避开主叶脉进行测定,每个处理重复4次.
1.6 数据处理与分析方法
实验数据采用Excel 2007进行分析.
2 结果与分析
2.1 NaCl胁迫对2个品种玉米幼苗离子积累与分布的影响
不同浓度NaCl胁迫下,2个品种玉米幼苗不同部位的离子分布情况如图1所示.由图1(a)和图1(b)可以看出,2个品种玉米幼苗的根系中,随着NaCl浓度的增加,PH4CV中的ωNa+先上升后下降,可能是随着NaCl浓度的增加,根中更多的Na+向地上部分转移,ωK+和ωCa2+持续下降;PH6WC中的ωNa+持续上升,ωCa2+持续下降,ωK+先上升后下降.由图1(c)和图1(d)可以看出,随着NaCl浓度的增加,2个品种玉米幼苗茎部的ωNa+均持续上升,ωK+均先上升后下降,PH4CV中ωCa2+先下降后上升,PH6WC中ωCa2+一直呈下降趋势.由图1(e)和图1(f)可以看出,随着NaCl浓度的增加,2个品种叶片中的ωNa+均持续上升,PH4CV中ωK+缓慢上升,ωCa2+先下降后上升,PH6WC中ωK+先上升后下降,ωCa2+一直呈下降趋势.
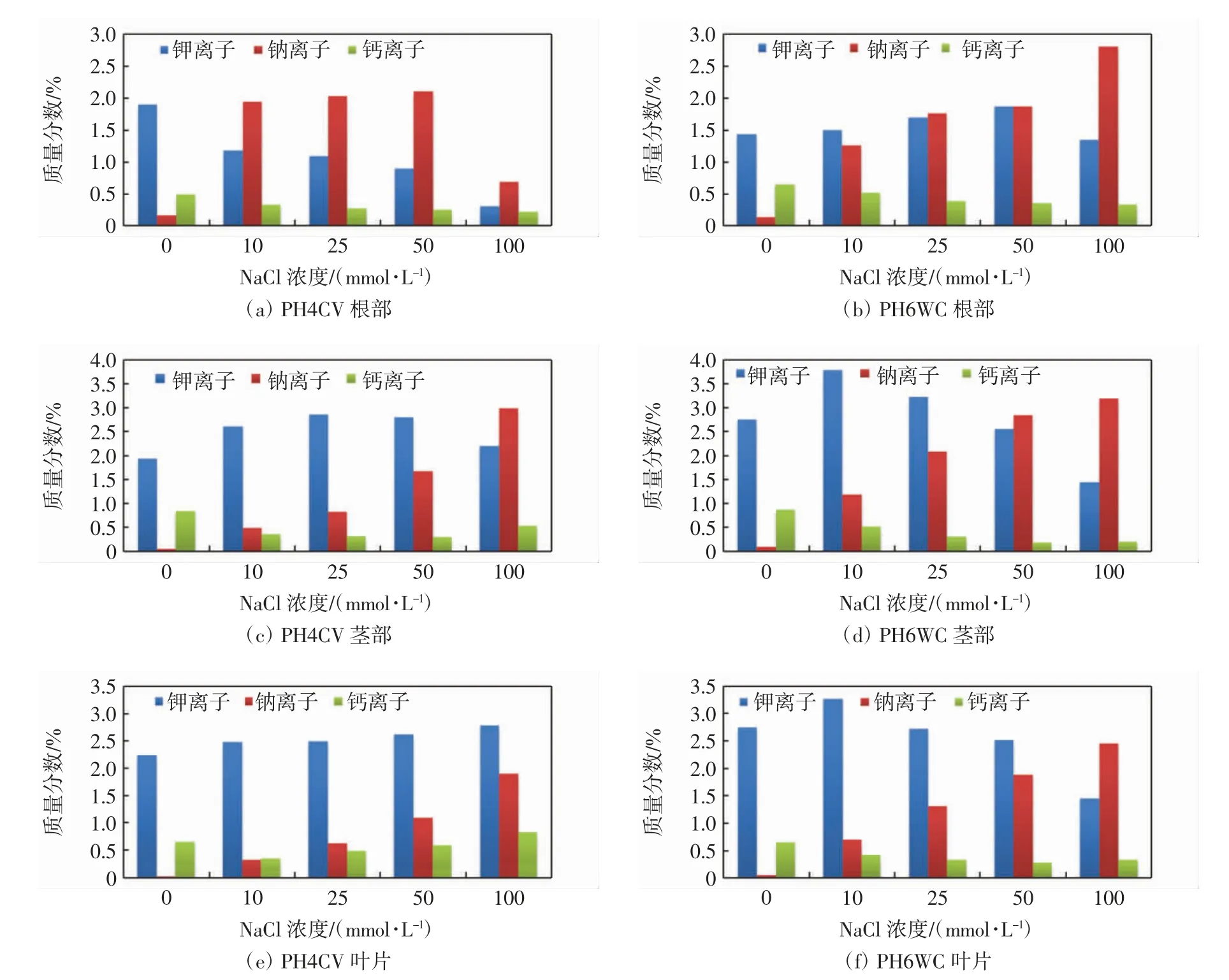
图1 不同浓度NaCl胁迫下PH4CV和PH6WC幼苗不同部位离子的质量分数Fig.1 Mass fraction of ion in different parts of PH4CV and PH6WC seedlings under various concentrations of NaCl stress
比较2个玉米品种,总的来看,相同盐胁迫程度下,PH6WC中的ωK+和ωNa+均大于PH4CV中的数值,ωCa2+则略低于后者中的数值.
不同浓度NaCl胁迫下,PH4CV和PH6WC幼苗不同部位的ωK+/ωNa+如表1所示,ωCa2+/ωNa+如表2所示.
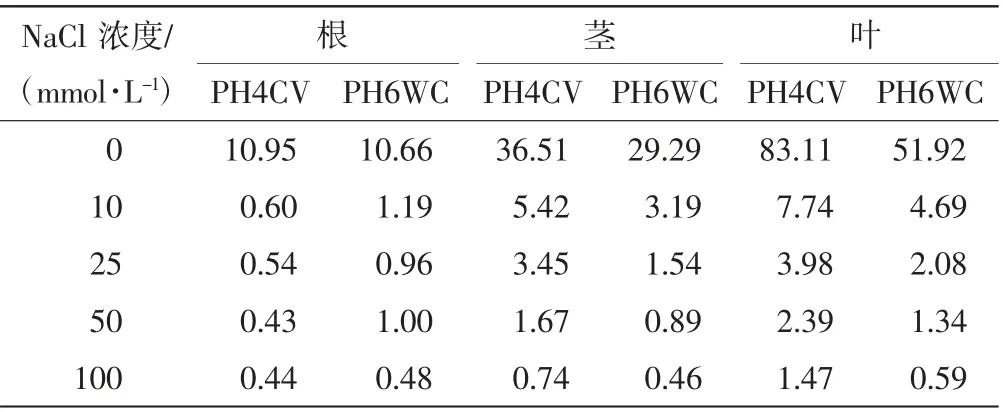
表1 不同浓度NaCl胁迫下PH4CV和PH6WC幼苗不同部位的ωK+/ωNa+Tab.1 ωK+/ωNa+in different parts of PH4CV and PH6WC seedlings under various concentrations of NaCl stress
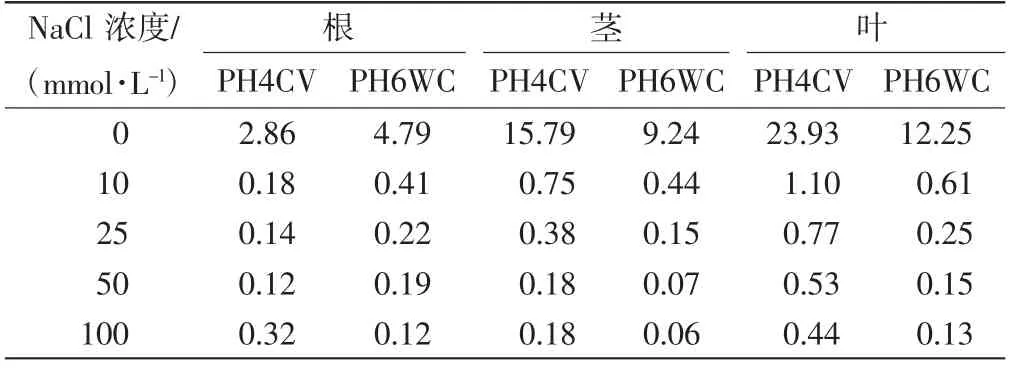
表2 不同浓度NaCl胁迫下PH4CV和PH6WC幼苗不同部位的ωCa2+/ωNa+Tab.2 ωCa2+/ωNa+in different parts of PH4CV and PH6WC seedlings under various concentrations of NaCl stress
由表1和表2可以看出,随着NaCl浓度的增加,2个品种玉米幼苗不同部位的ωK+/ωNa+均呈下降趋势,PH6WC根、茎、叶和PH4CV茎、叶中的ωCa2+/ωNa+均呈下降趋势,PH4CV根部ωCa2+/ωNa+呈先下降后上升的趋势.比较不同部位,2个品种均是叶片中的ωK+/ωNa+、ωCa2+/ωNa+最高,根部数值最低.随着NaCl浓度增加,PH4CV的根、茎、叶中ωCa2+/ωNa+和ωK+/ωNa+下降幅度更大.
2.2 NaCl胁迫对2个品种玉米幼苗MDA含量的影响
NaCl胁迫下,2个品种玉米幼苗根系和叶片中的MDA含量如图2所示.由图2(a)可以看出,在培养初期(<3 d),随着NaCl浓度的增加PH4CV根系的MDA含量呈上升趋势,培养后期(6~9 d)MDA含量呈先上升后下降的趋势,NaCl浓度为100 mmol/L时,MDA含量甚至低于对照组.由图2(b)可以看出,在培养前期和中期(≤6 d),随着NaCl浓度的增加PH6WC根系的MDA含量总体呈上升趋势,在培养后期MDA含量呈先上升后下降的趋势.由图2(c)可以看出,在培养前期和中期(≤6 d),随着NaCl浓度的增加PH4CV叶片的MDA含量总体呈上升趋势,在培养到9 d时,MDA含量呈先上升后下降的趋势;由图2(d)可以看出,随着NaCl浓度的增加PH6WC叶片的MDA含量除了在6 d时一直呈上升趋势外,在其他时间内都呈先上升后下降的趋势.总的来看,在培养的前期和中期,2个品种根系和叶片中的MDA含量均随着NaCl浓度的增加呈上升趋势,在后期则呈先上升后下降的趋势,NaCl浓度最大时,根系和叶片中的MDA含量均低于对照组的数值.
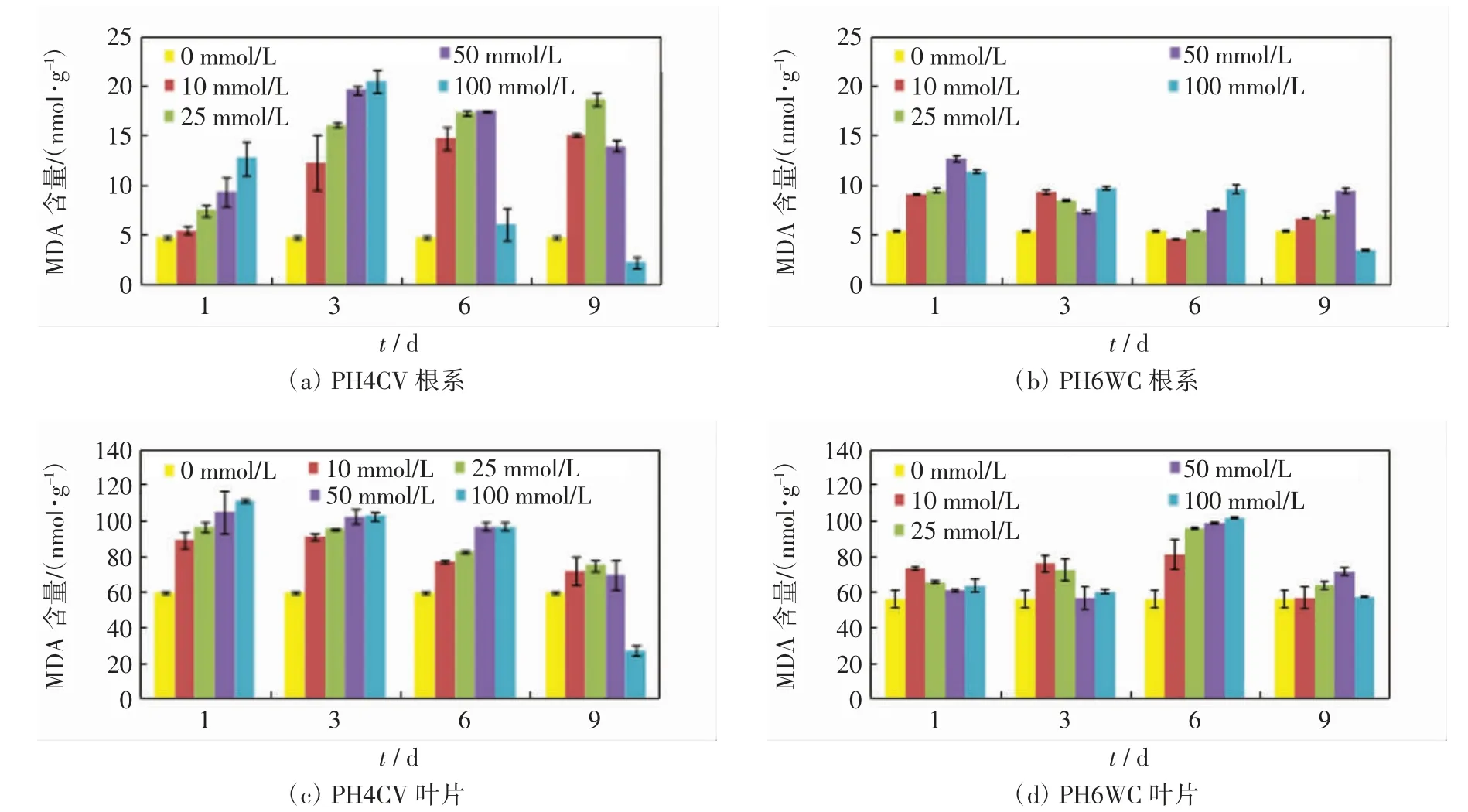
图2 不同浓度NaCl胁迫下PH4CV和PH6WC幼苗的MDA含量Fig.2 MDA content of PH4CV and PH6WC seedlings under various concentrations of NaCl stress
比较2个品种,同一培养时间内,相同NaCl浓度下,PH6WC根系和叶片中的MDA含量均低于PH4CV中的含量.
2.3 NaCl胁迫对2个品种玉米幼苗SOD活性的影响
NaCl胁迫下,2个品种玉米幼苗根系和叶片中的SOD活性如图3所示.由图3(a)和图3(b)可以看出,随着NaCl浓度的增加,2个品种玉米幼苗根系的SOD活性均呈上升趋势,PH4CV根系的SOD活性在6 d时达到最大值,随后略有降低;PH6WC根系的SOD活性在胁迫3 d内呈上升趋势,6~9 d内随着NaCl浓度的增加,SOD活性先上升后下降,之后再次上升.由图3(c)可以看出,PH4CV叶片中的SOD活性在整个培养期内变化幅度较小;PH6WC叶片中的SOD活性随着NaCl浓度的增加均呈先上升后下降的趋势.

图3 不同浓度NaCl胁迫下PH4CV和PH6WC幼苗的SOD活性Fig.3 SOD activity of PH4CV and PH6WC seedlings under various concentrations of NaCl stress
比较2个品种,同一培养时间内,相同NaCl胁迫浓度下耐盐品种PH6WC根系和叶片中的SOD活性均显著高于盐敏感型品种PH4CV中的活性,尤其是叶片中,前者叶片中的活性远远大于后者中的活性.
2.4 NaCl胁迫对2个品种玉米幼苗POD活性的影响
NaCl胁迫下,2个品种玉米幼苗根系和叶片中的POD活性如图4所示.由图4(a)和图4(b)可以看出,PH4CV根系中POD活性随着NaCl浓度增加波动较小,只是在培养后期波动较大,POD活性在NaCl浓度为10 mmol/L时达到最大值,之后下降;PH6WC根系的POD活性随着NaCl浓度增加呈缓慢上升趋势.由图4(c)和图4(d)可以看出,2个品种玉米叶片中的POD活性随着NaCl浓度增加波动幅度均较小.比较2个品种,同一培养时间内,相同NaCl胁迫浓度下,PH6WC根系和叶片中的POD活性均略低于PH4CV中的活性.
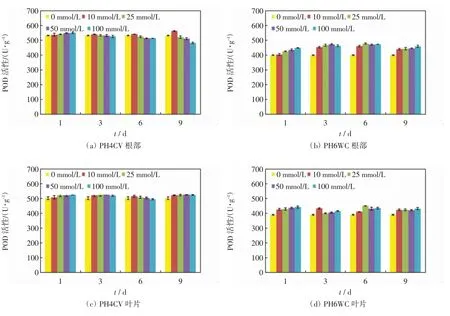
图4 不同浓度NaCl胁迫下PH4CV和PH6WC幼苗的POD活性Fig.4 POD activity of PH4CV and PH6WC seedlings under various concentrations of NaCl stress
2.5 NaCl胁迫对2个品种玉米幼苗叶绿素荧光参数的影响
不同浓度的NaCl胁迫下,2个品种玉米幼苗叶片的叶绿素荧光参数变化如图5所示.由图5可以看出,随着NaCl处理浓度的增加和处理时间的延长,2个品种玉米幼苗叶片的Y(Ⅱ)、ETR(Ⅱ)、qP均呈下降趋势,NPQ呈上升趋势.比较2个品种玉米幼苗的叶绿素荧光参数,同一培养时间内,相同NaCl胁迫浓度下,耐盐品种PH6WC叶片的Y(Ⅱ)、ETR(Ⅱ)、qP均大于盐敏感型品种PH4CV幼苗叶片的数值,NPQ小于PH4CV幼苗叶片的数值,培养时间越长NaCl处理浓度越大,二者之间的差异越显著.
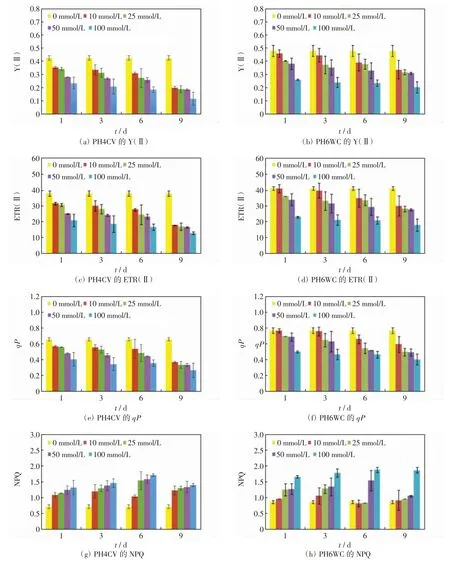
图5 不同浓度NaCl胁下PH4CV和PH6WC幼苗叶片的叶绿素荧光参数Fig.5 Chlorophyll fluorescence parameters of PH4CV and PH6WC seedlings leaves under various concentrations of NaCl stress
3 讨论与结论
土壤盐渍化可通过渗透胁迫扰乱作物矿质离子正常含量,抑制营养元素吸收,造成植株离子失衡[12].Na+是引起作物受到单盐毒害的主要离子,K+是作物所需的营养元素,可以维持作物正常代谢,Ca2+可以缓解Na+的毒害,维持细胞的稳定性和完整性[13].本研究比较了2种不同基因型玉米自交系PH4CV(盐敏感型)和PH6WC(耐盐型)对盐胁迫的抗性,结果发现:随着NaCl浓度的增加,2个品种玉米幼苗根、茎、叶中Na+含量明显增加,PH4CV根系中K+含量减少,茎、叶中K+含量增加,而PH6WC根、茎中K+含量增加,叶中K+含量逐渐减少;2个品种玉米根、茎中Ca2+含量降低,PH4CV叶片中Ca2+含量较对照组增加,PH6WC叶片中Ca2+含量较对照组减少.盐胁迫下,矿质营养元素与Na+的比值是衡量作物耐盐性的重要生理指标[14].本研究中,随着NaCl浓度的增加,2个品种玉米根、茎、叶部位ωCa2+/ωNa+和ωK+/ωNa+均逐渐降低,全株中叶片部位的数值最大,说明NaCl胁迫明显降低了根系对Ca2+、K+营养元素的吸收,叶片离子含量受渗透胁迫影响最小.PH4CV根、茎、叶中ωCa2+/ωNa+和ωK+/ωNa+下降幅度更大,表明该品种玉米幼苗的营养元素吸收受到的抑制作用更显著,这与陈勋基等[15]在分析玉米幼苗耐盐性差异时得到的结果一致.
MDA是细胞膜脂过氧化的终产物,其含量高低可反映NaCl胁迫对作物的氧化损伤[16].王婧泽等[17]在研究玉米响应盐胁迫时发现,随着盐浓度的增大MDA含量呈先上升后降低的变化趋势,表明处于盐胁迫下的玉米细胞损伤程度逐渐增大,MDA含量增多,但当玉米细胞膜脂过氧化损伤较严重时,胁迫对玉米幼苗的损伤不可逆转,从而MDA含量降低.本研究中NaCl浓度小于100 mmol/L时,处理组玉米叶片和根系的MDA含量较对照组均明显增加;当NaCl浓度达到100 mmol/L、处理幼苗9 d时,2个品种玉米幼苗的MDA含量总体上低于对照组的数值.比较2个品种,同一培养时间内,相同NaCl胁迫浓度下耐盐品种PH6WC根系和叶片中的MDA含量均低于盐敏感型品种PH4CV中的含量.
为了缓解逆境造成的损伤,植物保护酶系统能够发挥清除ROS的重要作用,SOD、POD是保护酶的重要组成部分[18].吴雪霞等[19]在研究高温胁迫对茄子果皮ROS代谢影响时发现,在高温胁迫下,茄子果皮中POD和SOD活性增强.刘艳丽等[20]的研究结果表明POD活性的增强可以显著提高小麦幼苗的耐盐性.本研究发现,盐胁迫下2个品种根和叶片中的POD和SOD活性均高于对照组的数值,这与吴雪霞等[19]、刘艳丽等[20]的研究结果一致.比较2个品种,同一培养时间内,相同NaCl胁迫浓度下,PH6WC植株中的SOD活性显著高于PH4CV中的数值,POD活性略低于PH4CV中的数值,这说明耐盐品种玉米PH6WC主要是通过提高SOD活性来缓解盐胁迫造成的损伤.
在盐胁迫下,植物体的许多生物机能会受到抑制,其中光合作用对盐胁迫比较敏感.测定叶绿素荧光参数是分析植物光合作用的重要方法,可提供叶片PSⅡ系统和电子传递过程的信息[21].本研究发现随着NaCl浓度的增加,2个品种玉米幼苗的Y(Ⅱ)、ETR(Ⅱ)、qP等主要叶绿素荧光参数均呈下降趋势,NPQ呈上升趋势,相同NaCl处理浓度下,PH6WC叶片的Y(Ⅱ)、ETR(Ⅱ)、qP均大于PH4CV的数值,NPQ小于PH4CV的数值.孙菲菲等[22]发现盐胁迫导致不结球白菜光合色素含量下降,NPQ呈上升趋势,PSⅡ有效光化学量子产量、ETR等呈下降趋势,本研究结果与之一致,说明NaCl处理对2个品种玉米幼苗的光合膜结构造成不同程度的损伤.比较2个品种,PH4CV叶片的光合系统受损更加严重.
总的来看,盐胁迫均能够显著抑制玉米2个品种幼苗的生长,相同处理条件下,耐盐品种PH6WC的生长情况好于盐敏感型品种PH4CV.PH6WC的K+含量、SOD活性较高,MDA的含量相对较低,叶绿素荧光参数Y(Ⅱ)、ETR(Ⅱ)、qP等较大,说明PH6WC可通过降低MDA含量、增加SOD活性和缓解PSⅡ系统所受损伤来缓解盐胁迫对小麦的伤害效应.

