4种中草药单体对嗜热四膜虫生长和凋亡的影响
潘厚军,康佳磊,张德锋,常藕琴,任 燕,王亚军,蒋俊贤,王 琳,石存斌
(中国水产科学研究院珠江水产研究所/农业农村部渔用药物创制重点实验室/广东省水产动物免疫技术重点实验室,广东 广州 510380)
长期以来寄生虫疾病给鱼类养殖造成了巨大的经济损失,且难以得到有效控制。寄生虫侵袭鱼体,不但引起鱼类生长发育缓慢,抵抗力下降,苗种大量寄生时还可直接引起大量死亡,造成较大的经济损失[1]。其中纤毛类寄生虫对鱼类苗种危害尤为严重,例如多子小瓜虫 (Ichthyophthirius multifiliis) 感染,死亡率可高达90%,甚至造成“全军覆灭”。由于寄生虫具有依赖于宿主才能完成其生活史的特性,其离体培养非常困难,这是寄生虫药物筛选的技术瓶颈[1]。
嗜热四膜虫 (Tetrahymena thermophila) 是一种单细胞真核生物,在分类地位上隶属于原生动物门、纤毛纲,因其可在实验室条件下纯培养、具有成熟的分子操作技术和清晰的遗传背景而成为一种被广泛研究的模式生物[2-4]。采用嗜热四膜虫,不仅在细胞和分子生物学方面获得重要成果,在药物研发方面也取得了重要进展,已有部分学者分析了多种药物对嗜热四膜虫生长繁殖、氧化应激、基因表达等方面的影响[5-10],为嗜热四膜虫作为模式生物、筛选抗虫药物奠定了前期研究基础。
研究发现,在鱼类养殖过程中,中草药及其有效成分如青蒿 (Artemisia annua)[11]、大黄 (Rheum palmatum)[12]、黄连 (Coptis chinensis)[13]等的使用不仅可以预防寄生虫病害[14-15],还可以提升鱼体的免疫力[16]和抗氧化性能[17],是控制鱼类寄生虫病药物筛选的宝库。中草药单体是从中草药的根、茎、叶等部位中提取并高度纯化的物质,其化学成分明确,作用机理可循[18-19],是良好的替抗药物的候选。本研究以康奈尔大学惠赠的嗜热四膜虫Cu428.2株为实验对象,研究青蒿素、大黄素、芦荟大黄素、小檗碱 (又名黄连素) 4种中草药单体对Cu428.2虫株增殖、氧化应激指标活性以及细胞凋亡的影响,以期建立利用嗜热四膜虫筛选抗鱼纤毛类寄生虫中草药的方法。
1 材料与方法
1.1 嗜热四膜虫虫株、培养基及试剂
嗜热四膜虫Cu428.2株由美国康奈尔大学惠赠;Neff培养基配方为多价蛋白胨2.5 g,酵母提取物 2.5 g,D-无水葡萄糖 5.0 g,9.0 g·L-1三氯化铁 (FeCl3) 储存液1.0 mL,蒸馏水1 L,121 ℃灭菌30 min,常温保存;总超氧化物歧化酶 (Superoxide dismutase, SOD)、过氧化氢酶 (Catalase,CAT)、丙二醛 (Malonyldialdehyde, MDA) 检测试剂盒购于南京建成生物工程研究所,Hoechst 33258染色试剂盒为上海碧云天生物技术有限公司出品。
1.2 仪器与设备
Elipse Ti数码倒置荧光显微镜 (日本Nikon公司);IC 1000 (Countstar) 细胞计数仪(上海瑞钰生物科技公司);ZWY-200D恒温培养振荡器(上海智诚分析仪器制造有限公司);3K-15高速冷冻离心机 (德国Sigma公司);Infinite M200 Pro多功能酶标仪(瑞士Tecan公司);电子天平(上海舜宇恒平科学仪器有限公司)。
1.3 中草药单体
4种中草药单体详见表1。分别称取中草药单体100 mg,加入10 mL助溶剂二甲基亚砜(DMSO,细胞培养级别,Sigma-Aldrich公司),即刻加入无菌水 90 mL,配成含 1.0 mg·mL-1(1.0 g·L-1) 药液的母液,DMSO体积分数为10% (0.1 mL·mL-1),4 ℃保存备用。使用时加适量培养液稀释至所需浓度。

表1 实验的4种中草药单体Table 1 Four kinds of Chinese herbal monomers used in experiment
1.4 嗜热四膜虫的活化培养
取室温保存的嗜热四膜虫,以5%接种于10 mL Neff培养基中,28 ℃静置培养24~48 h,至对数生长期,再按照培养基总体积的2% (1.0 mL)接种于 49 mL Neff培养基中,28 ℃ 100 r·min-1培养24 h至对数生长初期。
1.5 Hoechst 33 258检测细胞凋亡
取对数生长期的嗜热四膜虫按终密度5.5×104个·mL-1接种于50 mL反应体系的Neff培养液中。设置对照组 (DMSO 20 mg·L-1) 和中草药单体实验组 (质量浓度分别为 2.0、20、200 mg·L-1),于 28 ℃、100 r·min-1摇床培养 48 h 后,10 000 r·min-1离心5 min收集细胞,弃上清。加沉淀2~3倍体积的Hoechst 33258染色液,室温避光培养20 min,2 000 r·min-1离心5 min弃染液。用磷酸盐缓冲溶液 (PBS, pH 7.4) 洗2次,取20 μL细胞悬液滴在载玻片上,加入抗荧光淬灭封片液,并盖上洁净的盖玻片。荧光显微镜紫外光下观察细胞凋亡形态。
1.6 细胞计数与细胞活力测定
1.6.1 药物暴露 对数生长期的嗜热四膜虫按终密度 5.5×104个·mL-1接种于50 mL 反应体系的Neff培养液中,加入死亡率介于0~100% (需经预实验)、按常用对数间距0.2设置6个质量浓度(5.0、8.0、12.5、20、32、50 mg·L-1) 的受试药物及10% DMSO溶剂组,每个浓度组设置3个平行,并设置空白对照 (仅培养基) 及不加药物对照(有培养基、嗜热四膜虫,不加药物),于28 ℃、100 r·min-1的摇床中培养暴露处理24 h,进行细胞计数和CCK-8法细胞活力测定。
1.6.2 细胞计数 取待测的嗜热四膜虫试液,用75%乙醇以1∶1固定,取20 μL加入Countstar计数板,使用Countstar细胞计数仪测定细胞数量,实验重复3次,计算平均值 (±SD)。以中草药单体质量浓度 (mg·L-1) 为横坐标,嗜热四膜虫密度(104个·mL-1) 为纵坐标,绘制嗜热四膜虫密度在不同浓度单体作用下的折线图。同时采用SPSS 20.0软件计算药物对嗜热四膜虫生长的半抑制浓度(IC50)和95%置信区间 (95% CI)。
1.6.3 CCK-8细胞活力 取药物处理后的嗜热四膜虫试液,加入96孔板,每孔加入10 μL的CCK-8试剂混匀,28 ℃培养4 h,使用酶标仪450 nm处测定吸光度 (A)。CCK-8活力计算公式为:细胞活力 (T/C, %)=[(A实验-A空白)]/[(A对照-A空白)]×100%。每个浓度设6个复孔,实验重复3次,计算平均值(±SD)。
参考1.6.2 的方法,以中草药单体质量浓度(mg·L-1) 为横坐标,CCK-8 细胞活力 (T/C, %) 为纵坐标,绘制细胞活力在单体作用下的折线图,同时采用SPSS 20.0软件计算药物对嗜热四膜虫生长的IC50和 95% CI。
1.7 氧化应激指标测试
根据1.6中 IC50的结果,设置50 mL (Neff培养基+中草药单体) 试液体系,质量浓度按等对数间距,4个药物均设置1.25、3.2、5.0、8.0、12.5、20.0、32.0、50 mg·L-1的试液,每个浓度分别设置3个平行,另设置DMSO对照组。移取对数生长期的嗜热四膜虫,按5%的比例至各实验体系中,28 ℃、100 r·min-1摇床培养,即置于有药物的试液中处理4 h,10 000 r·min-1离心10 min,去上清,留沉淀提取嗜热四膜虫细胞,使用PBS洗2遍,在冰上匀浆。4 ℃、3 500 r·min-1离心10 min,将上清液吸出,分装入冻存管 -80 ℃保存备用。使用南京建成生物公司出品的SOD、CAT、MDA检测试剂盒,测定不同浓度中草药单体作用下的酶活力,具体测试方法参照试剂盒说明。
以药物质量浓度 (mg·L-1) 为横坐标,酶活力(U·mg-1) 为纵坐标,绘制嗜热四膜虫的3种酶活力在中草药单体作用下的柱形图。采用 SPSS 20.0软件进行统计处理分析,组间比较采用单因素方差分析 (One-way ANOVA),以P<0.05为差异有统计学意义,分析4种中草药单体对SOD、CAT、MDA的影响。
2 结果
2.1 中草药单体对嗜热四膜虫凋亡的影响
不同浓度的4种中草药单体 (青蒿素、大黄素、芦荟大黄素、小檗碱) 对嗜热四膜虫处理24 h后,经过Hoechst 33258 染色,结果见图1。随着药物浓度的增加,产生强荧光的着色细胞增多,4种中草药单体药物高浓度处理组 (20~200 mg·L-1) 比对照组的细胞着色明显增加,大量嗜热四膜虫的细胞核呈浓染致密、明亮鲜艳的颗粒状荧光。2.0 mg·L-1处理组,除青蒿素外,3种药物的凋亡细胞亦比对照组显著增加,其中青蒿素2.0 mg·L-1处理组凋亡细胞比对照组少。

图1 4种中草药单体对嗜热四膜虫Cu428.2凋亡的影响 (Hoechst 33258试剂染色)A. 青蒿素;B. 大黄素;C. 芦荟大黄素;D. 小檗碱;1、2、3、4示药物质量浓度分别为0、2.0、20、200 mg·L-1。Figure 1 Effect of four kinds of Chinese herbal monomers on apoptotic morphology of T. thermophila Cu428.2 (stained by Hoechst 33258)A. Artemisinin; B. Emodin; C. Aloe-emodin; D. Berberine; 1, 2, 3 and 4 show the monomer concentration as 0, 2.0, 20, 200 mg·L-1; respectively.
2.2 中草药单体对嗜热四膜虫种群增长和细胞活力的影响
将4种中草药单体稀释成不同浓度,分别处理嗜热四膜虫,细胞计数法测得的嗜热四膜虫活细胞密度和CCK-8法测得的细胞活力结果见图2,2种方法计算的IC50结果见表2。CCK-8法与活细胞计数法结果较为一致,随着3种中草药单体 (大黄素、芦荟大黄素、小檗碱) 浓度的增加,采用计数法测量的活细胞密度、CCK-8法测量的细胞活力均降低;而青蒿素在低质量浓度 (5.0 mg·L-1) 增加,质量浓度≥8.0 mg·L-1降低。

表2 活细胞计数法、CCK-8法测得的4种中草药单体对嗜热四膜虫的半抑制浓度Table 2 50% inhibitory concentration (IC50) of four kinds of Chinese herbal monomers to T. thermophila Cu428.2 determined by living cell counting method and CCK-8 test

图2 不同浓度的4种单体作用下嗜热四膜虫Cu428.2株的活细胞密度和CCK-8细胞活力a. 活细胞密度;b. CCK-8细胞活力。Figure 2 Cell Density and CCK-8 Cell viability of T. thermophila Cu428.2 at different concentrations of four kinds of Chinese herbal monomersa. Living cell density; b. CCK-8 cell viability.
IC50结果为:采用细胞计数法,抑制作用由强到弱依次为芦荟大黄素>大黄素>青蒿素>小檗碱;采用CCK-8法,亦为芦荟大黄素>大黄素>青蒿素>小檗碱;而数值大小略有不同。结果表明,2种方法测得的数据趋势一致而数值有一定差别。结合2种方法评估中草药单体对嗜热四膜虫的作用较好。
2.3 中草药单体对嗜热四膜虫酶活力的影响
嗜热四膜虫经中草药单体处理4 h后,SOD、CAT、MDA酶活力测定结果见图3。结果表明,在1.25~50 mg·L-1的药物浓度范围内,随着药物浓度的增加,SOD活性先升高后降低;而CAT有升高趋势,MDA有降低趋势。表明该4种中草药单体对此3种酶活力指标的影响具有一致性,而具体在某一浓度下对某种酶的活力影响有所不同。
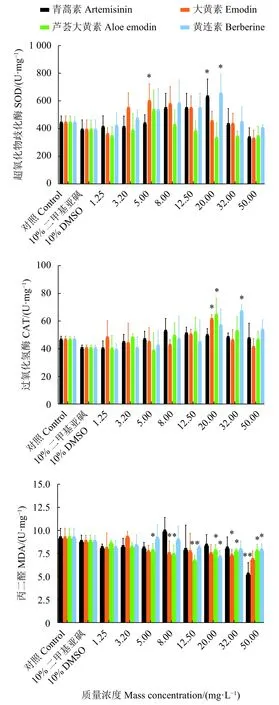
图3 嗜热四膜虫Cu428.2在4种中草药单体分别处理后超氧化物歧化酶、过氧化氢酶、丙二醛活力*. 与对照组差异显著 (P<0.05);**. 与对照组差异极显著 (P<0.01)。Figure 3 SOD, CAT and MDA activity of T. thermophila Cu428.2 after treatment of four kinds of Chinese herbal monomers*. The difference is significant with the control group (P<0.05); **. The difference is extraordinary significant with the control group (P<0.01).
3 讨论
随着水产养殖中大量化学药物的使用,水体环境污染愈发严重,也增强了寄生虫的抗药性。开发绿色环保、无污染、无抗性的中草药防治鱼类养殖中的病害刻不容缓。中草药单体成分明确、效应明显,是今后中草药应用的方向之一。青蒿素、大黄素、芦荟大黄素和小檗碱均是中草药单体物质,前人的研究显示其有抗虫效应,如青蒿素对疟原虫[20-21]、血吸虫[21]和球虫[21]有效,大黄素对疟原虫[22]、芦荟大黄素对利什曼原虫[23]和疟原虫[24]有效,小檗碱除对利什曼原虫[25]有效外还对多种原虫和蠕虫有效[15]。本研究同时分析4种单体对嗜热四膜虫的效应,结果表明,青蒿素、芦荟大黄素、小檗碱、大黄素等4种中草药单体对嗜热四膜虫增殖的影响有剂量效应关系,在一定浓度下可致嗜热四膜虫凋亡,具有抑制生长的作用,与钩吻碱(Koumine,断肠草里提取的一种生物碱)[9]对嗜热四膜虫的效应有类似之处。有意思的是,青蒿素在低浓度时有促进生长的作用,可能在低浓度时其作为培养基营养成分起了主要作用,这与柴小翠等[26]报道的低浓度竹节参 (Panax japonicus) 能促进生长的分析相似。
本研究主要采用Hoechst染色、细胞计数法和CCK-8法3种不同的方式进行实验,以探究4种中草药单体对嗜热四膜虫的抑制生长效应。Hoechst染料具特异性强、荧光性能强、实验方式快捷的优点,试剂穿过细胞膜与DNA相结合进行染色,当细胞发生凋亡时,染色质固缩,在荧光显微镜下观察,凋亡细胞的细胞核呈浓染致密的颗粒状荧光,或呈碎块状致密浓染,发出强烈蓝色荧光,与背景形成鲜明对比。凋亡细胞与活细胞对比明显,从而可以直观地分析药物在一定浓度范围是否有凋亡作用。嗜热四膜虫的计数方法以往是固定后采用血细胞计数板,人为误差较大且较烦琐,本研究采用Countstar细胞计数仪,成像后采用电脑直观计算细胞数量,可减少人为误差,且快捷方便。CCK-8法是一种WST-8在电子耦合试剂存在的情况下,被线粒体内的脱氢酶还原生成高度水溶性的黄色甲瓒产物 (Formazan dye),生成的甲瓒物颜色深浅与活细胞数量成正比,因而可以采用酶标仪定量分析,是一种灵敏度较高、重复性好的细胞活性检测方法,适合在分析药物对细胞增殖影响、细胞活性检测等实验中应用[27]。CCK-8法步骤较为简单,相对于细胞计数法更客观、稳定性更强,是一种较为理想的测试药物对嗜热四膜虫影响的研究方法。本研究采用3种不同的实验方法,对4种中草药单体处理后嗜热四膜虫的影响进行评估,在Hoechst荧光染色形态观察的基础上进行细胞计数和CCK-8实验,获得中草药单体的IC50数据,准确可行。本研究表明,在中草药单体作用下,嗜热四膜虫随着药物浓度的变化,用细胞计数法和CCK-8实验分别获得的活细胞数和细胞活力呈现相同的趋势;获得的IC50具有一致性,但数据有所区别。笔者认为,CCK-8法更为客观,必要时结合细胞计数法分析则更为可靠。
为探究嗜热四膜虫凋亡的机理,本研究分析了中草药单体对嗜热四膜虫氧化应激的影响。已有研究表明,这4种中草药单体对动物抗氧化作用有显著影响[28-31]。SOD、CAT和MDA是生物体和细胞内3种重要的氧化应激指标,其中SOD和CAT是生物体内极其重要的抗氧化酶,能清除超氧阴离子自由基 (),具有非常大的破坏作用,能够引起细胞死亡和器官衰老,SOD被认为是防卫伤害的第一步,它可以将转化为毒性较低的H2O2[32];而CAT可进一步将H2O2转化为H2O和O2,保护细胞免受损伤[33]。MDA是生物体或细胞内一种脂质氧化的产物,反映脂质氧化的水平[34]。本研究的4种中草药单体对嗜热四膜虫SOD活性的影响,相较于对照组,基本为先升高后降低的趋势,与潘厚军等[7]报道的苯甲酸钠、廖苑辰等[35]研究的氧化石墨烯对嗜热四膜虫SOD的影响均为低浓度促进、高浓度抑制的结果相似,具有剂量效应关系,原因亦为低浓度刺激了嗜热四膜虫致SOD活力增强,而高浓度使细胞产生毒害致自由基清除能力下降;本研究与在钩吻碱[9]和百草枯[36]作用下嗜热四膜虫SOD活性均升高的结果有所差异,可能是因为嗜热四膜虫对不同药物在不同浓度下的氧化应激适应性有所差异所致。本实验中草药作用后,CAT含量有升高趋势,与有机紫外防晒剂[37]、抗菌剂三氯生[38]对嗜热四膜虫CAT的影响一致,而与抗菌剂三氯卡班[38]不同。单体作用于嗜热四膜虫后,嗜热四膜虫的MDA水平降低,其中芦荟大黄素的效果尤为明显,表明芦荟大黄素能显著降低嗜热四膜虫的脂质水平,这与张莹莹等[39]报道的芦荟大黄素降低小鼠非酒精性脂肪肝模型的血清MDA水平结果一致。
本研究表明,中草药单体可引起纤毛类寄生虫的替代模式生物——嗜热四膜虫凋亡,对嗜热四膜虫增殖和凋亡的影响具有剂量效应关系。为解决寄生虫离体培养困难而致抗虫中草药筛选的瓶颈问题,本研究探讨了体外应用嗜热嗜热四膜虫的途径。中草药在鱼类寄生虫的防控实践中是否有效,仍有待进行鱼体临床试验。本研究结果为抗鱼寄生虫中草药大通量筛选的体外技术提供了可能途径。
4 结论
采用Hoechst 33258染色在荧光显微镜下观察,浓度为20~200 mg·L-1的青蒿素、大黄素、芦荟大黄素、小檗碱等4种中草药单体可引起嗜热四膜虫凋亡;中草药单体对嗜热四膜虫Cu428.2株的增殖具有抑制效应,采用CCK-8法与活细胞计数法测得的IC50较为一致;在单体浓度为1.25~50.0 mg·L-1,随着药物浓度的升高,CAT有升高趋势,而MDA活性有降低趋势,SOD先升高后降低。研究结果可为应用嗜热四膜虫筛选抗寄生虫中草药平台技术的建立提供方法。

