三维重建技术在肺裂发育不全肺癌患者中的应用
刘艳虎,薛 栋,李亚东
(南京医科大学第二附属医院胸外科,南京 210011)
肺癌是目前全球癌症相关死亡的主要原因,非小细胞肺癌约占肺癌的85%,其5 年生存率约20%[1]。自20 世纪90 年代以来,胸腔镜手术开始兴起并逐渐取代了传统的开胸手术,但肺癌患者围术期并发症发生率仍高达24.9%~36.3%[2]。肺叶间裂发育不全常合并血管、支气管解剖变异,不仅会对肺部疾病的病程产生影响,且会增加手术难度[3]。有学者[4]证实叶间裂发育不全会延长术后拔管及住院时间且会增加围术期心肺并发症的发生率。三维计算机断层扫描支气管血管成像(three-dimensional computed tomography bronchial angiography,3D-CTBA) 可精准显示肺血管、气管是否存在变异,为手术操作提供精确指导。对需行手术治疗的非小细胞肺癌患者行3DCTBA 会对术后并发症产生何种影响仍缺乏相应文献。本研究回顾性分析2018 年10 月—2020 年10月南京医科大学第二附属医院收治的202例肺裂发育不全非小细胞肺癌患者的临床资料,探讨3DCTBA 在胸腔镜下肺叶切除术中的应用价值。
1 对象与方法
1.1 研究对象 共纳入胸腔镜肺叶切除手术治疗的非小细胞肺癌患者202例,根据术前是否行3DCTBA 分为两组,2018 年10 月—2019 年12 月术前未进行3D-CTBA 处理116例为A 组,2020 年1月—2020 年10 月行术前3D-CTBA 86例为B 组。纳入标准:(1)可手术的原发性非小细胞肺癌。(2)行单肺叶切除术+淋巴结清扫术。(3)肺裂发育评分≥1 分。排除标准:(1)中转开胸患者。(2)术前接受新辅助治疗的患者。(3)既往胸、腹部手术史。本研究经南京医科大学第二附属医院医学伦理委员会审查批准。
1.2 CT 检查方法 两组患者均采用Siemens Somatom Definition FLASH CT 机进行检查。患者取双手抱头仰卧位,静脉团注碘海醇60~70 mL,流速为2~2.5 mL/s,延迟扫描时间为30~35 s。扫描参数为:管电压120 kV,有效管电流100~150 mA,准直器厚度0.6 mm,重建层厚1 mm。使用DeepInsight 软件进行后期处理,显示肺动脉、肺静脉、气管支气管树(图1)。
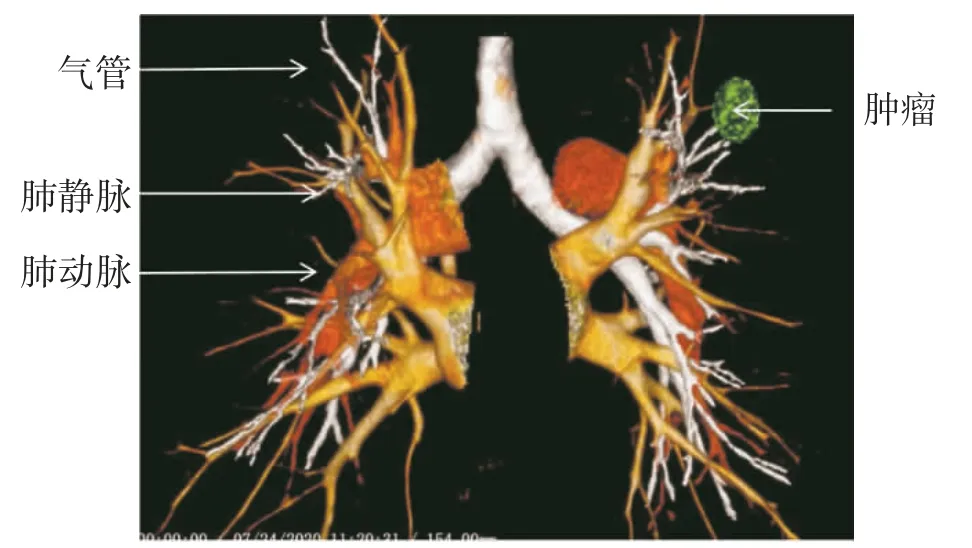
图1 使用DeepInsight 软件重建后肺脏气管、血管及肿瘤位置三维图像
1.3 肺裂的完全性评价方法 由两名具有中级职称胸外科专业医师使用裂隙发育评分系统[5]独立量化术中肺裂发育程度。如意见不统一,则由具有高级职称的第3 位胸外科医师进行一致评估,术中对肺裂评分进行再次确认。0 级,完全发育,肺叶分离良好计0 分;1 级,肺裂完整性>70%计1 分;2 级,肺裂完整性30%~70%计2 分;3 级,肺裂完整性<30%计3 分。
肺裂作为一种重要的解剖学因素,可分为上斜裂(右/左)、下斜裂(右/左)和水平裂(右)(图2)。实施胸腔镜肺叶切除术前至少需要解剖分离两个裂隙。因此,利用裂隙总和平均值,即两条解剖的裂隙发育得分的平均值,来确认是否达到入组标准。
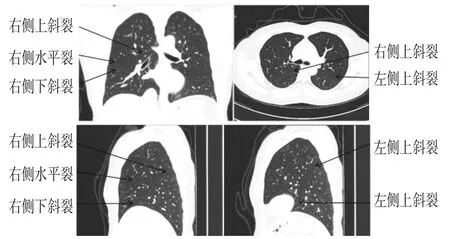
图2 肺裂在轴位、冠状面及矢状面位置图
1.4 病理分期方法 根据国际癌症控制联盟(International Union Against Cancer,UICC)TNM 分类(第8版),评估肿瘤侵袭(T)和淋巴结转移(N 病理参数)等。
1.5 术后疼痛评分方法 术后疼痛评分采用数字评定量表(numeric rating scale,NRS):0 表示无痛,10表示最痛,要求患者选择最能代表其疼痛强度的数字。
1.6 手术方法 全麻双腔气管插管,健侧卧位,单肺通气。选择腋中线第7 肋间1.5 cm 切口作胸腔镜观察孔;腋前线4 肋间3.0 cm 切口为主操作孔;腋后线后8 肋间2.0 cm 切口为副操作孔。采用单向式理念进行肺叶切除术,在肺叶根部由浅及深依次解剖游离出血管和支气管,使用内镜下切开缝合器闭合离断,最后处理肺裂。然后进行系统性淋巴结清扫,纵隔淋巴结清扫时注意保护迷走神经分支及膈神经,无明确胸导管损伤时不结扎胸导管。进行肺上叶切除术时不松解下肺韧带。
1.7 术后管理 腋中线第7 肋间切口放置24 号胸腔引流管1 根。术后使用芬太尼静脉镇痛泵1 μg/mL持续镇痛24 h。预防性使用头孢呋辛钠,术中、术后各1.5 g,使用24 h。如出现持续发热≥38 ℃,则依据药敏试验结果调整抗生素。术后6 h 进食,术后1 d下床活动并进行深呼吸、吹气球、咳嗽等肺康复锻炼。术后第1 天常规进行床边胸片拍摄。胸管拔管指征:胸腔引流量<200 mL/d,无肺漏气表现,胸片证实肺复张完全。出院标准:拔除胸腔引流管后无发热,无明显胸闷,两肺听诊呼吸音正常。
1.8 观察指标(1)一般资料:性别、年龄、体质量指数(body mass index,BMI)、吸烟史、肿瘤位置、肿瘤分期,基础疾病包括高血压、哮喘、冠状动脉粥样硬化性心脏病(以下简称冠心病)、慢性阻塞性肺疾病(chronic obstructive pulmoriary disease,COPD)、糖尿病;(2)术中变量:肺裂评分、胸膜粘连、术中出血量及手术时间;(3)围术期并发症:肺部感染、肺不张、皮下气肿、咯血、血胸、乳糜胸、支气管胸膜瘘、切口感染、心律失常;(4)术后疼痛评分、术后胸腔引流管留置时间及住院时间。
1.9 统计学方法 采用SPSS 22.0 软件进行数据处理。正态分布计量资料以表示,采用成组t 检验;非正态分布计量资料以中位数(median,M)和四分位数间距(interquartile range,IQR)表示,采用Mann-Whitney U 检验;计数资料以例(%)表示,采用χ2检验或Fisher 确切概率检验;P<0.05 为差异有统计学意义。
2 结果
2.1 基线资料及基础疾病比较 两组患者基线资料及基础疾病比较差异均无统计学意义(均P>0.05),见表1。
表1 两组患者基线资料与基础疾病的比较(n,%,)
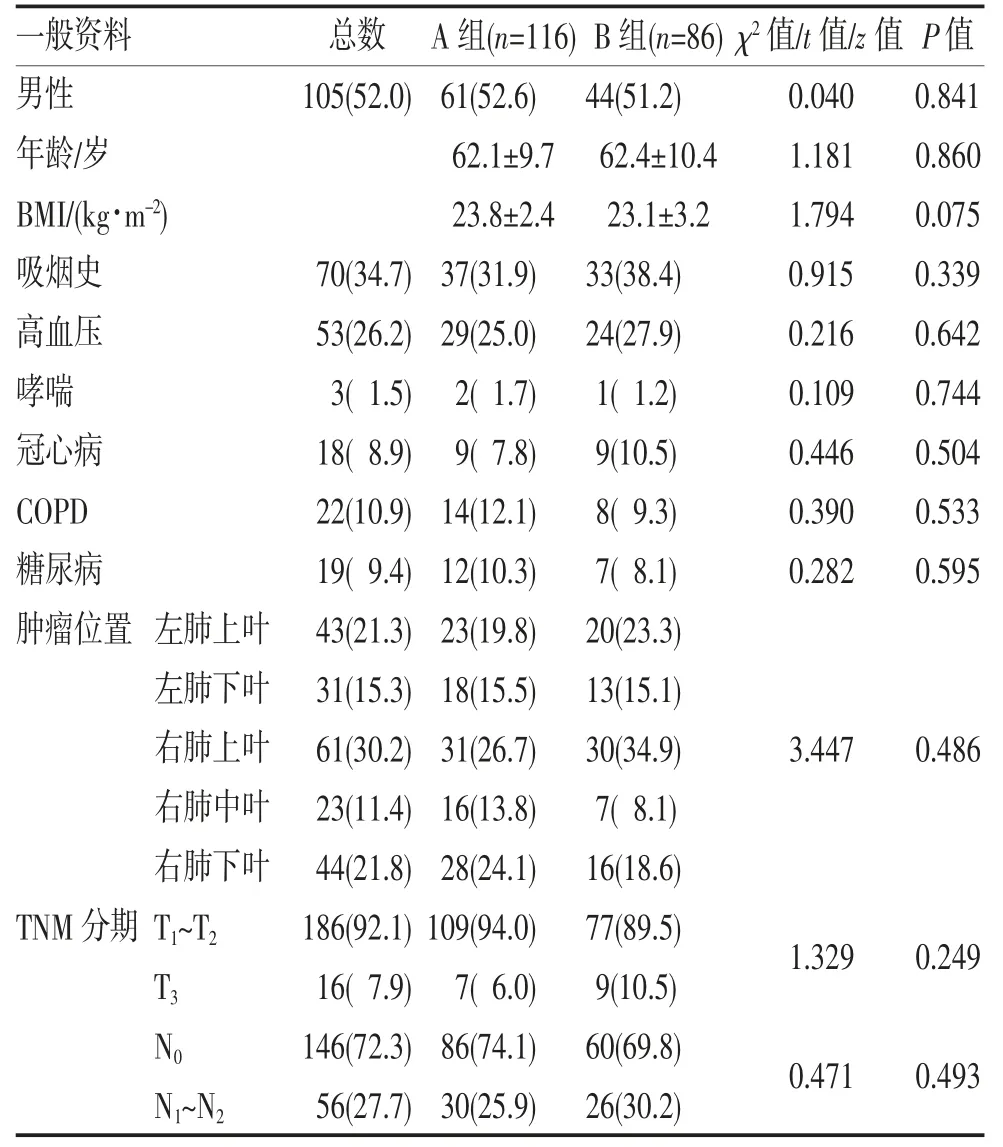
表1 两组患者基线资料与基础疾病的比较(n,%,)
2.2 术中、术后变量比较 两组肺裂评分及胸膜腔粘连发生率差异均无统计学意义(均P>0.05),A 组手术时间、术中出血量、胸腔引流管留置时间及住院时间均显著多于B 组(均P<0.05),见表2。
2.3 并发症比较 两组患者肺部感染、肺不张、心律失常差异均有统计学意义(均P<0.05),余变量差异均无统计学意义(均P>0.05),见表3。
表2 两组患者术中、术后变量比较(M,IQR,n,%,)
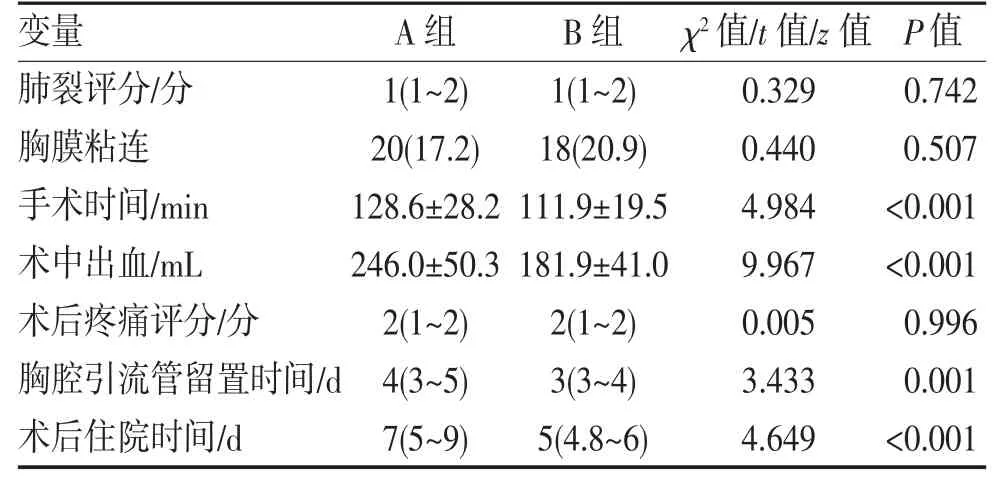
表2 两组患者术中、术后变量比较(M,IQR,n,%,)
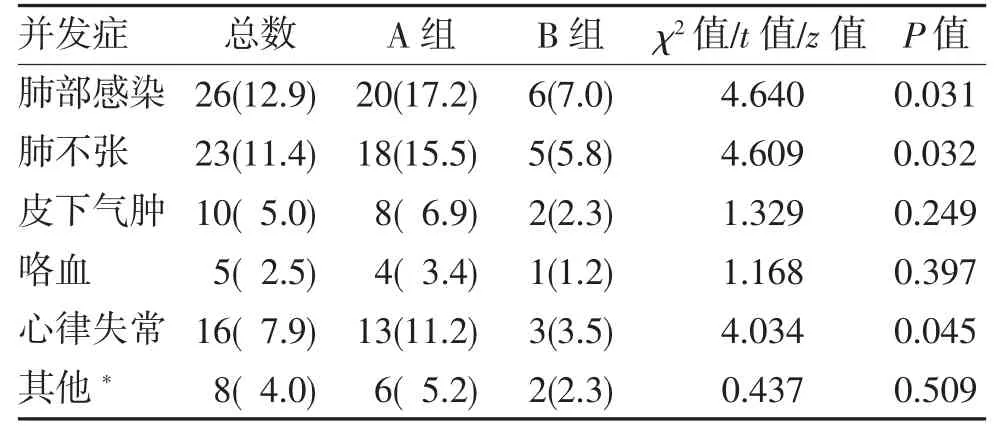
表3 两组患者并发症发生情况比较(n,%)
3 讨论
3D-CTBA 用于指导肺部手术已在临床广泛开展[6-9],该技术通过对肺血管、支气管的重建,可以更安全地行胸腔镜肺叶切除术和肺段切除术,但在肺叶间裂发育不全手术中的应用报道尚少。叶间裂是肺叶间分界的重要标志,经常存在变异[10]。有研究[4]表明肺裂发育程度是非小细胞肺癌胸腔镜肺叶切除术患者术后并发症发生率的一个很好的分类预测因子,其不全程度与胸腔引流时间延长和胸腔镜肺叶切除术后住院时间显著相关。
本研究对胸腔镜下行肺叶切除术的非小细胞肺癌患者术前进行3D-CTBA 检查,并进行模拟肺叶切除,实现了术中肺段动脉、静脉及支气管的精准解剖离断,结果证实3D-CTBA 肺血管、支气管重建为肺裂发育不全患者的手术提供了帮助,具有重要临床意义:(1)更加精准的血管、气管离断。2013—2015年荷兰肺外科审计报告的胸腔镜中转开胸手术率为8.8%~10.9%,主要原因为肺血管损伤,占29%[11]。由于肺部血管解剖结构存在许多变异,依据术前三维重建的规划进行模拟手术,术中能更精确识别需要离断的血管和支气管[12-13],减少了误判带来的血管损伤导致出血量增加的风险。本研究中A 组术中出血量显著高于B 组(P<0.05)。(2)模拟手术提高了手术效率,缩短了手术时间。术前三维重建使精确模拟手术简单易行,制定个体化的手术路径,术中手术操作步骤更具有目的性,减少了因解剖变异等原因导致的过度解剖、血管误断。在叶间裂发育不全手术中如果出现血管、气管辨识困难时多需要使用能量器械解剖发育不全的肺裂,因而导致术后肺泡胸膜瘘发生率增加,增加了术后肺不张、肺部感染发生率。这种情况多会导致胸腔引流管留置时间和术后住院时间延长;术中出血量、手术时间及术中对心肺牵拉及挤压与术后心律失常有关[14]。本研究中两组在肺部感染、肺不张、心律失常、术后胸腔引流管留置时间及住院时间上差异均有统计学意义(均P<0.05)。
综上所述,肺裂发育不全患者术前行3D-CTBA可缩短手术时间、减少术中出血量、降低术后并发症发生率,更加符合当前快速康复外科的围术期管理理念;肺裂发育不全患者术前行3D-CTBA 方法简单、安全、可行、且不增加患者的经济负担,值得临床推广。本研究的局限是目前样本量还偏小,且为单中心研究,需进行大规模的队列研究来进一步验证。

