益肾化湿颗粒对脓毒症急性肾损伤大鼠肾功能及炎症因子和自噬凋亡相关蛋白的影响
张 敬,王 燕,侯雅楠,罗梦醒,杜立建
(1. 河北中医学院研究生院,河北 石家庄 050090;2. 河北中医学院护理学院,河北 石家庄 050200;3. 河北北方学院,河北 张家口 075000;4. 石家庄市中医院,河北 石家庄 050051)
脓毒症是由感染导致的全身炎症反应综合征,如果干预不及时,会导致器官功能障碍。急性肾损伤在脓毒症早期较为常见,发生率为55%~73%[1-2],大约70%的感染性急性肾损伤是致命性的[3]。因此,保护肾脏是改善脓毒症预后的关键。益肾化湿颗粒是治疗慢性肾小球肾炎的中成药制剂,沈文清等[4]研究发现该药可改善慢性肾脏病患者微炎症和氧化应激状态。刘秀艳[5]报道益肾化湿颗粒可以通过降低白细胞介素-6(IL-6)及肿瘤坏死因子-α(TNF-α)水平改善尿毒症患者微炎症状态,保护残存肾功能。本研究通过建立脓毒症急性肾损伤大鼠模型,观察肾功能、炎症因子及自噬凋亡相关蛋白表达情况,探讨了益肾化湿颗粒对脓毒症引起急性肾损伤的保护作用及可能作用机制,旨在为临床中脓毒症急性肾损伤的治疗提供理论参考。
1 实验材料与方法
1.1实验动物 雄性 SD大鼠32只,体重 (240±10)g,购自河北医科大学实验动物中心,动物合格证编号:SCXK(冀)2018-004。大鼠饲养环境:温度(23±2)℃,12 h的光照/黑暗循环,自由饮食、饮水,适应环境1周后进行实验。实验程序和实验方案均按照动物实验伦理原则执行,并经河北医科大学动物实验委员会批准。
1.2实验药物及试剂 益肾化湿颗粒(广州康臣药业有限公司生产,规格:10 g×9袋)。根据药理试验中动物与人体间的等效剂量换算方法,计算出益肾化湿颗粒高剂量为150 mg/(kg·d)、低剂量为100 mg/(kg·d)。白细胞介素-1β(IL-1β)、IL-6、TNF-α qPCR试剂盒(美国promega公司) ,总RNA提取试剂盒(Biotek, Winooski, VT, USA),BCA蛋白浓度检测试剂盒(北京索莱宝公司);LC3抗体、p-Akt抗体、Beclin-1 抗体、Caspase-3 抗体、Akt 抗体及GAPDH 抗体(Cell Signaling Technology公司);脂多糖(LPS,Sigma-Aldrich公司);PE Annexin V Apoptosis Detection Kit I(美国 BD 公司);其他所用生化试剂均为国产分析纯。
1.3实验方法 将32只大鼠随机分为对照组、模型组、益肾化湿颗粒低剂量组、益肾化湿颗粒高剂量组,每组8只。除对照组大鼠腹腔注射生理盐水外,其余组大鼠均腹腔注射LPS(溶解于生理盐水)10 mg/kg建立脓毒症急性肾损伤模型,以血肌酐(SCr) 水平增加到对照组的2倍时为建模成功。建模成功后,益肾化湿颗粒低、高剂量组分别给予益肾化湿颗粒100 mg/(kg·d)和150 mg/(kg·d)灌胃,对照组和模型组给予等量的生理盐水灌胃,均每天1次,连续3 d,实验过程中各组大鼠自由饮水与进食。
1.4观察指标及方法
1.4.1血尿素氮(BUN)及SCr水平 灌胃结束后,各组大鼠背侧尾静脉取血, 采用全自动生化分析仪(TC6010 L, 江西泰康科技股份有限公司),以苦味酸法测定SCr水平,以尿素酶法测定BUN水平。
1.4.2肾组织形态学观察 各组大鼠经戊巴比妥钠注射液(50 mg/kg)腹腔注射安乐死,取肾脏组织,采用4%多聚甲醛固定24 h,常规方法脱水,然后浸蜡、包埋、切片,HE染色,在光学显微镜下观察肾脏组织的病理学形态,每张切片随机选取5个视野拍照记录。
1.4.3肾组织中IL-1β、IL-6、TNF-α mRNA表达检测 取各组大鼠肾脏组织50~60 mg,用总RNA提取试剂盒提取总RNA,使用ScanDrop 100 (AnalytikJena, Thuringia, Germany)测定器测定mRNA浓度。取OD260/OD280比值在1.8~2.0间的mRNA样品,反转录成 cDNA,将 cDNA 放于荧光定量 PCR 仪扩增。采用 Primer 5. 0 软件设计引物,引物序列:IL-1β上游为5’-AAATACCTGTGGCCTTGGGC-3’,下游为5’-CTTGGGATCCACACTCTCCAG-3’,引物长度101 bp;IL-6上游为5’-GAGTCCTTCAGAGAGATACAG-3’,下游为5’-CTGTGACTCCAGCTTATCTG-3’,引物长度125 bp;TNF-α上游为 5 ’-GTCTCAGCCTCTTCTCATTC-3’,下 游为5 ’-CATAGAACTGAT GAGAGGGA-3’,引物长度128 bp。反转录成功后,使用qPCR试剂盒,采用SYBR®Green I方法进行RT-PCR检测。以β-actin作为参照基因,用对照组进行校准,参照Applied Biosystems公司提供的Comparative Ct(ΔΔCt)方法计算目的基因的相对表达量(2-ΔΔCt)。
1.4.4肾组织中LC3、Beclin-1、Caspase-3及p-Akt蛋白表达检测 采用Western blot方法检测:取各组大鼠肾脏组织50~60mg,放入匀浆器里在冰上匀浆,加入蛋白裂解液,冰上放置 60 min,4 ℃、12 000 r/min离心30 min,取上清液,用BCA蛋白浓度检测试剂盒定量检测。取30 μg蛋白样品,用10%SDS-PAGE电泳分离,90 V转移1~2 h至PVDF膜,然后放进封闭液里37 ℃条件下静置2 h,加入TTBS稀释的一抗(LC3 1∶1 000,Beclin-1 1∶1 000, Caspase-3 1∶500,p-Akt 1∶1 000,Akt 1∶1 000,GAPDH 1∶1 500),4 ℃冰箱中过夜。TTBS洗膜5 min×3,加入用1 mL TTBS稀释的过氧化物酶所标记过的二抗,37 ℃ 1.5 h,TTBS洗膜10 min×3,TBS洗膜5 min×1。用Odyssey成像系统进行显色并分析所得数据。
1.5统计学方法 所有数据应用SPSS Statistics 17.0统计软件进行统计分析,计量资料呈正态分布,多组间比较采用方差分析,两个均数比较采用SNKq检验,P<0.05为差异有统计学意义。
2 结 果
2.1各组大鼠血清BUN、SCr水平比较 实验过程中,模型组有2只、益肾化湿颗粒低剂量组有1只大鼠死亡。模型组、益肾化湿颗粒低剂量组、益肾化湿颗粒高剂量组大鼠血清BUN、SCr水平均明显高于对照组(P均<0.05),益肾化湿颗粒低、高剂量组均明显低于模型组(P均<0.05),且益肾化湿颗粒高剂量组均明显低于益肾化湿颗粒低剂量组(P均<0.05)。见图1及图2。
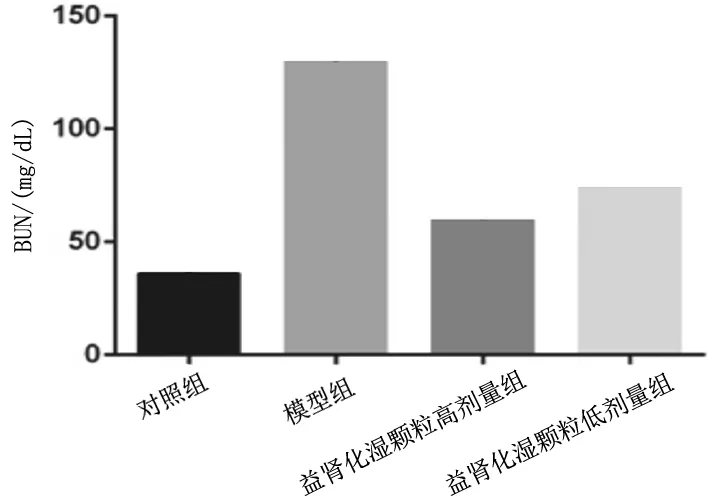
图1 对照组和脓毒症急性肾损伤各组大鼠血清BUN水平

图2 对照组和脓毒症急性肾损伤各组大鼠血清SCr水平
2.2各组大鼠肾组织病理形态 对照组大鼠肾脏组织结构完整且清晰,间质中未发现明显的炎性细胞浸润,肾小管上皮细胞胞质染色均匀,细胞核居中,没有发现明显的变性及坏死;模型组大鼠肾小管结构破坏,大量肾小管上皮细胞发生变性及坏死,间质中有较多的炎性细胞浸润;益肾化湿颗粒低、高剂量组大鼠肾脏组织损伤程度较模型组轻。见图3。
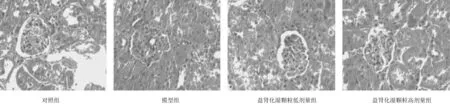
图3 对照组和脓毒症急性肾损伤各组大鼠肾组织HE 染色表现(×200)
2.3各组大鼠肾组织中IL-1β、IL-6、TNF-α mRNA表达情况 模型组大鼠肾组织中IL-1β、IL-6、TNF-α mRNA表达量均明显高于对照组(P均<0.05),益肾化湿颗粒低、高剂量组均明显低于模型组(P均<0.05),且益肾化湿颗粒高剂量组均明显低于益肾化湿颗粒低剂量组(P均<0.05)。见图4。
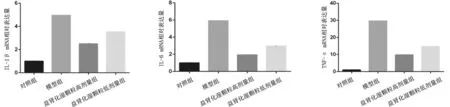
图4 对照组和脓毒症急性肾损伤各组大鼠肾组织中促炎细胞因子mRNA表达情况
2.4各组大鼠肾组织中自噬相关蛋白表达情况 模型组大鼠肾组织中LC3-Ⅱ/ LC3-Ⅰ及Beclin-1、Caspase-3、p-Akt表达量均明显高于对照组(P均<0.05),益肾化湿颗粒低、高剂量组均明显低于模型组(P均<0.05),且益肾化湿颗粒高剂量组均明显低于益肾化湿颗粒低剂量组(P均<0.05)。见图5。
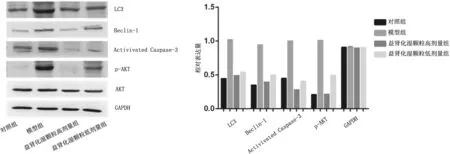
图5 对照组和脓毒症急性肾损伤各组大鼠肾组织中自噬相关蛋白表达情况
3 讨 论
脓毒症是由于宿主对感染的调节失常引起的,是急性肾损伤的首要因素,约占重症监护病房急性肾损伤病例的50%左右[6],脓毒症幸存者慢性肾脏病发生率也较高[7]。病理生理学研究表明,炎症反应参与脓毒性急性肾损伤的发生发展,炎性细胞因子 IL-6 、TNF-α等水平增高可导致死亡风险增加[8]。但由于脓毒症急性肾损伤的发生机制复杂,目前该病仍然没有特效的治疗方法。
中医学中没有与“脓毒症”相关的病名,根据其临床表现多将其归属于“伤寒”“温病”中,早期对于脓毒症的证型分析多为热毒内蕴、瘀血互结,随着对脓毒症研究的深入,扶正固本成为治疗的关键。急性肾损伤虽然在中医学中也无记载,但其尿量逐渐减少甚至无尿的临床表现与中医的“关格”“癃闭”“水肿”类似,其病机为本虚标实,脾肾衰败,气、血、水湿代谢平衡失调,导致水湿、痰浊、血瘀内蕴而发本病。益肾化湿颗粒方中人参增补元气,肾为气之本,起到固本的功效;黄芪健脾益气,脾为后天之本,后天充足以滋养先天;白术、茯苓、泽泻配伍利水渗湿、健脾消肿;陈皮、清半夏合用健脾燥湿化痰;白芍养阴柔肝、缓中止痛;羌活、独活、防风合用疏风化湿;黄连清热燥湿、解毒,清除体内瘀积的水湿、毒素;柴胡调畅气机,升举阳气;甘草补脾益气,调和诸药。诸药合用,共同调节机体上、中、下三焦水液代谢,以达益肾健脾、利水消肿之效。现代药理研究表明,人参中人参皂苷Rc可以通过抑制TANK结合激酶1(TBK-1) /干扰素调节因子-3(IRF-3)而减轻炎症反应[9];茯苓多糖可以恢复脾虚大鼠的肠道菌群稳态,增强免疫功能[10];黄芪具有调节机体免疫、抑制炎症反应、清除体内毒素作用[11]。前期研究发现,对于一些慢性肾脏病及脓毒症患者,运用益肾化湿颗粒可下调患者血浆TNF-α、降钙素原(PCT)、C 反应蛋白(CRP)、白细胞介素-10(IL-10)水平[4-5,12-14]。
本实验采用LPS建立脓毒症急性肾损伤大鼠模型,结果模型组大鼠血清 Cr、BUN 水平及肾组织中IL-1β、IL-6、TNF-α mRNA表达量均明显升高,肾小管上皮细胞受损;益肾化湿颗粒低、高剂量组大鼠血清 Cr、BUN 水平及肾组织中IL-1β、IL-6、TNF-α mRNA表达量均明显降低,肾小管上皮细胞受损程度明显减轻。提示益肾化湿颗粒可明显减轻脓毒症急性肾损伤,可下调炎症因子表达,抑制炎症反应。
在脓毒症发病期间,不仅存在大量细胞坏死,同时也伴随着细胞的自噬与凋亡。自噬相关蛋白LC3是自噬体膜的标志蛋白,分为Ⅰ型和Ⅱ型,贯穿自噬体形成的始终,LC3-Ⅱ、LC3-Ⅰ增加提示自噬体形成。已有研究发现,在脓毒症小鼠模型中,敲除关键性的自噬基因 LC3 和 Beclin-1 后,也会影响炎症因子IL-1β、IL-18 的表达,提示自噬在脓毒症发病及炎症反应中起着关键作用[15-16]。Caspase-3 是细胞凋亡的一个必要效应蛋白酶,其可通过作用于细胞凋亡和炎症通路,参与细胞凋亡小体的形成过程。磷酸肌醇3-激酶(PI3K)/Akt信号通路参与调控炎症反应,其主要通过 Akt 的下游蛋白调控炎症介质的表达,如mTOR、GSK-3β、FOXO1等[16-17]。本实验结果显示,模型组大鼠肾组织中LC3-Ⅱ/LC3-Ⅰ及Beclin-1、Caspase-3、p-Akt表达量均明显升高,益肾化湿颗粒低、高剂量组均明显低于模型组。提示益肾化湿颗粒可抑制脓毒症急性肾损伤大鼠肾脏细胞的自噬与凋亡。
综上所述,益肾化湿颗粒可以减轻脓毒症急性肾损伤,保护肾功能,分析与下调炎症因子和自噬凋亡相关蛋白表达,从而抑制炎症反应和肾小管上皮细胞自噬凋亡有关,为临床早期治疗脓毒症急性肾损伤提供了一定理论依据。
利益冲突:所有作者均声明不存在利益冲突。

