基于GEO 数据库筛查小鼠缺血性卒中后心脏组织的差异基因
王 蕊,杨正飞
(宁夏医科大学中医学院,宁夏银川 750004)
缺血性卒中(cerebral infarction,CI)是栓子阻塞血管,使入颅血流量减少,引起脑组织供血障碍,继而出现相应神经功能受损的一类疾病,严重危害人类健康[1-3]。此外,CI 常会诱发其他器官的损害,尤以心脏损害多见,后者表现为心律失常、心肌损害、心电图改变、心肌酶谱异常甚至急性心肌梗死[4-7],进而加重病情,影响患者预后。目前,对CI 后诱发心功能障碍的机制研究较少[8],迄今尚未阐明。因此,本研究从GEO 数据库中获取MCAO 小鼠与Sham 小鼠左心室的基因芯片数据,分析二者存在的差异基因,以期分析缺血性卒中后诱导出现心功能障碍的机制,并为脑卒中相关心功能障碍的治疗提供依据;同时,为其他相关疾病的研究提供思路。
1 资料与方法
1.1 资料来源
以美国国立生物技术信息中心(NCBI)的GEO DataSets 数据库(https://www.ncbi.nlm.nih.gov/pubmed)为检索对象,检索时间截止于2019 年12 月,以“Cerebral infarction and cardiac dysfunction”为关键词进行检索,获取24、72 h 两个时间点MCAO 小鼠与Sham 小鼠左心室中基因芯片数据GSE102558。
1.2 研究方法
下载基因芯片数据GSE102558,并通过R 语言软件进行编程、分析,设定筛选条件logFC 绝对值≥1,校正P<0.05,获取这两个时间点MCAO 小鼠与Sham 小鼠左心室中的差异表达基因;同时,利用R语言软件绘制差异基因的火山图和前20 位差异基因的热图。
1.3 GO 和KEGG 富集分析
利用DAVID 6.8(https://david.ncifcrf.gov/)在线分析工具,对24 h 和72 h 的MCAO 小鼠与Sham小鼠左心室中的差异表达基因进行GO 功能富集分析和KEGG 通路富集分析[9]。其中,以小鼠为物种筛选条件,设置Select Identifier 为“Official Gene Symbol”,List Type 为“Gene List”,选择生物过程、细胞组成和分子功能模块对差异基因进行GO 功能富集分析;同时,选择Pathways 进行KEGG 通路富集分析。最后,运用Omicshare(http://www.omicshare.com/tools/Home/Index/index.html)在线分析工具对富集分析结果进行可视化。
2 结果
2.1 原始数据筛选
本研究为避免如品种、年龄等因素对基因表达的干扰,故根据小鼠品系、鼠龄、分组以及取样部位相同的原则对原始数据进行筛选,最终选择8 周龄C57BL/6J 小鼠,取样部位为左心室。经筛选,符合要求的数据显示,Sham-24 h 组、MCAO-24 h 组、Sham-72 h 及MCAO-72 h 组均具有6 个样本数据;具体样本数据信息见表1。

表1 样本数据信息Tab 1 Sample data information
2.2 差异基因筛选
对原始数据进行整理,将缺血24 h 和72 h 的数据按Sham 组和MCAO 组进行分组,使用R 语言软件对整理的数据进行一致性评价,选择相关系数>0.9 的样本,确保准确检测到缺血性卒中诱导后出现心功能障碍的差异基因;对Sham 组及MCAO 组数据进行分析后,发现缺血后24 h 和72 h 的Sham 组和MCAO 组样本数据中差异基因分别有187 个和51 个(图1),图中红色圆点代表上调基因,绿色圆点代表下调基因,黑色圆点代表未变化的基因;分别列出调控最显著的前20 位差异基因及表达值(图2),图中颜色越红代表基因表达值变化越大。结果显示,缺血24 h 变化最显著的前10 位差异基因分别 为 :Nr4a1、Tacc2、Pnpla2、Aplnr、Arrdc2、Map3k6、Itgb6、Cblb、Tuba4a 和Bnip3;缺血72h 变化最显著的前10 位差异基因分别为:Myh7、Gm12295、Itgb6、C130080G10Rik、Hmgcs2、Cmss1、Lrrc52、Fam107a、Lcn2 和Aplnr。其中,Aplnr、Itgb6两个基因在24 h 与72 h 均发生变化。
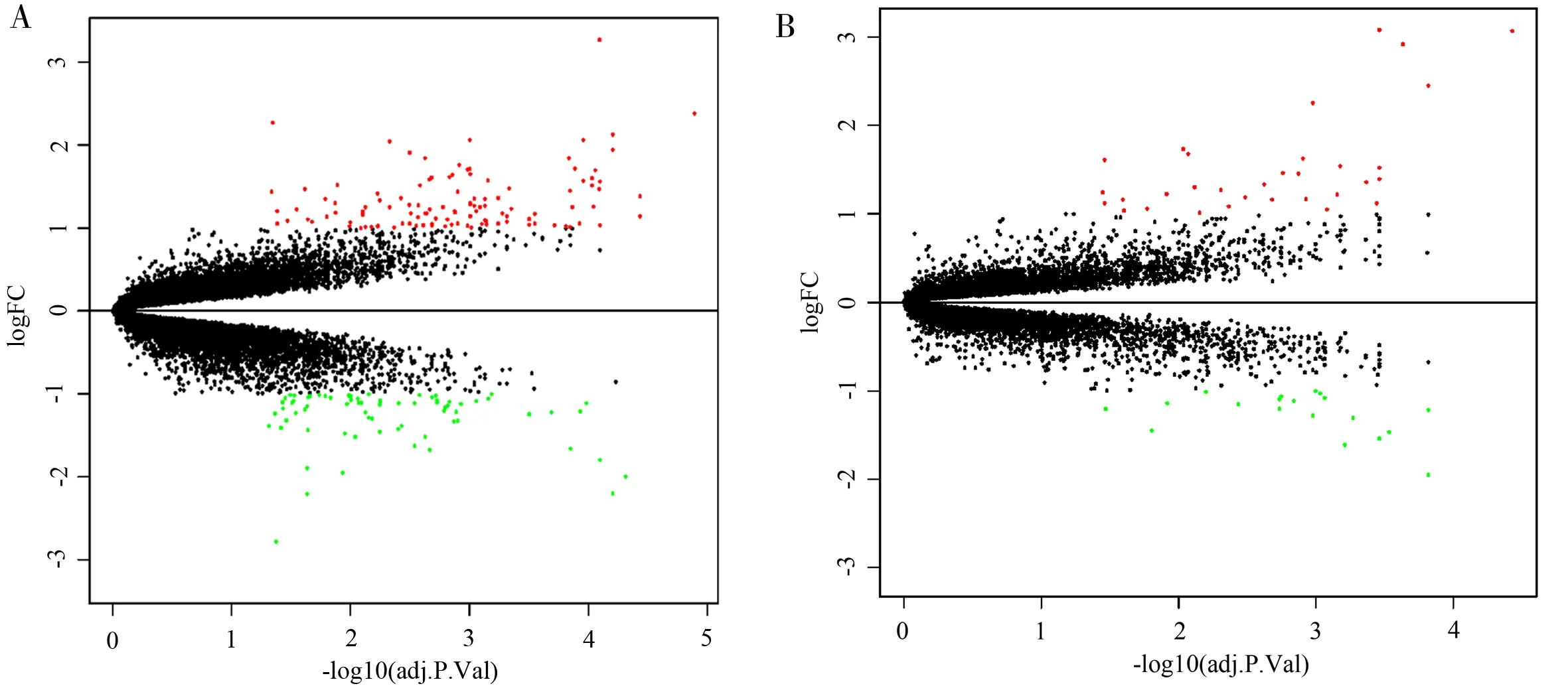
图1 差异基因的火山图Fig 1 Volcanic map of differential genes

图2 前20 位差异基因的热图Fig 2 Heat map of the first 20 differential genes
2.3 GO 功能富集分析
对24、72 h 缺血性卒中诱导后出现心功能障碍的差异基因影响的生物过程、细胞组成和分子功能,运用DAVID 6.8 在线分析工具对差异基因进行GO 功能富集分析后,得出具体结果如下:
在缺血后24 h,得到100 个GO 条目,筛选P<0.05 作为显著性富集,得到56 条具有显著意义的条目:在生物过程方面,有30 条(53.57%)显著富集条目,涉及整合素介导的细胞黏附负调控、胶原纤维组织、细胞死亡的正向调节及细胞凋亡过程的负调节等;在细胞组成方面,有11 条(19.63%)显著富集条目,主要涉及线粒体膜、细胞外基质及细胞质等;在分子功能方面,有15 条(26.78%)显著富集条目,主要涉及转录调节区序列特异性DNA 结合、转录因子活性及转录因子结合等。
在缺血后72 h,得到23 个GO 条目,筛选P<0.05 作为显著性富集,得到14 条具有显著意义的条目:在生物过程方面,有9 条(64.28%)显著富集条目,涉及活性氧的种类代谢过程、肌肉收缩、细胞基质附着力、自噬细胞死亡、整合素介导的信号通路及程序性细胞死亡的正向调节等;在细胞组成方面,有4 条(28.57%)显著富集条目,主要涉及MHCⅡ类蛋白复合物、蛋白质的细胞外基质、质膜外侧的锚定成分和膜锚定成分;在分子功能方面,有1 条(7.14%)显著富集条目,主要涉及整合素结合。结果见图3。

图3 前10 位GO 功能富集Fig 3 Top 10 of GO function enrichment
2.4 KEGG 通路富集分析
运用DAVID 6.8 在线分析工具对差异基因进行KEGG 通路富集分析,得出具体结果如下。
缺血后24 h,共富集到9 条通路,筛选P<0.05作为显著性富集,得到5 条显著富集通路,主要涉及的信号通路是癌症中的小RNA、生理节律、HTLV-I 感染、PI3K-Akt 信号通路和化学致癌性。
缺血后72 h,共富集到4 条通路,筛选P<0.05作为显著性富集,得到3 条显著富集通路,主要涉及的信号通路是PI3K-Akt 信号通路、酮体的合成与降解、细胞外基质-受体相互作用。
运用Omicshare 在线分析工具对富集分析结果进行可视化,结果见图4。
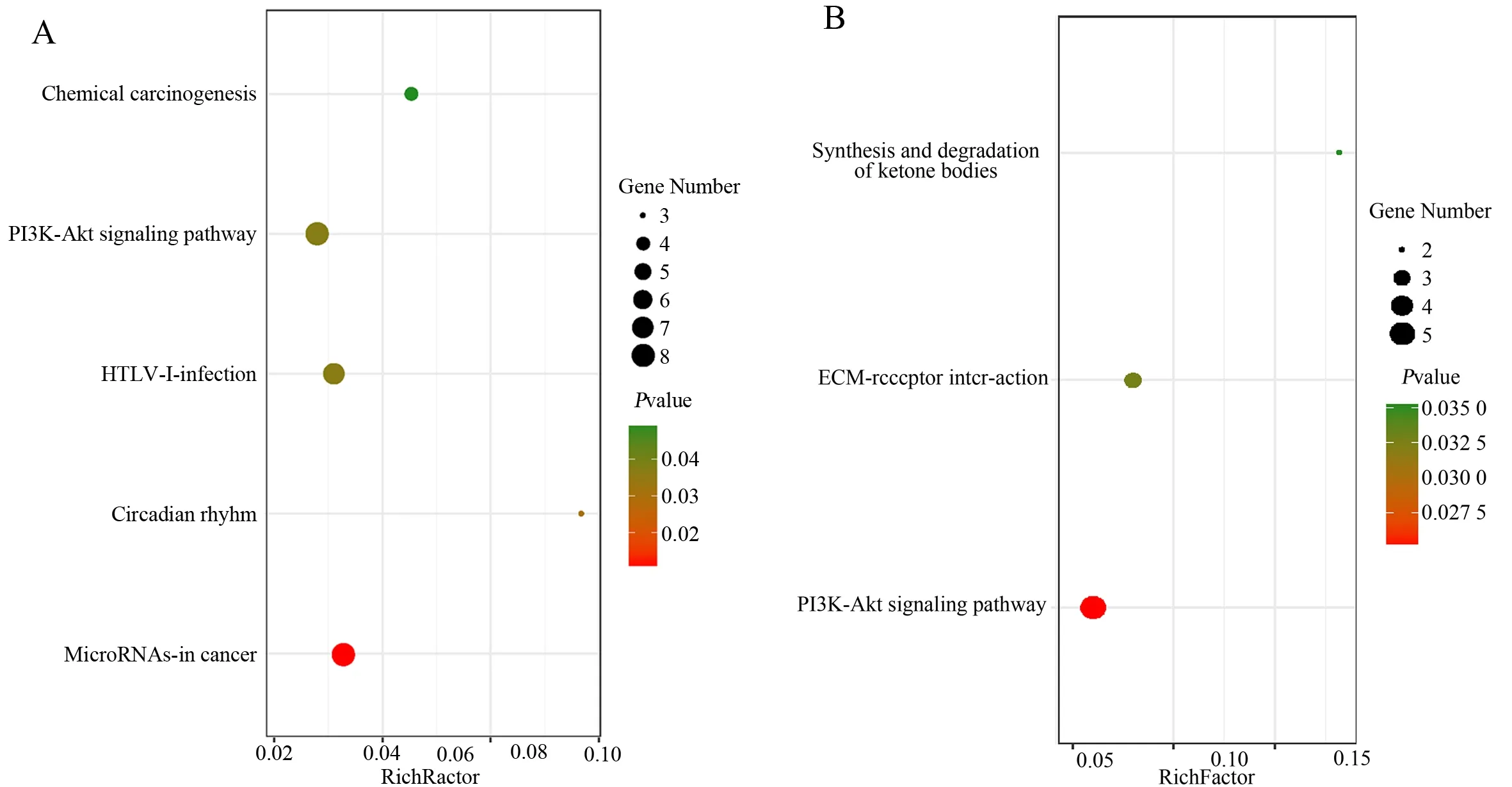
图4 差异基因的KEGG 通路富集分析Fig 4 KEGG pathway enrichment analysis of differential genes
3 讨论
自1937 年,Dozzy 首次对脑血管病可伴心脏功能障碍进行报道以来,越来越多的学者证实了脑血管病可导致心肌损害,出现心肌酶升高、心律失常、心肌损伤及急性心肌梗死等临床表现,即出现脑心综合征[5]。目前,随着脑梗死患者越来越多,脑心综合征的发病率已占所有急性脑梗死患者的78.3%[10],并成为脑卒中患者急性期猝死的主要原因[11],但由于其机制尚不清楚,临床上只能对症处理,故疗效差,治疗上较被动[12]。因此,对缺血性卒中后诱发心功能障碍的机制进行研究将成为今后重要的研究课题。
本研究利用公共数据库(GEO),获得缺血性卒中后诱发心功能障碍的差异表达基因及相关通路。结果表明:随着脑缺血时间的延长,在缺血后24 h和72 h,会出现不同的差异表达基因,其中,Aplnr、Itgb6 两个基因在24 h 与72 h 均发生差异表达。Aplnr 是一个典型的G 蛋白偶联受体,是apelin 的唯一受体,存在于冠状动脉和肺血管的内皮细胞和平滑肌细胞以及心肌与多区域的脑组织中;Aplnr 主要通过G 蛋白的亚基(Gαi 或Gαq)来介导信号,Gαi有助于PI3K/AKT 的活化和ERK 的激活,Gαq 有助于PLCβ/PKC 的激活;在心肌与脑组织缺血、缺氧早期,会促进Aplnr 的表达,从而通过激活PI3K/AKT 和ERKs 信号通路抑制细胞凋亡和促进血管新生[13]。Itgb6 可调节扩散、迁移、细胞外基质降解等细胞基本功能[14]。对差异基因做进一步的GO 功能富集与KEGG 通路富集发现,脑缺血的不同时间段会引起心脏发生不同的生物学功能及信号通路改变,而PI3K-Akt 信号通路是两个时间段都会涉及的共同信号通路,因此,可以预测出PI3K-Akt 信号通路为缺血性卒中后诱导出现心功能障碍的主要通路。在PI3K-Akt 信号通路中,磷脂酰肌醇3-激酶(PI3K)广泛存在于心肌细胞,参与生理病理过程,如细胞凋亡、坏死,细胞自噬,细胞存活与分化等[15],PI3K 分为Ⅰ类、Ⅱ类和Ⅲ类,其中,Ⅰ类在多种通路中发挥作用。蛋白激酶B(Akt)是一种广泛存在于人体各组织中的丝氨酸/苏氨酸蛋白激酶,存在Akt1、Akt2 和Akt3 三种亚型[16],其中,Akt1 和Akt3 广泛表达于人体细胞,Akt2 主要在肝脏和骨骼肌等组织中表达[17,18],而Akt 被认为是PI3K-Akt 信号通路的关键。研究表明,PI3K-Akt 信号通路可通过多种机制调节心血管功能[19],如Sun 等[20]研究发现,PI3K-Akt 信号通路具有心脏保护作用,激活PI3K-Akt 信号通路,可改善心肌损伤,并抑制心脏肥大的发生;Ogita 等[21]通过实验发现,激活PI3K-Akt 信号通路可改善冠状动脉灌注、心脏收缩及心肌代谢功能。因此,PI3K-Akt 信号通路与心脏功能调节密切相关,主要通过影响心肌细胞存活、增殖、凋亡以及心肌细胞能量代谢及调节,血管再生等方面,实现对心脏的调节作用。当发生脑梗死时,脑部血流量减少,引起脑水肿,损害岛叶皮质及皮质下联合纤维,使血液中儿茶酚胺的含量增加,也可通过影响神经、体液等多方面因素影响心脏功能,从而引起脑心综合征[22]。同时,本研究预测结果得出:缺血性卒中后通过影响PI3K-Akt 信号通路的心脏调节作用,引起心脏功能障碍。
综上所述,缺血性卒中后诱导出现心功能障碍的机制主要涉及PI3K-Akt 信号通路。当心肌持续缺血时,该通路对抑制心肌细胞凋亡和减缓心功能恶化速度等方面具有积极的作用[23]。因此,研发调控PI3K-Akt 信号通路的相关药物,可能是治疗缺血性卒中后诱导出现心功能障碍的重要方向。

