两种高浓度静注人免疫球蛋白中IgA 残留量检测方法的验证及比较
刘勇,李泽秀,唐良玉,邓靖,张尧,余雨蓉,陈云华,赵学梅
贵州泰邦生物制品有限公司,贵州贵阳550025
静注人免疫球蛋白(human immunoglobulin for intravenous injection,IVIG)是治疗原发性免疫缺陷病、继发性免疫缺陷病和自身免疫性疾病(原发性血小板减少症、川崎病)的有效药物[1-4]。目前,国内上市的IVIG 制剂为IVIG(pH4),蛋白浓度为50g/L(5%IVIG),以糖类作为稳定剂。高浓度IVIG 是采用层析工艺开发的新一代 IVIG 制剂[5],蛋白浓度为 100 g /L(10%IVIG),以氨基酸类作为稳定剂,国内暂无产品上市。目前,10%IVIG 的研发已成为血液制品行业的焦点[6-7]。
选择性IgA 缺乏症(selective immunoglobulin A deficiency,SIgAD)是指患者血清 IgA 低于 0.05 g /L,IgG 和IgM 含量正常,是免疫缺陷中最常见的类型,占原发性免疫缺陷病的60%以上。IgA 缺乏型患者可能因使用含IgA 的IVIG 制剂而产生抗-IgA,当再次输入该类制品时可产生严重的过敏反应,甚至危及生命,因此,严格控制IVIG 中IgA 残留量具有重要的临床意义[8-9],国外如Octaphama 公司内部标准要求 IVIG 制品 IgA 残留量 ≤ 200 μg / mL[10]。
《中国药典》三部(2020 版)已增加IVIG 中IgA残留量检测要求,检测方法包括紫外-可见分光光度法、酶联免疫法和散射比浊法 3 种[11]。10% IVIG 较5%IVIG 蛋白浓度高1 倍,更应关注制品中IgA 的残留量。目前,紫外-可见分光光度法中所用抗人IgA 血清试剂批间质量尚存在一定的差异,为加快10%IVIGⅢ期临床样品IgA 残留量检测方法的建立,本研究对酶联免疫法和散射比浊法进行验证及比较。
1 材料与方法
1.1 供试品 高浓度IVIG 由贵州泰邦生物制品有限公司生产。
1.2 主要试剂及仪器 人IgA 测定试剂盒购自美国Immunology Consultants Laboratory,Inc 公司(ICL);人脑脊液IgA 测定试剂盒购自德国Siemens Healthcare Diagnostics Products GmbH 公司;IgA 国际标准品(批号:67 / 086,规格:100 IU / 支,1 IU = 14.2 μg)购自NIBSC;全波长酶标仪购自美国赛默飞公司;BN Pro-Spec®全自动蛋白分析仪购自德国Siemens Healthcare Diagnostics Products GmbH /西门子公司。
1.3 检测方法
1.3.1 酶联免疫法 取ICL 试剂盒中样品稀释液进行5 倍稀释,配制成样品稀释液,并将样品 / 标准品按需求进行稀释。取100 μL 标准品 / 样品,室温孵育 30 min;洗涤液洗板 3 次,加入 100 μL 酶标工作液,避光孵育30 min;洗涤液洗板3 次,加入100 μL TMB 显色液,避光孵育 10 min;加入 100 μL 终止液,酶标仪450 nm 测定A 值,A450值与浓度进行四参数拟合,得到标准曲线,计算IgA 残留量。
1.3.2 散射比浊法 IgA 试剂盒内定标液、质控品、检测试剂、检测辅助试剂按要求进行复溶,放入仪器指定位置;供试品经0.45 μm 微孔滤膜过滤后,取2 mL 滤液置于试管中,装载上机检测IgA 残留量。
1.4 方法的验证
1.4.1 线性与范围
1.4.1.1 酶联免疫法 将ICL 试剂盒内标准品按照试剂盒说明书用样品稀释液倍比稀释,按1.3.1 项步骤检测,验证线性与范围。
1.4.1.2 散射比浊法 将试剂盒内定标品装载至全自动蛋白分析仪上,建立标准曲线方法,仪器自动按预设比例倍比稀释,验证线性与范围。
1.4.2 准确度 采用加标回收率法。取复溶后的标准品溶液,分别稀释至 6、12 和 18 μg / mL;将 10%IVIG 原液稀释至浓度分别约为 6、12 和 18 μg / mL,作为供试品。将对应浓度的标准品和供试品按体积比1 ∶1 混合,分别制成3 个浓度水平的加标混合溶液,每个浓度制备3 份,分别采用酶联免疫法和散射比浊法进行测定,按下式计算回收率,验证方法的准确度。
回收率(%)=(加标供试品测定浓度-供试品测定浓度)/标准品理论浓度× 100%
1.4.3 重复性 分别采用酶联免疫法和散射比浊法测定平行制备的6 份10% IVIG,并计算RSD,验证方法的重复性。
1.4.4 中间精密性 不同试验员于不同时间独立采用酶联免疫法和散射比浊法分别测定平行制备的6 份 10% IVIG 的 IgA 残留量,并计算 RSD,验证方法的中间精密性。
1.4.5 专属性 取同一批次的2 份10%IVIG 样品,分别采用酶联免疫法和散射比浊法测定,样品1 直接测定IgA 残留量,样品2 添加甘氨酸浓度至20 g / L再测定IgA 残留量,各平行测定3 次,并计算RSD,验证方法的专属性。
1.5 两种方法的比较 取3 批10% IVIG,分别采用酶联免疫法和散射比浊法测定样品中的IgA 残留量,每个样品平行制备3 份。
1.6 委外检测比对 试制7 批次10% IVIG 的Ⅲ期临床试验药物,完成公司自检后,委托中国食品药品检定研究院检测IgA 残留量,进行比对分析。
1.7 统计学分析 应用SPSS 25.0 软件进行统计学分析,组间比较采用独立样本t 检验,以P < 0.05为差异有统计学意义。
2 结 果
2.1 方法的验证
2.1.1 线性与范围
2.1.1.1 酶联免疫法 IgA 浓度在2.5~800 ng/mL范围内,以IgA 标准品A450值和浓度做四参数曲线拟合,IgA 与A450呈良好的线性关系,相关系数r 为0.999 96。见图1。
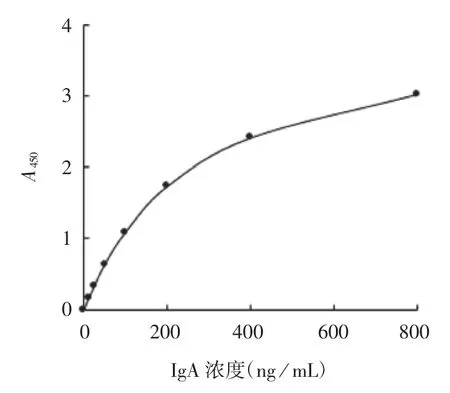
图1 酶联免疫法标准曲线Fig.1 Standard curve of ELISA
2.1.1.2 散射比浊法 以IgA 的浓度0.261~8.35mg/L与散射光强度值求得直线回归方程,标准曲线均值偏差为0.56%,见图2。
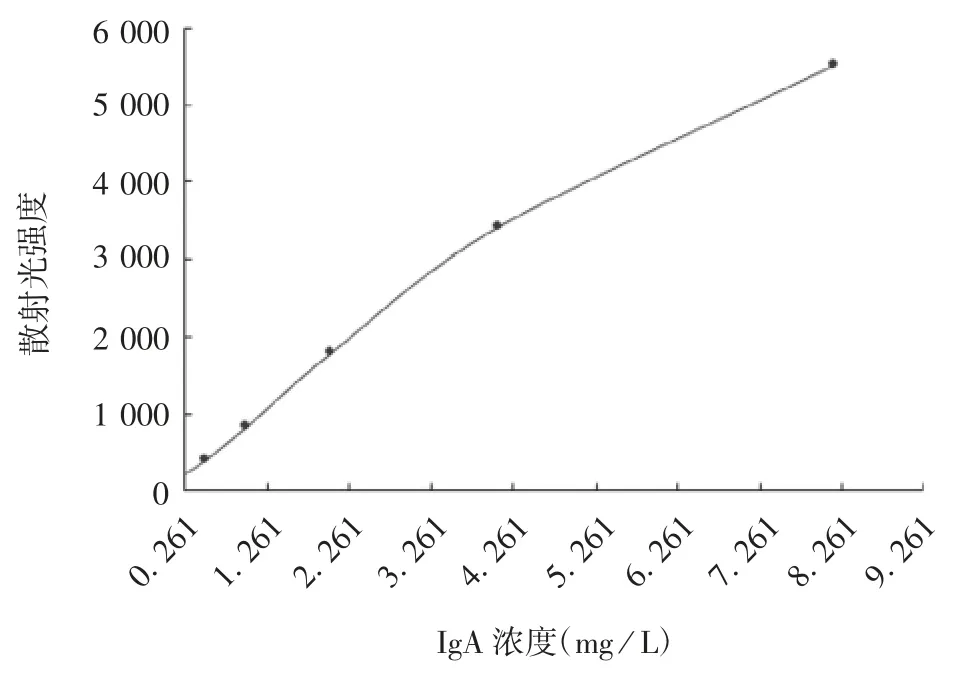
图2 散射比浊法标准曲线Fig.2 Standard curve of nephelometry assay
2.1.2 准确度 酶联免疫法和散射比浊法测定不同浓度水平样品的平均加标回收率(n = 9)分别为103.32%和89.82%,见表1。表明两种方法受样品基质影响小,能够准确测定10%IVIG 中IgA 的残留量。

表1 两种方法的回收率测定结果Tab.1 Determination results of recoveries by two methods
2.1.3 重复性 酶联免疫法和散射比浊法重复测定10%IVIG IgA 残留量的RSD 分别为4.90%和5.05%,均小于8%,见表2。表明两种方法重复性良好。
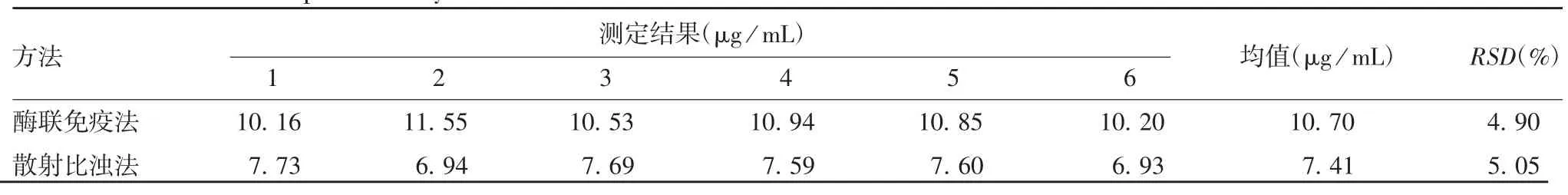
表2 两种方法的重复性验证结果Tab.2 Verification for reproducibility of two methods
2.1.4 中间精密性 酶联免疫法和散射比浊法测定10% IVIG IgA 残留量的RSD 分别为5.88%和5.42%,均小于8%,见表3。表明两种方法中间精密性良好。
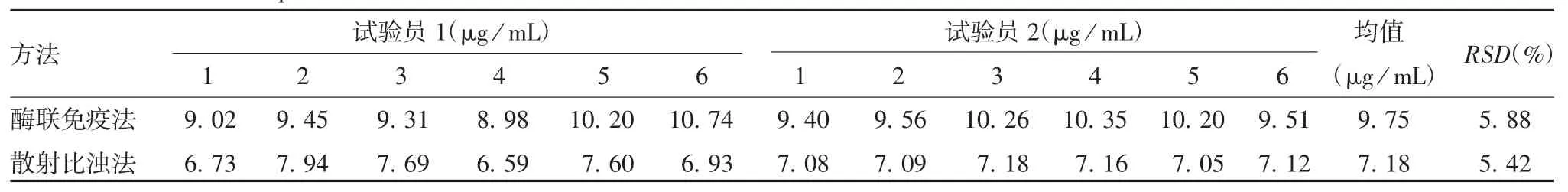
表3 两种方法的精密性验证结果Tab.3 Verification for precision of two methods
2.1.5 专属性 酶联免疫法和散射比浊法测定结果的均值分别为 9.38 和 7.28 μg / mL,RSD 分别为6.14%和4.3%,见表4。表明甘氨酸辅料对IgA 检测干扰较小。

表4 两种方法的专属性验证结果Tab.4 Verification for specificity of two methods
2.2 两种方法的比较 酶联免疫法与散射比浊法相比,测定IgA 残留量偏高,两种方法平行测定的结果稳定性良好,两种方法检测结果差异无统计学意义(t = 1.311,P = 0.260)。见表 5。
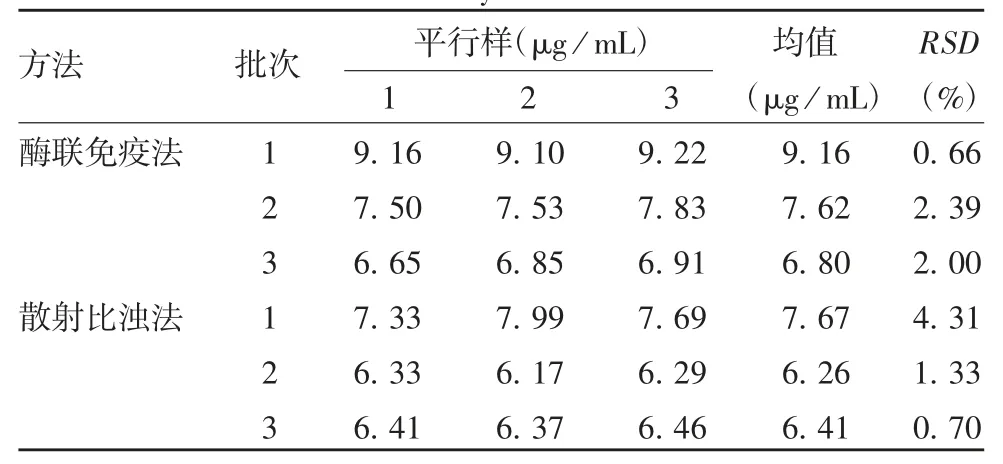
表5 两种方法检测结果的比较Tab.5 Determination results by two methods
2.3 委外检测结果 委外检验10% IVIG 的IgA 残留量略低于企业自检结果,见表6。
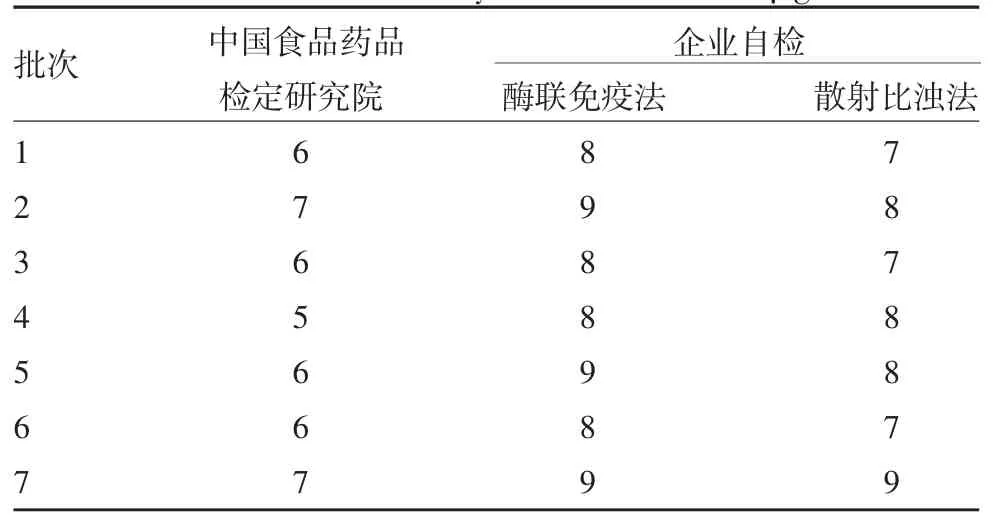
表6 委外检测与企业自检结果比对(μg / mL)Tab.6 Determination results by two laboratories(μg / mL)
3 讨 论
本研究通过酶联免疫法和散射比浊法检测10%IVIG 中IgA 残留量,并验证两种检测方法的线性范围、准确度、重复性、中间精密性、专属性均符合药典要求,两种方法的检测结果差异无统计学意义(P >0.05),但酶联免疫法较散射比浊法检测结果略高,这可能与供试品IgA 含量较低有关,有一定的误差,今后需进一步深入研究。
采用两种方法检测试制7 批次的高浓度IVIGⅢ期临床试验药物中的IgA 残留量略高于中国食品药品检定研究院检测结果,这可能与不同实验室采用的检测试剂盒、仪器不同有关,后续还需进行多批次对比分析。高浓度IVIGⅢ期临床试验药物中的IgA 残留量远低于 200 μg / mL。
已有研究报道国内厂家已上市的IVIG(pH 4)IgA均值约 150 μg / mL,部分厂家接近 400 μg / mL[12]。IgA 是IVIG 中重要的安全性指标,本研究检测的新型高浓度IVIG 中杂蛋白IgA 含量极低,能有效降低副作用,临床使用更加安全[9]。
《中国药典》三部(2020 版)中规定的3 种测定方法原理均是基于IgA 与相应的抗体特异性结合,与酶联免疫法和散射比浊法所用的包被IgA 特异性抗体的酶标板和颗粒不同,紫外-可见分光光度法使用的试剂是抗人IgA 血清(应为全血清经一定纯化技术分离制得的特异性抗体),而目前国内抗人IgA血清试剂批间质量尚存在一定差异,因此暂未系统地开展该方法验证。
酶联免疫法具有简便、快速、灵敏、精确等优点而被广泛使用,更易于实验室操作[13];散射比浊法所使用的全自动蛋白分析仪更多地应用于医疗机构临床检验,检测时间短于酶联免疫法,但对于IgA 含量较低的IVIG 检测时需使用人脑脊液IgA 测定试剂盒,费用相对较高。《中国药典》三部(2020 版)规定,首次采用本法检测供试品中IgA 残留量时,应根据不同样品基质及IgA 残留量的水平选择适宜的测定方法,并进行相应的验证[11]。
综上所述,本研究结果表明,酶联免疫法和散射比浊法均可用于高浓度IVIG 中IgA 残留量的质量控制,基于检测费用成本考虑,同时多批次酶联免疫法检测结果略高于散射比浊法,参考风险评估原则,企业对于IgA 含量极低的10% IVIG 中IgA 残留量进行放行检测时,更推荐使用酶联免疫法。此外,参考《中国药典》,企业也可根据研制的10% IVIG 样品基质及IgA 残留量的水平选择适宜的测定方法。

