四价流感病毒裂解疫苗上市后安全性及免疫原性评价
肖艳慧 ,郭雪 ,韩莎莎 ,王圣怡 ,张岷 ,王辰皓 ,阮杰为,罗林云,刘小琴,陈海平
1.中国生物技术股份有限公司,北京100024;2.长春生物制品研究所有限责任公司,吉林长春130012
流行性感冒(influenza)简称流感,是由流感病毒引起的急性呼吸系统疾病,每年可导致全球300 万~500 万的重症病例及29 万~ 65 万呼吸道疾病相关死亡病例[1-2],是人类社会面临的公共卫生健康问题之一。2006 — 2019 年,我国平均每年因流感就诊(门诊急诊)的病例数约为300 万,严重急性呼吸道感染住院病例数约为234 万,呼吸系统疾病超额死亡例数约为9 万[3]。全人群普遍易感流感病毒,其中儿童和患有慢性基础性疾病的中老年人发生重症的风险更高[4-7]。
为减轻流感流行的负担,提高健康相关生命质量[8],每年及时接种流感疫苗是预防流感最经济有效的手段[9-10]。目前,国内批准上市的流感主要有三价灭活流感疫苗、三价流感病毒减毒活疫苗和四价灭活流感疫苗。本研究通过分析2020 年9 月—2021 年6 月贵州、福建、湖南省接种四价流感病毒裂解疫苗[influenza vaccine(split virion),inactivated,quadrivalent,IIV4]人群的血清抗体滴度及接种后不良事件的发生情况,评价该疫苗上市后的安全性及免疫原性。
1 对象与方法
1.1 研究对象 选择2020 年9 月 — 2021 年6 月于贵州、福建及湖南省接种1 剂IIV4、年龄 ≥ 3 岁的人群为研究对象。本研究获得贵州、福建、湖南省疾病预防控制中心相关伦理委员会批准(批准号为:2020013)。入选标准为:①入组当天年龄≥ 3岁;②自愿签署知情同意书并签日期;③能够参加所有计划的随访并遵守所有试验程序;④未接种过当季流感疫苗;⑤测量腋下体温≤ 37.0 ℃。出现以下任一情况不纳入本研究:①有惊厥、癫痫、脑病和精神病等病史或家族史;②对疫苗中任一成分过敏或既往有任何疫苗接种严重过敏史;③患免疫缺陷症、恶性肿瘤治疗期间、接受免疫抑制剂治疗(口服类固醇激素等)、HIV 感染导致的免疫力低下或密切接触的家庭成员中有先天性免疫疾病;④入组前3 个月内注射非特异免疫球蛋白者;⑤入组前3 d患有急性发热性疾病(腋下体温> 37.3 ℃);⑥患有法定传染病;⑦入组前有确诊的血小板减少或其他凝血障碍病史,可能造成皮下注射禁忌;⑧入组前已知或怀疑同时患有严重呼吸系统疾病、急性感染或慢性病活动期;⑨入组前患严重心血管疾病[肺心病、肺水肿、不能经药物控制的高血压(成人收缩压≥160 mmHg 和 / 或舒张压≥100 mmHg)]、严重肝肾疾病、有并发症的糖尿病;⑩患各种严重感染性、化脓性及过敏性皮肤病;11 孕期或哺乳期;12 不同意接种疫苗后1 月内采取有效措施避孕。
1.2 疫苗 IIV4 由长春生物制品研究所有限责任公司生产,疫苗毒种为A/Guangdong-Maonan/SWL1536/2019(H1N1)pdm09-like virus(H1N1)、A / Hong Kong /2671 /2019(H3N2)-like virus(H3N2)、B / Washington /02 / 2019(B / Victoria Lineage)-like virus(BV)、B / Phuket/3073/2013(B/Yamagata Lineage)-like viru(sBY),批号:20200311,有效期至 2021 年 6 月 7 日。
1.3 样本量 根据IIV4 的Ⅲ期临床试验研究结果,假定流感抗体阳转率(P0)为 60%,α 取 0.05,检验效能(1-β)为 0.95,可接受的率差 δ 为-10%,通过NCSS-PASS 11 软件计算样本量为325 人,考虑20%的脱落率,最终研究所需最小样本量为408 人。
1.4 安全性评价 接种IIV4 后留观30 min,并发放日记卡,收集接种后0 ~ 7 d 的不良事件。局部征集性不良事件包括疼痛、硬结、红、肿胀、皮疹、皮肤黏膜等,全身征集性不良事件包括发热、呕吐、腹泻、嗜睡、急性过敏反应等。疫苗接种后的不良事件严重程度按照《预防用疫苗临床试验不良反应分级标准指导原则》(2019 版)进行判定:1 级(轻度)为短时间的不适(< 48 h),无需医疗;2 级(中度)为轻度至中度限制日常活动,不需或仅需少量医疗干预;3 级(重度)为显著地限制日常活动,需日常生活照顾,需医疗,可能需住院;4 级(危及生命)为极度限制日常活动,显著需要日常生活照顾,需医疗和住院。
1.5 免疫原性评价 分别于IIV4 接种前及接种后30 d 经受试者静脉采血5.0 mL,分离血清,委托吉林省疾病预防控制中心采用血凝抑制试验(hemmagglution inhibition test,HI)检测血清抗体水平。抗体阳转定义为接种前HI 抗体滴度 < 1 ∶10,接种后HI 抗体滴度 ≥ 1 ∶40,或接种前HI 抗体滴度 ≥ 1 ∶10,接种后HI 抗体至少4 倍增长;抗体免后保护率为免后抗体滴度≥1 ∶40 的研究对象比率。免疫原性结果需满足以下标准判为有效:①< 60 岁受试者HI 抗体阳转率95%置信区间(CI)的下限必须达到或超过40%,≥60 岁受试者HI 抗体阳转率95%CI 的下限必须达到或超过30%;②< 60 岁受试者HI 抗体保护率95%CI 的下限达到或超过70%,≥60 岁受试者HI 抗体保护率95% CI 的下限必须达到或超过60%;③ < 60 岁受试者中针对每种抗原HI 抗体几何平均滴度(GMT)较接种前增长 > 2.5倍,≥60 岁受试者针对每种抗原的HI 抗体GMT 较接种前增长> 2.0 倍。
1.6 统计学分析 通过Epidata 3.1 软件建立数据库,并进行独立双录入,应用Stata1 7.0 统计学软件进行统计分析。采用描述性分析方法对研究对象年龄、性别、既往病史等人群特征,接种后0 ~ 7 d 的不良事件发生情况,H1N1、H3N2、BV 和 BY 流感抗体的接种后保护率,抗体阳转率,接种前后抗体GMT水平,接种后几何平均增长倍数(GMI),95% CI 进行分析。
2 结 果
2.1 基本情况 410 人完成入组及接种纳入安全性分析,研究期间脱落9 人,401 人纳入免疫原性分析。研究对象的年龄为9~50 岁,中位数为21 岁;身高为134~163 cm,中位数为153 cm;体重为31.5~62.0 kg,中位数为52.4 kg。男性191 名(占47.63%),女性210 名(占比52.37%)。无既往病史为有279 名(占比69.58%),有既往病史的为占122(占比30.42%)。
2.2 安全性 本研究共有410 人完成疫苗接种及安全性观察,接种后0 ~ 7 d 内发生与疫苗接种有关的不良事件共103 例,不良事件总发生率为25.12%,其中局部征集性不良事件发生率为17.62%,以疼痛、硬结、红、肿胀为主,全身征集性不良事件发生率为6.59%,以发热、腹泻、嗜睡为主。不良事件的严重程度以1 级(轻度)为主,研究期间有1 例受试者发生严重不良事件,与疫苗接种无关,见表1。
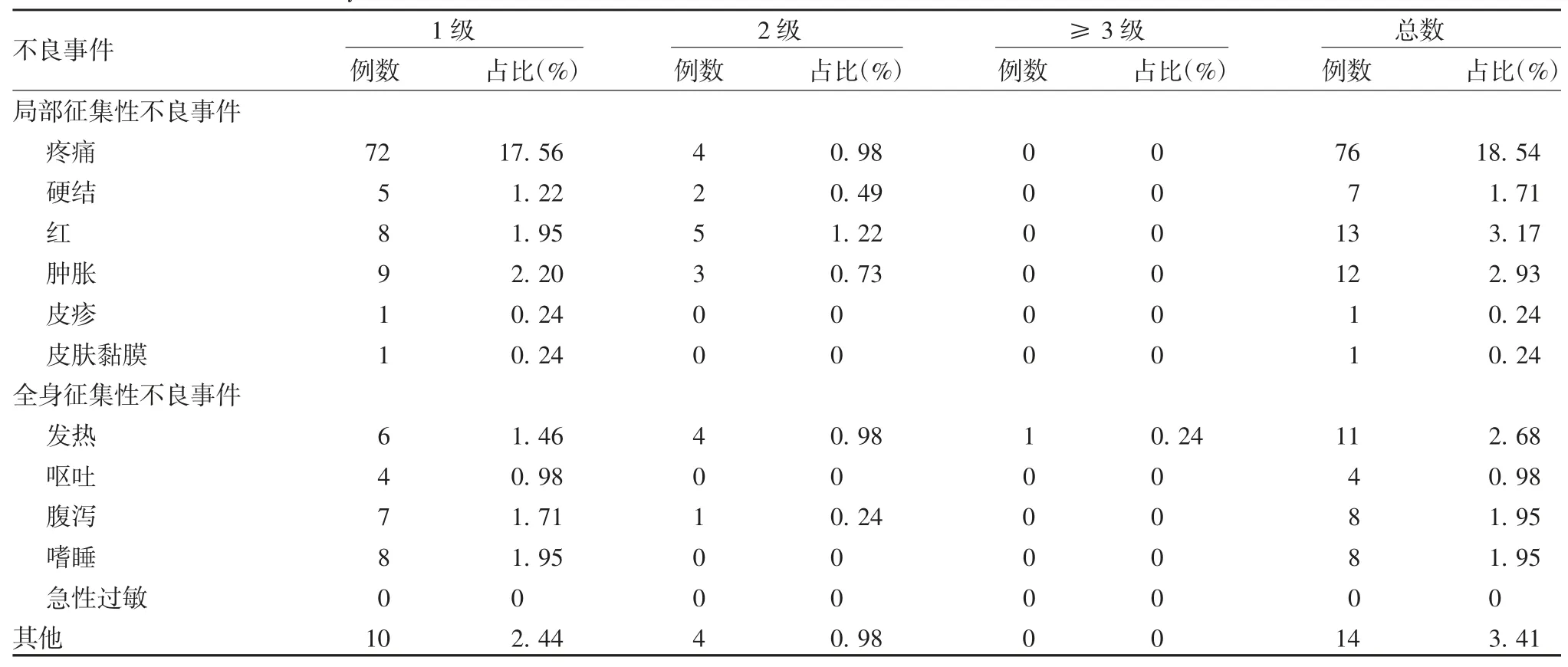
表1 不良事件严重程度分布Tab.1 Distribution of severity of AEs
2.3 免疫原性 H1N1、H3N2、BY 和 BV 抗体阳转率分别为 85.54%、80.05%、64.09%和 69.33%,95%CI 下限均超过40%。接种后保护率分别为97.26%、100.00%、83.04%和 74.81%,95% CI 下限均超过70%。接种前 GMT 分别为 15.02、89.07、11.41 和3.03,接种后 GMT 分别为 227.91、806.81、86.08 和38.76,接种后 GMI 分别为 15.17、9.06、7.54 和 12.77,4 种HI 抗体接种后GMI 均超过2.5。见表2。

表2 免疫原性检测结果(n = 401)Tab.2 Result of immunogenicity test(n = 401)
3 讨 论
接种流感疫苗可有效减少流感相关门急诊、住院和死亡人数,降低治疗费用,尤其在老年人、幼儿、孕妇和患有某些慢性疾病的人群中发挥了重要作用[11]。目前,公共卫生管控措施有效控制新冠疫情的同时,也降低了流感等呼吸道疾病的传播[12]。积极接种流感疫苗可降低流感的危害,也避免了对新冠疫情防控的影响,预防两种呼吸道传染病的交叉感染[13-14]。
本研究结果表明,接种 IIV4 后,H1N1、H3N2、BY和BV 抗体阳转率分别为85.54%、80.05%、64.09%和 69.33%。国内研究显示,H1N1、H3N2、BY 和 BV抗体在全人群中的阳转率分别为87.66%、79.39%、86.77%和 75.19%[15],其中 BY 抗体阳转率较本研究结果高,其他3 种抗体结果相近。国外研究显示,H1N1、H3N2、BY 和 BV 抗体在菲律宾 18~60 岁人群中的阳转率分别为86.7%、80.0%、85.0%和90.0%,在> 60 岁人群中的阳转率分别为86.7%、86.7%、78.3%和 91.7%[16],其中 H1N1、H3N2 抗体阳转率与本研究结果相近,BY 与BV 抗体阳转率略高于本研究结果。另一项研究显示,H1N1、H3N2、BY 和BV抗体在澳大利亚和菲律宾18 ~ 60 岁人群中的阳转率分别为 63.6%、59.3%、66.5%和 65.9%[17],其中BY、BV 抗体阳转率与本研究结果相近,其他2 种抗体均略低。
本研究显示,IIV4 在≥3 岁人群中的接种后保护率、阳转率、GMI 等免疫原性数据均达到预期效果,不良事件以接种部位疼痛为主,严重程度以1 级(轻度)为主,未发生与疫苗接种有关的严重不良事件,初步证明该疫苗上市后具有良好的安全性和免疫原性。由于缺少接种同类疫苗作为对照进行非劣效研究,存在一定的局限性,下一步将进一步评估IIV4在儿童、老年人等重点人群的安全性及免疫效果。

