液液萃取-HPLC法检测人参皂苷Rg3的研究
杨文志,杜跃中,高宇,马双欣,宋莹莹
(吉林人参研究院·吉林通化·134001)
在现有的人参质量评价中,人参皂苷Rg3未列入检测项目,但随着对人参药材认识的深入,Rg3重要性和特殊性显示了出来,Rg3不仅是人参中的一种重要的有效成分,同时也体现出不同人参品种的差别。
人参皂苷Rg3具有抗疲劳、舒张血管、提高免疫力、抗肿瘤作用,是一种功能活性较强的人参皂苷,在天然人参中含量极微,而在加工品种红参中其含量显著增加。据报道[1-3],野山参和红参都含有Rg3成分,人参茎叶也发现含有Rg3。对于园参是否含有Rg3,野山参和红参Rg3的含量范围,本研究在建立了人参中Rg3检测方法的基础上,分别对不同产地、5个批次的野山参、红参及园参进行了Rg3检测,以证实和确定野山参、红参及园参的Rg3含量及其特点。
1 材料、试剂与仪器设备
1.1 材料
野山参,红参及园参各5个样品,其中野山参参龄在15年以上,样品来源见表1。

表1 野山参、红参及园参的样本来源
1.2 试剂
乙腈(色谱纯)、甲醇、乙酸乙酯、吡啶为分析纯;人参皂苷对照品产自吉林人参研究院植化研究室,纯度分别是Rg3(S)(93.04%)、Rg3(R)(98.86%)。
1.3 仪器设备
高效液相色谱仪Agilent 1260(美国);色谱柱Agilent ZORBAX SB-C18(Made in USA);4.6×250mm;旋转薄层蒸发仪(郑州长城科工贸有限公司);电热恒温水浴锅(北京市永光明医疗仪器有限公司);250mL玻璃回流装置(国产)。
2 供试样品的制备
2.1 对照品溶液的制备
精密称取人参皂苷Rg3(S)、Rg3(R),加甲醇溶解,制成每1mL各含1mg的溶液,作为对照品母液。分别取对照品母液再混合定容,制成标准曲线使用的对照品溶液,浓度范围0.2~0.04 mg.mL-1。Rg3(R)在甲醇中溶解困难,需要加一点吡啶。
2.2 供试品溶液的制备
分别精密称取人参样品2.0g,用甲醇吡啶(4:1)50mL浸泡过夜,次日回流提取1次(1h),提取液过滤,滤渣用适量甲醇洗1次,与前液合并;将溶液回收,残渣用水溶解后,用乙酸乙酯萃取,共6次,将乙酸乙酯萃取液合并,回收试剂,残渣用甲醇定容于2mL的容量瓶中,制成供试样品,上样前,进行微孔滤膜(0.45μm)过滤。
3 检测方法及方法验证
3.1 HPLC色谱条件及测定方法
仪器检测波长为203nm;柱温30℃;流速:1mL/min;以乙腈为流动相A,水为流动相B进行梯度洗脱。

时间(分钟)流动相A(%)流动相B(%)0~152575 15~4525→4075→60 45~504060 50~8040→6260→38
测试:分别吸取对照品溶液与供试品过滤溶液,注入液相色谱仪中,定量环上样,记录色谱保留时间与峰面积。
3.2 线性关系的考察
将对照品溶液分别进行HPLC色谱分析,每个浓度供试品平行测定3次,共5个浓度梯度,计算每个浓度下峰面积的平均值,以峰面积(Y)对浓度(X)进行线性回归分析,计算回归方程。
3.3 精密度实验
将对照品Rg3(S)及Rg3(R)连续进样6次,测得各次峰面积,计算峰面积的RSD。
3.4 供试品制备参数的研究
3.4.1 取样量范围试验
分别梯度称取野山参2.0、1.5、1.0及0.5g,共4个样品,用甲醇吡啶(4:1)50mL分别浸泡过夜,按供试品溶液制备方法制成供试品,测试Rg3含量,计算±RSD。
3.4.2 提取次数
精密称取野山参2g,共6个平行样,分别标号为1#、2#、3#、4#、5#、6#。各样品用50mL甲醇吡啶(4:1)浸泡过夜,次日回流提取,每次1h,提取液过滤,然后再加入新的提取试剂重复提取;1#用甲醇吡啶提1遍,2#重复提2遍;以此类推,6#重复提6遍,每个样品过滤后,最后的滤渣用适量甲醇吡啶洗一次,与之前过滤液合并,然后,旋蒸回收提取溶剂,剩余旋蒸不易回收的溶剂用甲醇转移到蒸发皿中,放于水浴上挥干,残渣分别用20mL水溶解,乙酸乙酯15mL萃取6次;水浴上挥干乙酸乙酯,用2mL甲醇定容成供试品,测试Rg3的含量,计算±RSD。
3.4.3 萃取次数
精密称取野山参样品2g,共6个平行样,分别标号为1#、2#、3#、4#、5#、6#,按提取1次的方法操作,提取后的各样品分别用20mL水溶解,用乙酸乙酯15mL萃取;1#萃取1次;2#萃取2次;依此类推,6#萃取6次,将每个样品的乙酸乙酯萃取液合并,在水浴上挥干乙酸乙酯,用2mL色谱甲醇定容成供试品,测试Rg3的含量,计算±RSD。
3.5 回收率实验
将已知含量的野山参样品精密加入Rg3(S)标准溶液,共6个平行加标样品,测试Rg3含量,计算回收率。
3.6 重复性实验
精密称取野山参样品2g,5个平行样,按供试品溶液制备方法制成供试品,测试Rg3的含量,计算RSD。
3.7 稳定性实验
将野山参供试品分别在0~30h时间段中,不同时间点间隔取样测试Rg3,计5次,计算保留时间及峰面积的RSD。
4 实验结果
供试野山参样品只检测出S型Rg3,而R型Rg3未检出。
4.1 Rg3线性关系及最低检测限
以对照品峰面积的平均值与其浓度分别作Y(mAU)轴和X(浓度C:mg.mL-1)轴,制作标准曲线,回归方程如下。
Rg3(S):Y=8526.616 C+31.682(r=0.9975,n=5);
Rg3(R):Y=7815.414 C+10.483(r=0.9989,n=5)。
注n为供试品数量。
结果表明,上述各Rg3皂苷质量在4~0.8μg区间与峰面积具有良好的线性关系。
4.2 精密度实验
对照品Rg3(S)及Rg3(R)连续进样6次,其Rg3(S)峰面积的RSD为1.21%,Rg3(R)峰面积的RSD为1.12%。
4.3 取样量范围
不同取样量测试的结果见表2,结果表明,野山参取样量范围在0.5~2g之间,Rg3(S)含量的RSD为3.80%,其结果基本一致,产生的差异可以认为是随机误差,因此取样范围定为0.5~2g之间。

表2 野山参Rg3(S)差异取样量的测定结果
4.4 提取次数
野山参提取1~6次的Rg3(S)测定结果见表3。结果表明提取1~6次测定结果的RSD为5.01%,其结果基本一致,存在偶然误差,但在可接受范围内,而从节约角度选择,将提取次数定为1次。

表3 野山参不同提取次数Rg3(S)的测定结果
4.5 萃取次数
野山参萃取1~6次的Rg3(S)测定结果见表4。结果表明萃取1~6次测定结果的RSD为12.3%,说明萃取次数对结果影响较大;而萃取5次和萃取6次的偏差(0.56%)最小,可认为是实验误差,说明体系中Rg3已被充分萃取出来,为减少萃取对结果的影响,将萃取次数确定为6次。

表4 野山参不同萃取次数Rg3(S)的测定结果
4.6 准确度
回收率实验结果见表5。野山参检测Rg3(S)的加标回收率是99.06%,说明方法有一定的准确度。

表5 Rg3(S)回收率测试结果
4.7 重复性
样品重复检测结果见表6。Rg3(S)含量的RSD为3.70%,表明方法具有良好的重复性。

表6 野山参重复检测Rg3(S)的测定结果
4.8 稳定性
稳定性实验结果见表7。野山参供试样品在0~30h时间范围内,Rg3(S)保留时间的RSD为0.33%,其峰面积的RSD为0.84%,表明样品在这个时间范围测试,数据稳定可靠。
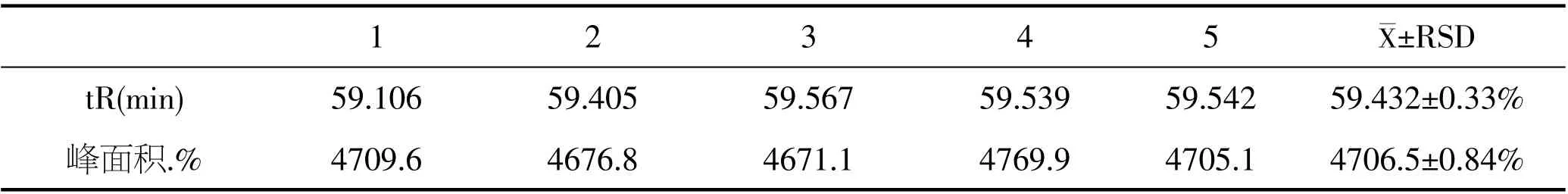
表7 野山参Rg3(S)稳定性测试结果
5 不同人参品种Rg3 的检测结果
不同人参品种Rg3的检测结果见表8及图1。
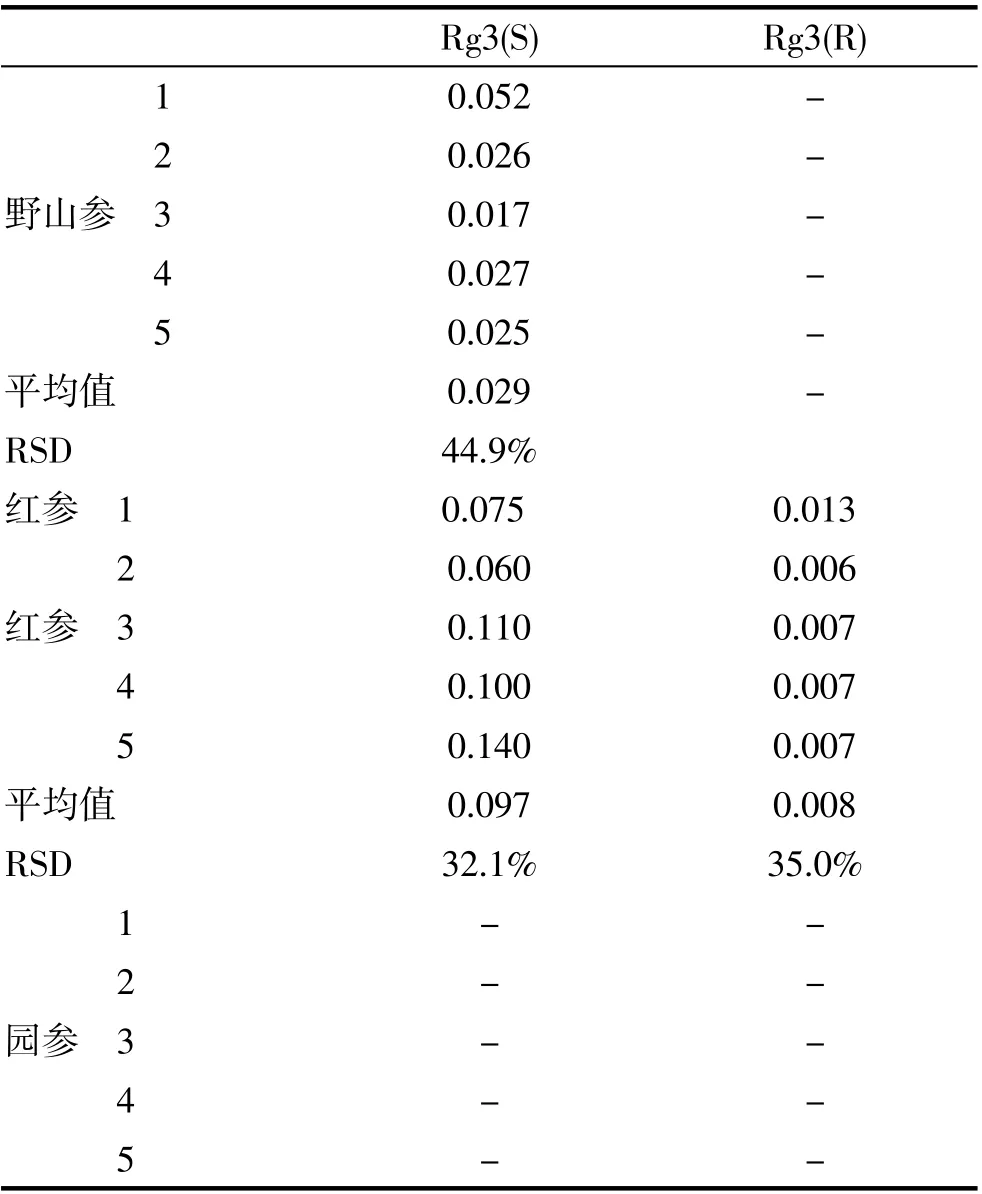
表8 野山参、红参及园参不同产地样品Rg3检测结果
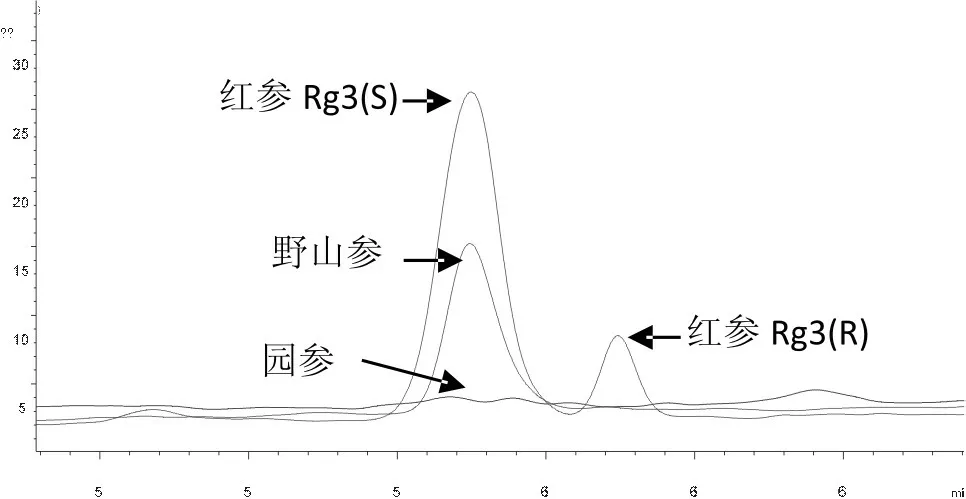
图1 野山参、红参及园参Rg3色谱图
结果显示,野山参检出Rg3(S),其平均含量是0.029%,含量较分散,而Rg3(R)未检出。红参检出Rg3(S)及Rg3(R),其平均含量分别是0.097%及0.008%,含量较分散。圆参的Rg3(S)及Rg3(R)均未检出。
野山参与红参Rg3(S)的数据经t检验分析,红参的Rg3(S)含量极显著高于野山参,t=4.493**。
6 讨论
6.1利用该方法做了人参皂苷Rh2的测试实验,对照品Rh2与响应信号具有良好的线性关系,线性回归方程分别是,Rh2(S):Y(峰面积)=9905.265×X(mg/mL)-61.007;r=0.9962;Rh2(R):Y(峰面积)=11942.148×X(mg/mL)-46.132;r=0.9955,但是在人参中却未检出Rh2,是方法存在问题,还是野山参、红参及园参中Rh2含量极低检不出来,或不含有,这有待于进一步的实验。Rg3与Rh2对照品色谱图见图2。6.2本实验取样量为2g,目的是增大取样量以观察Rh2的检测情况。按照本实验得出的结果是,野山参和红参均未检出Rh2;由最低检出限推算,它们Rh2的含量应低于百万分之二,或者样品中就没有Rh2。6.3本实验比较了甲醇吡啶(4:1),甲醇及80%甲醇溶液提取野山参Rg3的效果,三种试剂均能提取出Rg3(S),其含量分别为0.053%、0.054%及0.058%,以80%甲醇溶液提取测得的含量较高,三者含量的RSD为4.81%,结果相近;但甲醇和80%甲醇溶液提取得到的供试品色谱图,其在Rh2附近的色谱峰分离不好,不易辨识,因此实验选择了甲醇吡啶(4:1)作为提取剂。详见图3。

图2 Rg3及Rh2与甲醇空白的HPLC色谱图
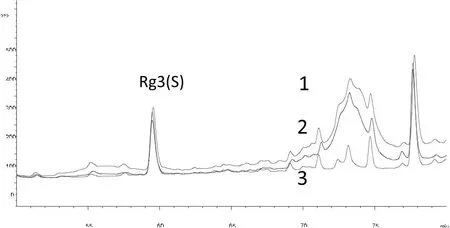
图3 甲醇吡啶、甲醇及80%甲醇提取物色谱图比较

