一种快速灵敏非特异性核酸酶酶活测定方法
高 婷, 朱 瑜, 赵 晨, 葛 燕, 李端华, 李进军, 王 辂
(成都大学 四川抗菌素工业研究所,成都 610052)
核酸酶是以核酸为底物,催化磷酸二酯键水解的一类酶。核酸酶按作用底物的不同分为脱氧核糖核酸酶、核糖核酸酶和非特异性核酸酶;按作用的位点不同,又可将核酸酶分为核酸外切酶和核酸内切酶。其中非特异性核酸内切酶是一类高活性水解酶,其最大的特点是能非特异地降解几乎所有类型的核酸,包括单链、双链、线状及环状的 DNA 和 RNA,且对核酸的序列没有严格的要求[1]。目前关于非特异性核酸酶的报道已经很多,例如:海洋嗜热细菌噬菌体(GBSV1-NSN)非特异性核酸酶[2],对虾白斑综合症病毒(white spot syndrome virus,WSSV)核酸酶[3],小肠结肠炎耶尔森菌(Yersiniaenterocoliticasubsp.palearctica)核酸酶[4],灵杆菌(Escherichiacoli)非特异性核酸酶[5]等。非特异性核酸内切酶已在工业、医药及分子研究等各领域得到非常普遍的应用,如工业上消除生物制品中的外源核酸,减少过敏反应[6-7],医药上可以作为抗肿瘤药物的辅助增效试剂[8],在分子研究中可用于抗病毒试剂的开发[9]等。非特异性核酸内切酶已有商品化的产品Benzonase,主要用途是在蛋白质纯化的过程中消除核酸的污染,加入该核酸酶可以减小加工处理过程中蛋白样品的黏稠度[10]。目前关于非特异性核酸酶的酶活测定方法主要有3种方法:王亚楠[11]通过琼脂糖凝胶电泳检测非特异性核酸酶活性,以RNA为底物,在70 ℃水浴15 min的RNA的减少来反映酶活性;Song等[12]采用分光光度法测量非特异性核酸酶活性,以DNA为底物,在60 ℃孵育15 min,单位时间内使Δ260值增加0.001所需的酶量来表示酶活大小,此方法需要以高氯酸等强酸来终止反应,且受溶液中杂质影响较大;第3种方法是改进的原位染色法[13-14],此方法是在12%分离胶中加入DNA,利用SDS-PAGE电泳分离蛋白样品,电泳后将凝胶用溴化乙锭染色,通过凝胶记录系统酶活性可视化为一条条带,操作条件较为复杂。因此为研究非特异性核酸酶,建立快速准确的非特异性核酸酶酶活测定方法非常重要。
本酶活测定方法原理是非特异性核酸酶能促使核酸降解为单磷酸核苷酸,未被降解的DNA与琼脂糖凝胶中的Gelred核酸染料结合后形成一种荧光络合物(Gelred-DNA复合物),在312 nm紫外光的照射下会发出较强的荧光,这种荧光可用带 CCD 成像头的凝胶成像处理系统拍摄,利用Quantity one分析软件分析拍摄的图像即得到核酸条带的光密度值。核酸被非特异性核酸酶降解后,核酸的光密度值会降低,故通过光密度值的变化来鉴定非特异性核酸酶的作用。比光密度值为核酸减少的光密度值与核酸总量的光密度值的比值,反映了非特异性核酸酶水解核酸的能力,在一定条件下与酶活性有良好的线性关系,故利用一定条件下单位时间内比光密度值的变化来表示非特异性核酸酶的酶活力。本文研究了多种因素对核酸酶酶活测定的影响,并进行方法验证,以期建立一种简便、快速、准确的非特异性核酸酶活性检测方法。
1 材料与方法
1.1 材料
1.1.1 主要设备
Bio-Rad凝胶成像仪ChemiDoc XRS及分析软件Quantity One购自美国Bio-Rad公司。
1.1.2 试剂和工作液
20 mmol/L Tris 缓冲液:20 mmol/L Tris,2 mmol/L MgCl2,2 mmol/L NaCl,HCl调pH值至8.0;6×蔗糖DNA Loading Buffer:10 mmol/L Tris(pH 7.6),60 mmol/L EDTA,40% 蔗糖(W/V),0.05% 溴酚蓝(W/V);DNA底物母液(20 μg/μL):称取0.5 g 鲑鱼精子DNA,溶于25 mL 20 mmol/L Tris缓冲液,2个当量的NaOH溶液调pH值至8.0,保存于-20 ℃;1×TAE缓冲液:40 mmol/L Tris-乙酸盐,1 mmol/L EDTA, pH 8.0。
1.2 方法
1.2.1 酶活测定方法
制胶:称取1.0 g 琼脂糖,加入100 mL 1×TAE电泳缓冲液,于微波炉加热至溶解,冷却至60 ℃加入10 μL Gelred染色液,并摇匀。倒入制胶板中,室温冷却凝固。
取甲、乙两支0.5 mL 离心管,分别设定为阴性对照管与测定管,在每支离心管中分别加入0.1 μg/μL 的DNA底物溶液36 μL ,在37 ℃预热5 min,甲管中加入20 mmol/L Tris 缓冲液 2 μL,乙管中加入2 μL 稀释酶液,立即混匀,在37 ℃反应3 min后,立即加入7.6 μL 6×蔗糖DNA Loading Buffer混匀,冰浴,终止反应。取样10 μL进行1%琼脂糖凝胶电泳,于100 V电泳25 min。将琼脂糖凝胶放入凝胶成像仪工作台,选择透射UV光,调节图像至清晰,进行曝光采集图像。用Quantity One打开采集的图像,识别条带并扣除背景值,即分析得到各条带的光密度值。
酶活力单位:在37 ℃,pH 8.0的条件下, 38 μL的体系中以浓度为0.1 μg/μL的核酸为底物,1 min内使核酸的1% 琼脂糖凝胶电泳比光密度值减少1%的酶量定义为1个活性单位。
酶活力计算:
ATO(列车自动运行)通过监测列车能量来预测所有的安全定位,并使列车尽可能靠近安全限制点。为了达到此目的,ATO计算得到能量触发曲线,并在给定时间内对曲线的估计进行优化以及更改。安全限制点的主要类别包括永久速度限制(如土建限速)、临时速度限制(如临时限速)、零速度目标速度、占用的轨道电路或计轴边界、线路的末端、车档、防护区段、非受控道岔、限制信号和授权终点等。
X=[(OD对照-OD样品)/OD对照]×100×Dr/(t×V)
式中:OD对照为阴性对照样光密度,OD样品为酶样光密度,(OD对照-OD样品)/OD对照表示比光密度值,Dr为稀释倍数,t为反应时间,min,V为加酶体积,μL。
1.2.2 底物浓度的确定
配制0.025、0.05、0.075、0.1、0.125和0.15 μg/μL的DNA底物溶液,Benzonase核酸酶液稀释125倍,反应3 min,分别按照1.2.1的酶活性测定方法进行酶促反应,研究不同底物浓度对反应速率的影响。各个DNA底物浓度进行2次平行实验。
1.2.3 待测酶活范围的确定
取核酸酶液稀释不同倍数(20、40、75、80、100、125、150、200、250和500倍),配制不同浓度的核酸酶,分别按照1.2.1的酶活性测定方法与0.1 μg/μL脱氧核糖核酸底物进行酶促反应,研究不同核酸酶浓度对相应酶活力测定的影响。每个稀释倍数进行2次平行实验。
1.2.4 反应时间的确定
取180 μL 0.1 μg/μL的 DNA 底物溶液,加入10 μL 125倍稀释酶液,按照1.2.1的酶活性测定方法进行酶促反应,分别在0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、6、7、8、9和10 min时取样10 μL,立即加入2 μL的6×蔗糖DNA Loading Buffer,混匀冰浴,取样10 μL进行1%琼脂糖凝胶电泳。每个时间进行2次平行实验。
1.2.5 方法验证
线性关系考察。取10支0.5 mL离心管,按照表1配置溶液;精确量取各组分后充分混匀,加入7.6 μL 6×蔗糖DNA Loading Buffer 混匀,取样10 μL,进行1%琼脂糖电泳。重复测定3次,分析各条带光密度值,制作标准曲线。
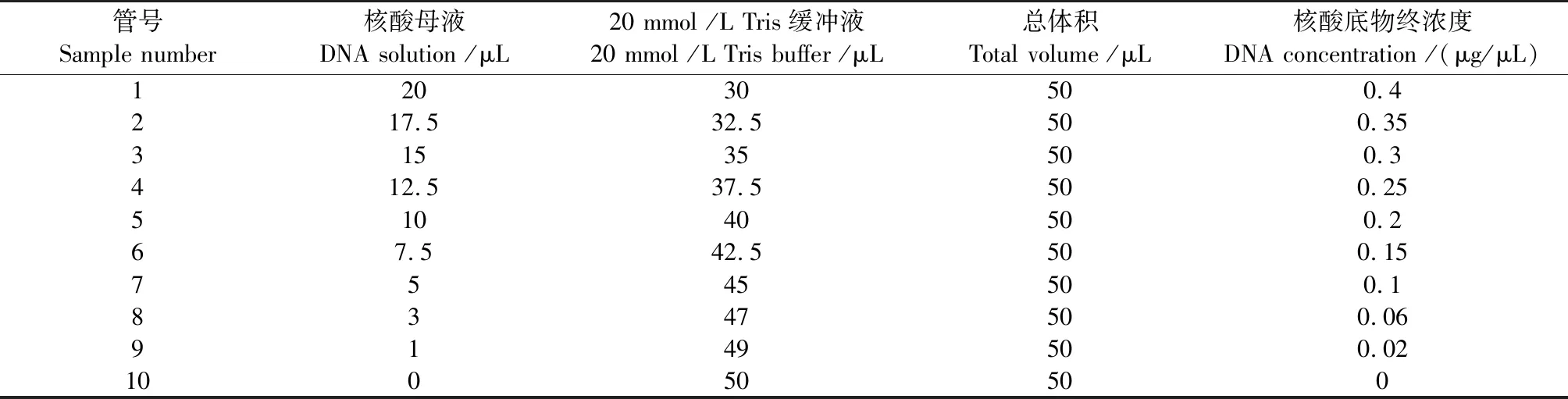
表1 溶液配置
准确度调节。已知含量的核酸酶液,使其浓度分别达到其含量的80%、100%和120%,按照1.2.1酶活性测定方法测定酶活,每个浓度重复测定3次,分别计算各浓度的样品回收率(回收率=实际测得值/理论值)和相对标准偏差。
精密度。分别量取6份酶液,用20 mmol/L Tris 缓冲液稀释125倍,按照1.2.1酶活性测定方法测定这6个相同浓度酶液的酶活,考察其相对标准偏差。
检测限与定量限。以水和20 mmol/L Tris分别与核酸底物反应,测其光密度值,计算光密度差值,此作为基线。依此计算当S/N≥3的光密度差值作为检测限,当S/N≥10的光密度差值作为定量限。
2 结果与分析
2.1 底物浓度的确定
在酶活的测定中,酶浓度恒定的条件下,底物浓度对酶促反应的速度有很大影响。在底物浓度很低时,由于提供的底物不足,使得酶促反应速度很低;随着底物浓度的增加,酶促反应的速度成比例迅速增加;而随着底物浓度继续增加,反应速度的增加开始减慢,到一定程度,反应速度趋于恒定为一常数,实际上就是趋向最大反应速度,在此处底物浓度变化,对反应速度影响很小[15]。
由图1可知,底物浓度在0.025~0.1 μg/μL时,酶促反应速度随底物浓度增加而显著增大,但超过0.1 μg/μL时,变化不显著,表现为酶已基本被底物饱和,且相对标准偏差较大。一般而言,当底物浓度过大,酶促反应速率过高,会导致相对标准偏差增大[16],从图1可看出,当底物浓度为0.1 μg/μL时,相对标准偏差最小,因此底物浓度0.1 μg/μL时为最优浓度。后续在非特异性核酸酶酶活力测定采用的底物脱氧核糖核酸浓度为 0.1 μg/μL。
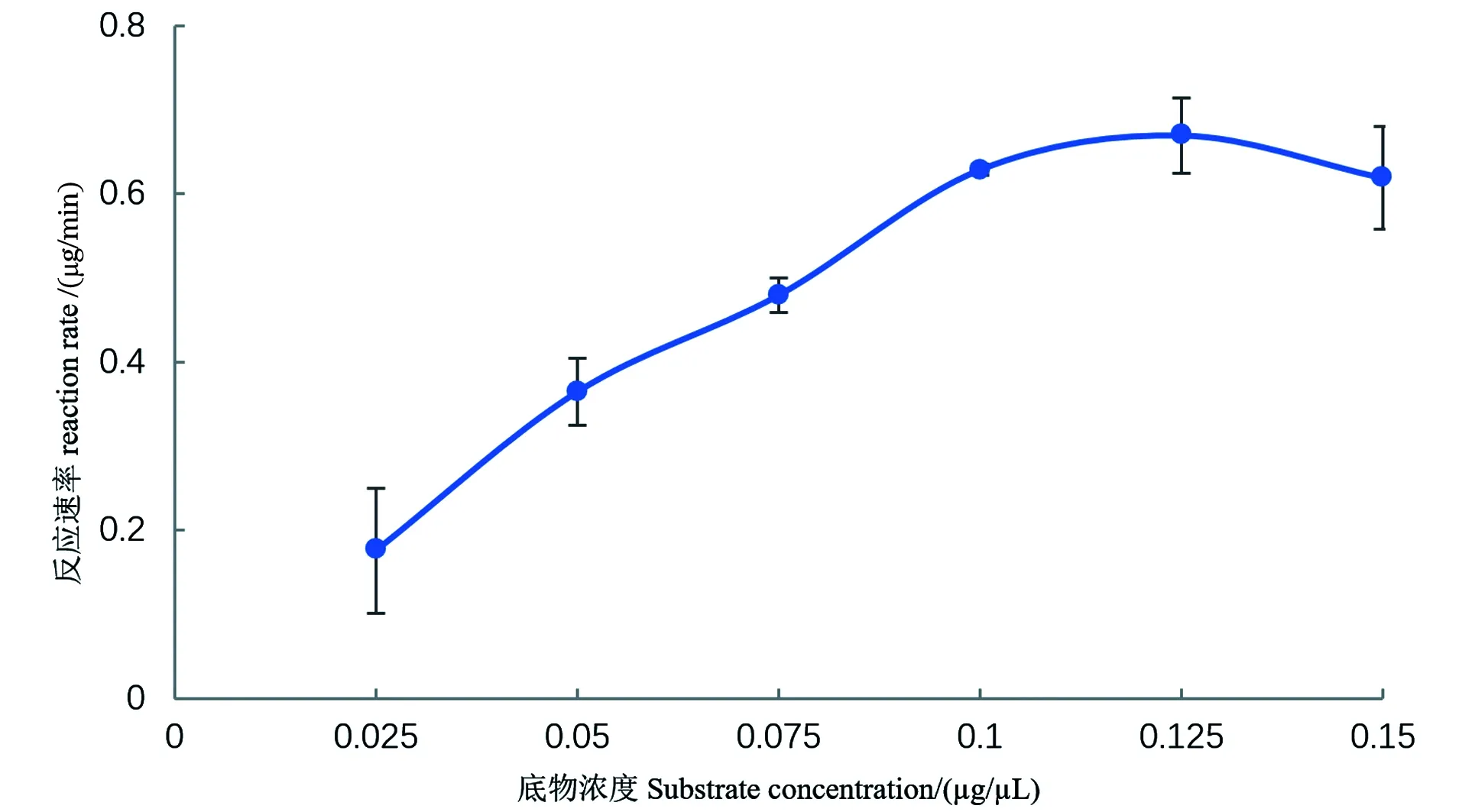
图1 底物浓度对反应速率的影响Figure 1 Effect of substrate concentration on reaction rate
2.2 待测酶活范围的确定
由于酶促反应底物的量是一定的,所以加入的酶液的酶活浓度要在测定线性范围内。结果如图2和图3所示,核酸酶液的酶活在4.17~9.01U/μL范围内有良好的线性关系(R2=0.992 7),酶浓度过高则测定结果较低,过低超过了检测限,故在测定酶活时要调整至该范围内才能准确测定。
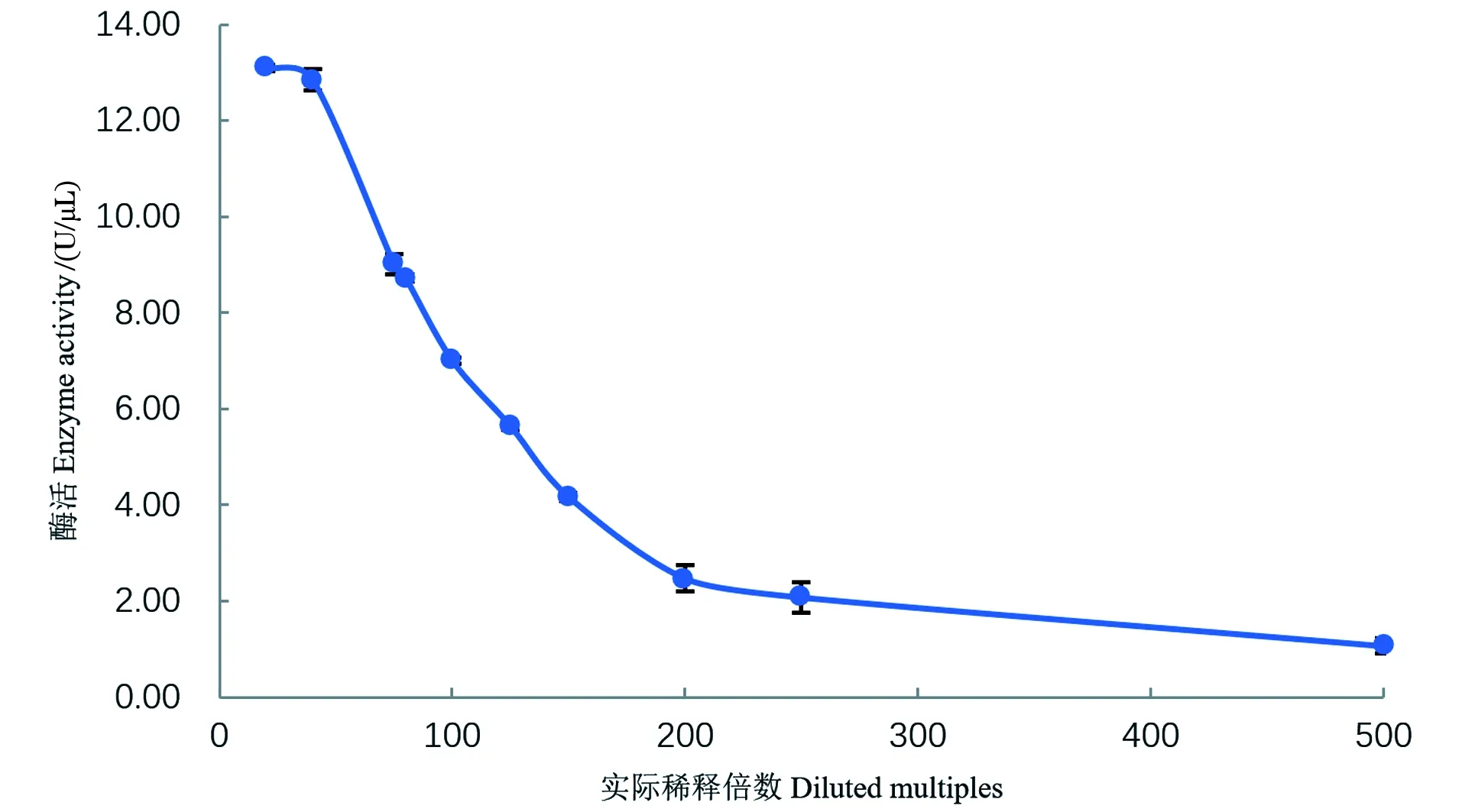
图2 不同酶浓度对酶活测定的影响Figure 2 The influence of different enzyme concentrations on enzyme activities
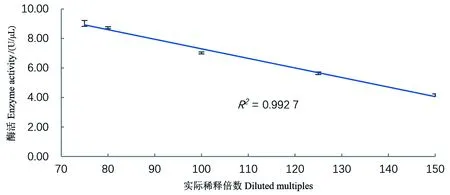
图3 不同酶浓度与测得酶活的线性关系Figure 3 Linear relationship between different enzyme concentrations and measured enzyme activities
2.3 反应时间的确定
有研究显示,即使在适宜条件下酶的催化效率也不是一成不变的,酶催化速率会下降,即酶出现钝化现象[16],比如酶反应的产物达到一定浓度后对酶产生反馈抑制作用,故进行酶活力测定,要确定适宜的酶反应时间。从酶促反应进程曲线可知,反应起始一段时间内,由于底物充足,底物的变化与时间成直线关系(其斜率代表初速度);随反应时间延长,曲线趋于平坦,斜率变小,反应速度下降。因而反应速度随着时间延长会越来越慢,只有反应的初速度才与酶量成正比,因此要准确测定出酶活力大小,就应在底物过量的情况下在初速度时间内测定。得到的酶促反应进程曲线如图4所示:在前3 min,底物的减少量随反应时间呈线性增长,其斜率代表了反应的初速度;3 min后,随反应时间的延长,曲线趋于平坦,反应速度逐渐减慢。为了保证反应处于初速度时间内,同时尽量降低实验操作带来的影响,最终确定的反应时间为3 min。
2.4 线性关系考察结果
线性关系考察结果见图5。以DNA底物浓度为横坐标,光密度值为纵坐标,制作标准曲线,并得出回归方程:y=203 311x+1 128.9,线性相关性系数R2=0.994 2。
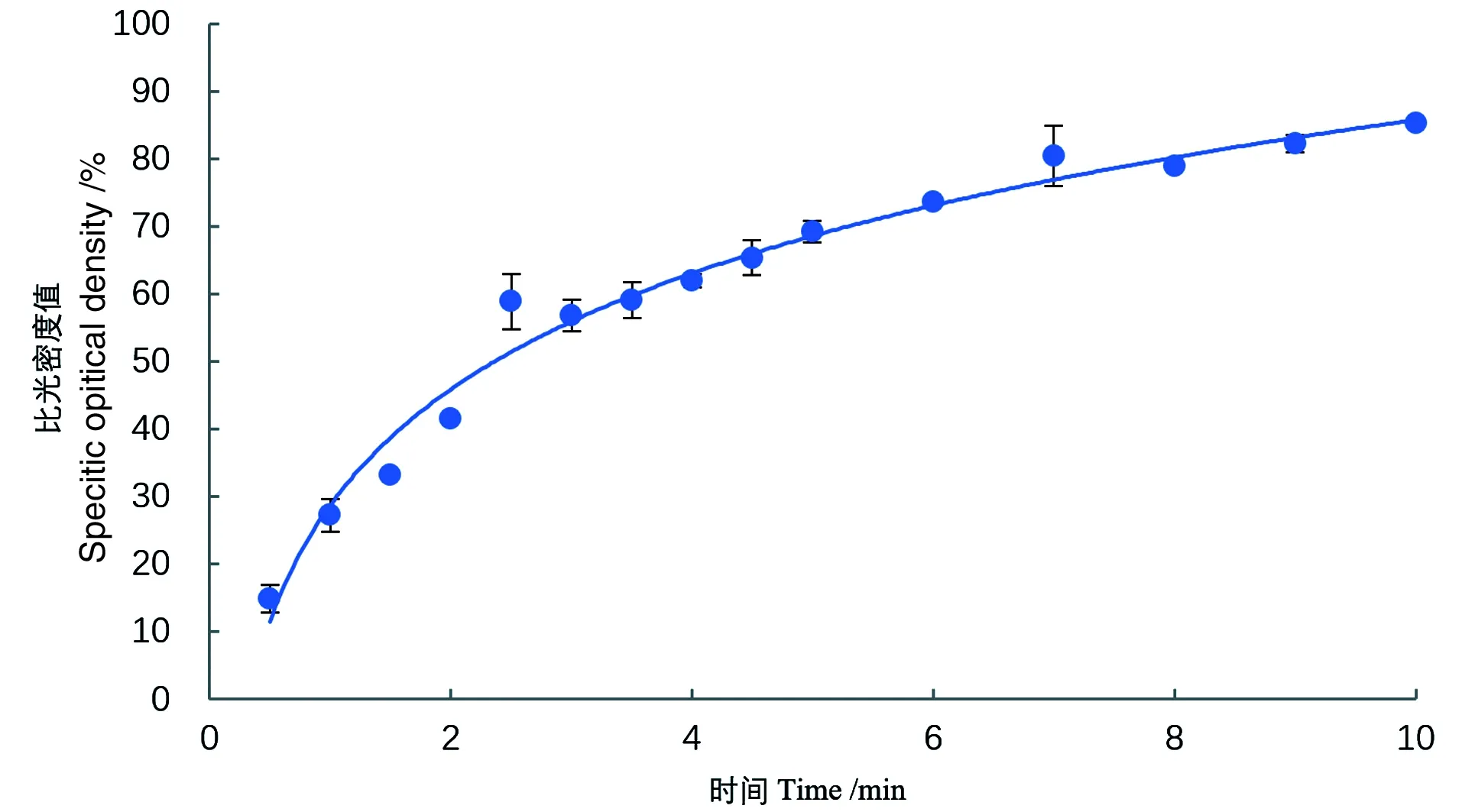
图4 酶促反应进程曲线Figure 4 Progress curve of enzymatic reaction
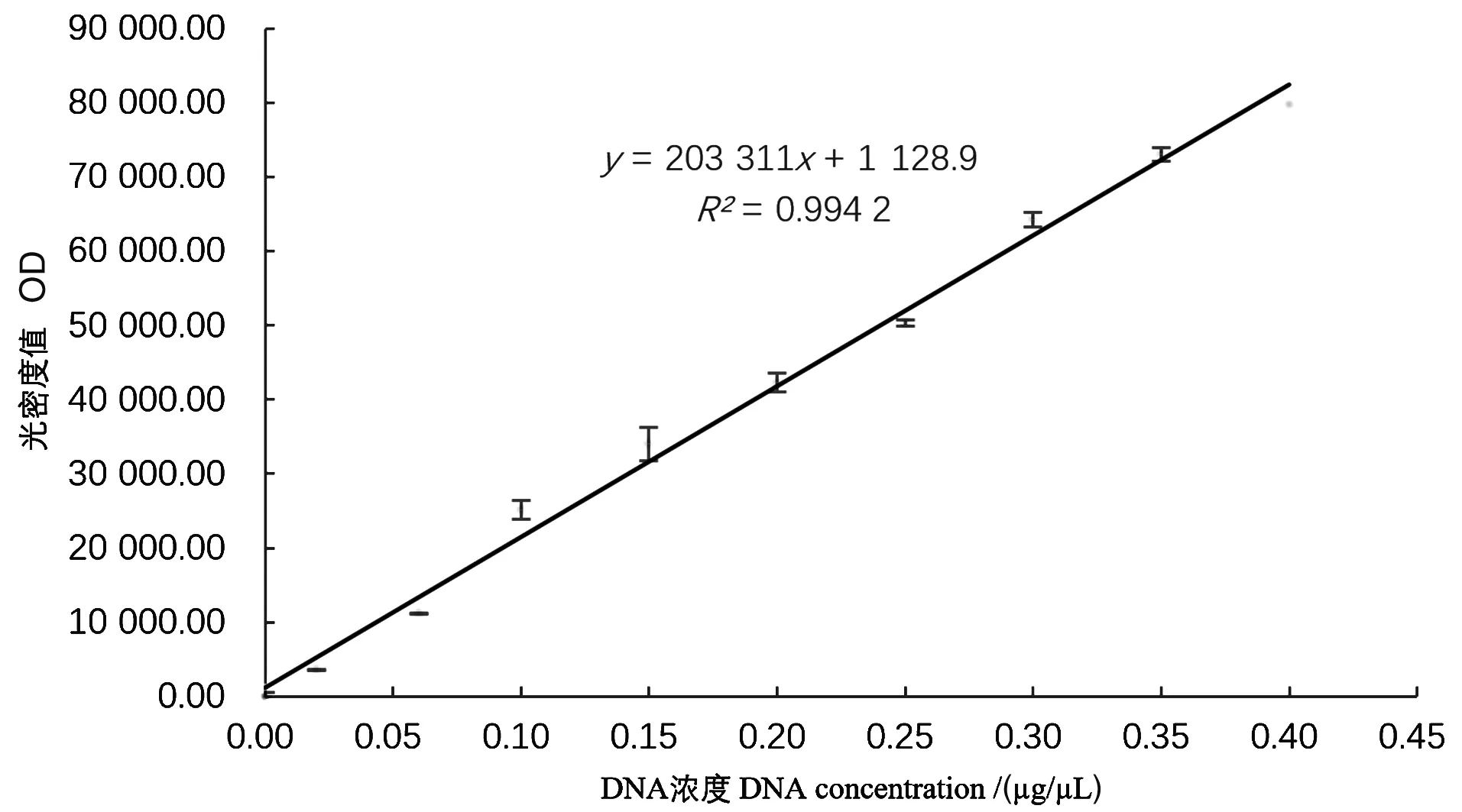
图5 标准曲线Figure 5 The linear dependence between different concentrations of DNA substrates and OD value
2.5 准确度试验结果
准确度试验结果见表2。测得3种浓度样品回收率为99.63%、98.96%和98.76%,平均RSD为2.09%。
2.6 精密度试验结果
通过制备6个相同浓度酶溶液进行测定,精密度实验结果见表3。测得样品之间的相对标准偏差为2.3%,小于5%,重复性较好。
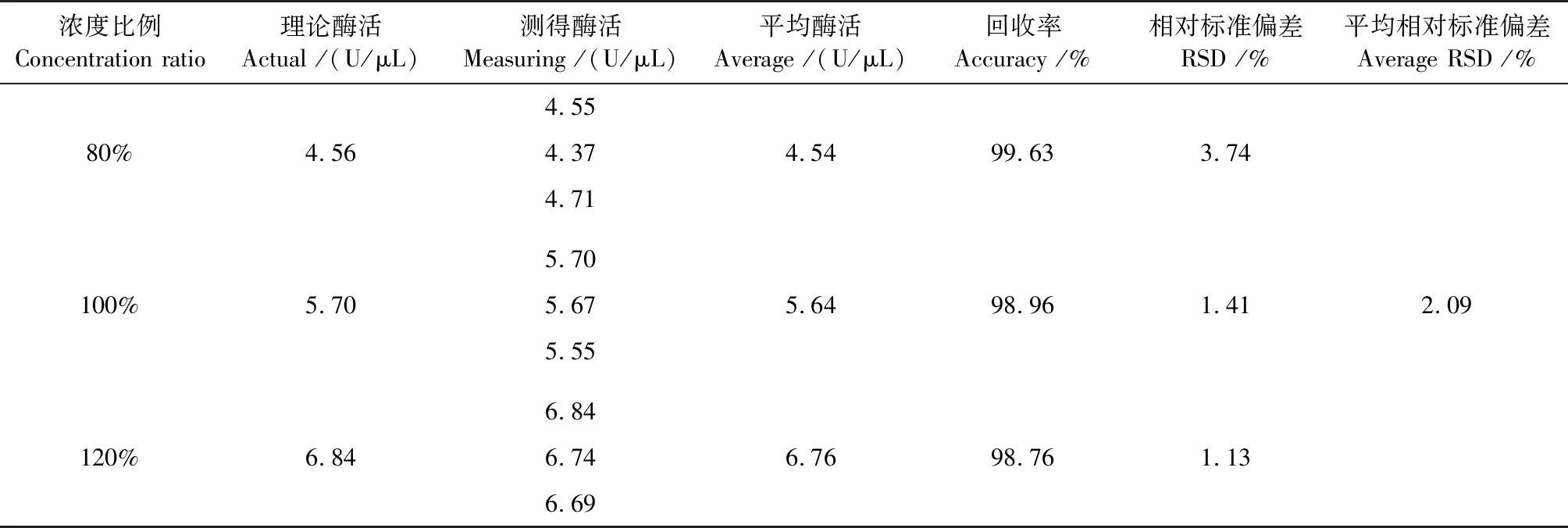
表2 非特异性核酸酶酶活的准确度试验结果

表3 非特异性核酸酶活性精密度试验结果
2.7 检测限与定量限
检测限与定量限测定结果见表4。核酸底物减少量即光密度差值为3 321.62,此时S/N≥3,定为检测限。光密度差值为1 1071.05时,S/N≥10,定为定量限。

表4 非特异性核酸酶活性检测限与定量限试验结果
3 讨论
目前国家现有的关于核酸酶的检测标准为《GB/T 34801—2017脱氧核糖核酸酶活力检测方法》[17]和《GB/T 34222—2017核糖核酸酶活力检测方法》[18],这两种标准均采用紫外分光光度法检测酶活性。紫外分光光度法是根据核酸降解后在最大吸收波长260 nm的吸光度增加,产生增色效应,通过测定单位时间内260 nm处吸光度的增加来表示酶活力。该方法操作简单,重复性较好,但反应时间较长(10 min)且不能同时进行多个样品的测定。
从实验结果可见,本方法适用于低浓度的酶活测定(4.17~9.01 U/μL),酶与底物用量少大大减少了测定成本。紫外分光光度法的干扰因素较多,凡是能引起A260变化的物质如离子、色素均会影响酶活力测定结果[19],不适用于成分复杂或杂质较多的酶液酶活性测定,但本方法主要由DNA与染料结合形成的荧光复合物在紫外灯的照射下发出荧光,酶反应液中的杂质对其影响较小,且在稳定的缓冲体系中电泳,反应条件温和,故此方法相较于紫外分光光度法提高了抗干扰能力。两种方法同时使用可增加酶活力测定范围,有效弥补了紫外吸收法测定酶活的不足,特别适合于一般实验室对非特异性核酸酶的测定。本方法反应时间短,3 min即可完成反应进行测定。反应时间的长短,对判断酶活测定结果的准确性非常重要,时间过长或过短都会使得测定结果偏低。本方法灵敏度较高,通过测定空白样品的光密度差值,计算其三倍信噪比和十倍信噪比时的光密度差值,得出该方法能被检测的最低浓度非特异性核酸酶活为1.11 U/μL,能被定量测定的最低浓度非特异性核酸酶活为3.71 U/μL。根据实验结果,要使酶活性被准确定量,检测样品的酶浓度不得低于定量限,酶浓度也不能过高,过高则超过了该方法的定量范围。因此,选用此方法进行酶活性测定时,酶浓度要控制在酶活测定范围内,过高或过低都会使得超过定量范围,致使灵敏度不佳。
本方法由于是测定底物减少量来测定酶活,因此在每一批次均需设定阴性对照组,这一设定消除了不同批次间琼脂糖融化过程的不一致、使用凝胶成像仪的曝光时间及位置不一致以及个人测定习惯对酶活测定的影响,大大提高了该方法的精确度。
4 结论
酶活力测定是进行酶研究、生产与应用的基础,探寻一个快速、简便而且精确的测定方法尤其重要。本方法采用凝胶成像仪测定了底物减少量来测定酶活,重复性好且测定结果精确,酶用量少减少了测定成本,反应时间大大缩短,而且可同时测定多个样品的酶活。本研究为非特异性核酸酶的酶活测定提供了一套操作简单、结果稳定可靠及高效率的方法。

