基于matK部分序列福建茶树遗传多样性分析
聂传朋, 陈丹丹, 李焰焰
(武夷学院 茶与食品学院,武夷山 354300)
福建有悠久的茶树种植历史,经过不断的杂交和自交,茶树资源丰富[1]。但也因为不断的自交和杂交,这些茶树骨干亲本相似,亲缘关系密切,遗传背景较窄[2]。DNA条形码在系统分类学中应用越来越广泛。利用特定的DNA一级结构序列分析植物的系统发生和遗传变异,为物种鉴定和遗传结构分析提供了重要依据[3]。matK基因是DNA条形码识别的核心序列,广泛应用于植物系统发育和遗传结构分析[4]。matK基因引物通用性差,研究在前期预备实验成功的前提下,通过matK部分序列对采自武夷学院茶树种质资源圃(始建于2015年,面积80亩约5.33 km2)引种于福建省5个地区的51个茶树品种样本遗传多样性和遗传结构进行分析,了解资源圃内福建茶树的遗传背景,为武夷学院茶树种质资源圃建设及福建茶树的进一步开发利用提供参考依据。
1 材料与方法
1.1 实验样本
51个茶树品种样本均采集武夷学院茶树种质资源圃,按照原产地分成5个群体(表1)。还有原产自建阳和永春的茶树资源各1种。将新鲜采摘的福建茶种放在密封袋带回实验室,用其嫩叶提取DNA。将嫩叶洗净晾干后,放入冰冻过的研钵中,经液氮研磨,至粉末状后将转移到离心管中[5]。
1.2 茶树DNA提取
选择Plant Genomic DNA试剂盒(康为世纪生物科技有限公司)对新鲜采摘的51个福建茶种提取总DNA[6]。所有离心步骤均使用台式高速离心机,在室温下进行离心。提取的总DNA, 采用0.8%的琼脂糖凝胶电泳检测[7]。将收集的DNA溶液置于-20 ℃冰箱内保存。
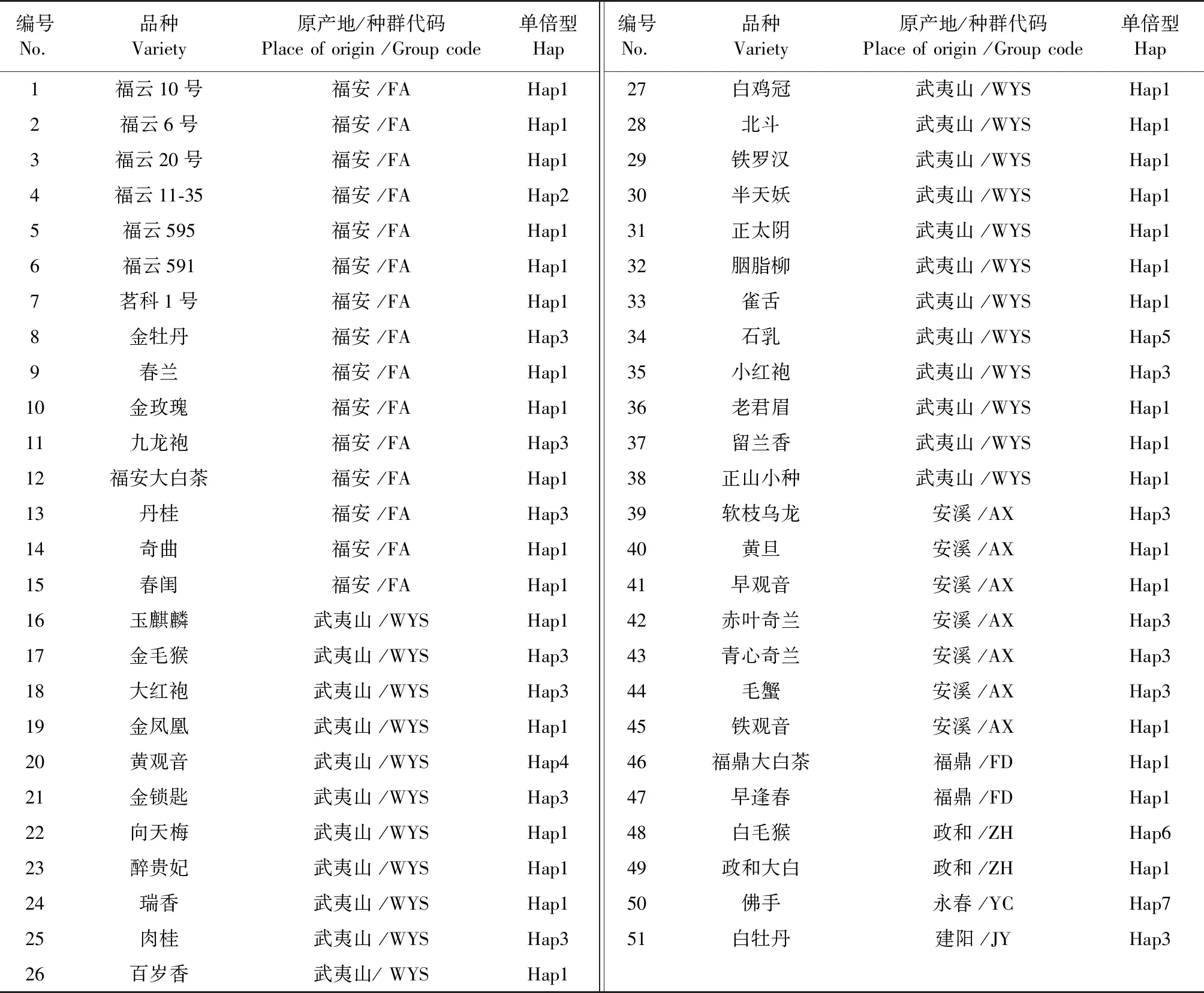
表1 福建茶树品种及单倍型信息表
1.3 PCR扩增与测序
PCR扩增引物为matKKIM_3F(5′-CGTACAGTCTTTTGTGTTTACGAG-3′)和matKKIM 1R(5′-ACCCAGTCCATCTGGAAATCTTGGTTC-3′)[8]。PCR扩增体系: 12 μL ddH2O,15 μL PCR Master Mix,matKKIM_3F/1R 引物各1 μL,DNA模板1 μL。PCR扩增程序:95 ℃预变性4 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,共30个循环;72 ℃再延伸10 min,4 ℃保存。PCR扩增产物在琼脂凝胶糖上电泳检测, PCR扩增产物送上海生工进行单向测序。
1.4 数据处理
使用Chromas软件查看序列峰图,ClustalW进行序列比对,通过人工校正除去两端不能用的序列,保存成fasta格式和mega格式。利用MEGA 7.0软件计算序列之间的突变位点的碱基组成频率,使用Kimura-2 参数模型计算群体间和群体内遗传距离。将序列比对后的fasta格式文件导入Dnasp 5软件,计算51个茶树序列的单倍型数量、单倍型多样性(Hd)、核酸多样性(Pi)、遗传分化系数(Fst)[9]。依据(1-Fst)/(4Fst)≈Nm的公式求出基因流(Nm)。使用MEGA 7.0软件的邻接法(NJ)构建单倍体系统发育树,所有的空位做缺失处理,使用邻接法(NJ)进行分析,为检测邻接树中每个分支的支持率,使用自举法进行1 000次计算[10]。应用Dnasp 5软件对所有样本进行中性检验Tajima’s D、Fu and Li’D* and F*及错配分布曲线[11]。
2 结果与分析
2.1 PCR扩增结果
PCR产物电泳图结果见图1(截取了10个品种),设置阴性对照,阴性对照没有扩增出条带,与Marker对比可知,福建茶种均获得清晰的800 bp左右的目的条带,实验结果较为理想。
2.2 序列特征和单倍型分布
51个福建茶树序列比对后,获得的序列长度为833 bp,其中碱基A/T/C/G的组成频率为36.9%、30.3%、15.8%和17.0%。51个品种序列共定义了7个单倍型(表1和表2),单倍型多样性(Hd)为0.525,核苷酸多样性(Pi)为0.001 89。其中,常见单倍型有Hap1和Hap3;稀有单倍型有Hap2、Hap4、Hap5、Hap6和Hap7。来自福鼎、永春和建阳原产地的茶树样本少,因此只检测到一种单倍型。而来自武夷山原产地茶树样本多,拥有的单倍型数最多。在单倍型的分布中,7种单倍型频率差异较大,频率分别为64.7%(Hap1)、1.96%(Hap2)、25.5%(Hap3)、1.96%(Hap4)、1.96%(Hap5)、1.96%(Hap6)和1.96%(Hap7)。Hap1出现的频率最高,说明Hap1单倍型较为稳定。表2中显示了这7种单倍型之间的26个多态变异位点。
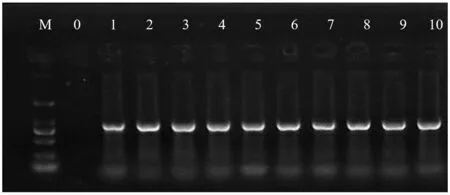
图1 部分扩增产物的琼脂糖凝胶检测电泳图Figure 1 Agarose gel electrophoresis for partial amplification products
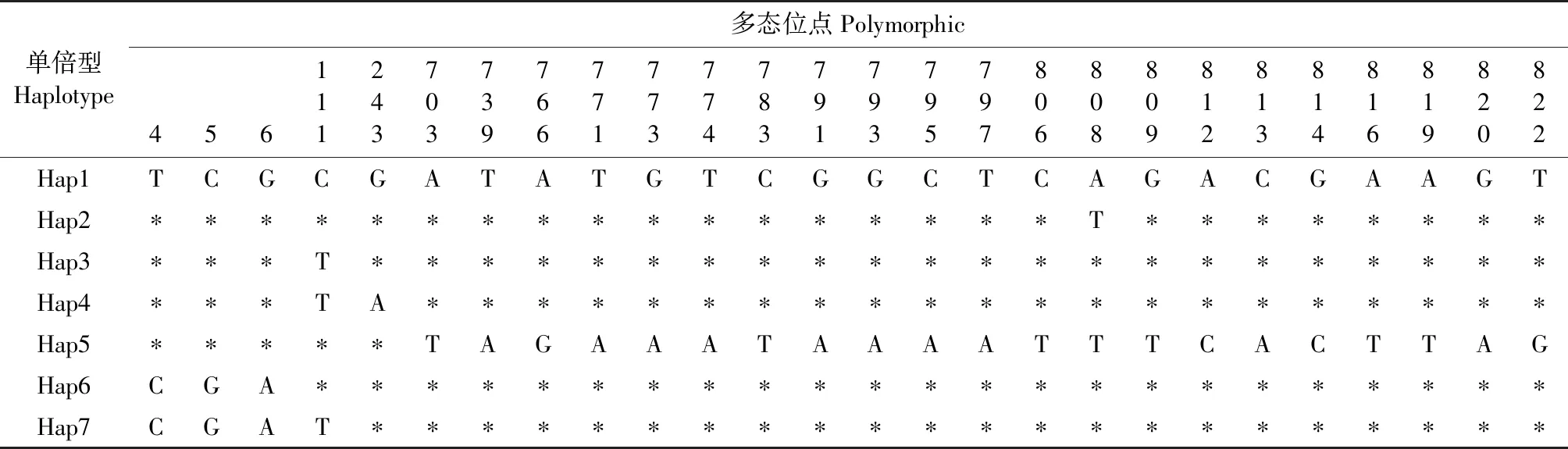
表2 基于matK部分序列的单倍型多态位点
2.3 单倍体系统发育关系
MEGA软件构建的邻接树(图2),有四大分支,均有较高的自展支持率。Hap2、Hap5和Hap1形成第一进化枝,自展支持率为62%,有较近的亲缘关系。第二进化枝由Hap6和Hap7组成,具有较高自展支持率83%。Hap3和Hap4单独为一个进化枝,说明Hap3和Hap4与其他单倍型亲缘关系较远。
2.4 群体遗传距离
应用MEGA 7.0软件选择Kimura-2 参数模型检测遗传距离,结果(表3)显示,不同茶树两两群体之间的遗传距离范围是0.000 3~0.003 3,群体内遗传距离范围是0.000 0~0.003 7。最大值存在于武夷山与政和茶树群体之间,遗传距离为0.003 3,说明武夷山与政和茶树群体亲缘关系远,遗传分化程度大,遗传多样性高。最小值存在福安和福鼎茶树群体之间,遗传距离为0.000 3,说明福安和福鼎茶树群体亲缘关系近,遗传分化程度小,遗传多样性低。不同茶树群体内,遗传距离最小是福鼎茶树,遗传距离最大的是政和茶树。

图2 基于matK部分序列的福建茶树的NJ发育树Figure 2 NJ development tree of Fujian tea trees based on matK partial sequence

表3 群体间(对角线下)和群体内(对角线上)遗传距离
2.5 群体遗传结构与分化
通过分析发现5个福建茶树群体间分化系数Fst=-0.016 22~0.500 00和基因流Nm=-15.663 07~15.210 73(表4)。安溪和福鼎茶树群体之间存在高度分化(Fst>0.25),地理隔离产生分化(Nm<1)。福安和安溪、福鼎茶树群体;安溪和政和茶树群体间均为低度分化(0.05
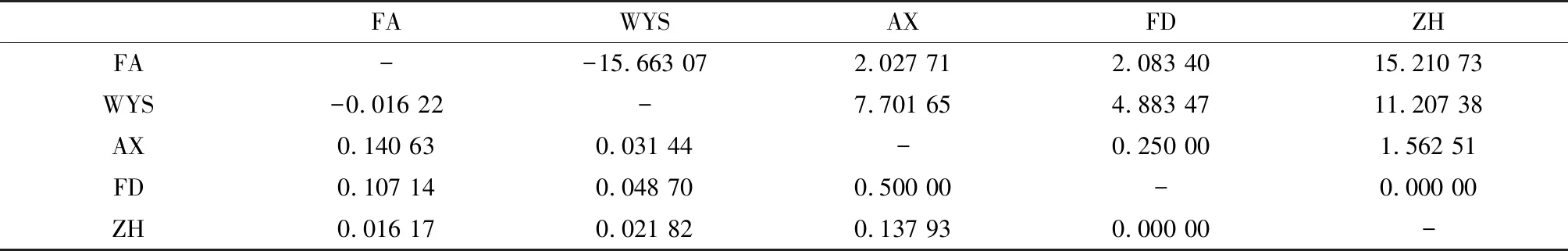
表4 福建茶树群体间遗传分化系数(Fst)和基因流(Nm)(Fst对角线下)和基因流(Nm对角线上)
2.6 中性检验与错配分布分析
福建茶树的matK序列的Tajima’s D、Fu and Li’D* and F*中性检验呈现明显偏离,且达到显著水平(Tajima’sD=-2.392 771,P<0.01;Fu and Li’sD*=-4.576 21,P<0.02;Fu and Li’sF*=-4.523 57,P<0.02),错配分布曲线呈现为单峰模式(图3),表明福建茶树群体可能经历了扩张事件,显著偏离了稳定群体。

实线代表期望值,虚线代表观察到的碱基差异分布。图3 错配分布曲线Figure 3 Mismatch distribution curve
3 讨论与结论
单倍型多样性(Hd)和核苷酸多样性(Pi)是衡量遗传变异的重要指标,能很好地反映物种的遗传多样性水平[12]。研究共检测到7种单倍型,单倍型多样性为0.525,核苷酸多样性为0.001 89。与核苷酸多样性相比,单倍型多样性相对较高,出现这种情况可能是瓶颈反应后茶树群体扩张的原因。少量碱基突变能迅速增加单倍型多样性,但很难在短期内积累较多的核苷酸变异。Hap2、Hap4、Hap5、Hap6和Hap7为稀有单倍型,出现在福安、武夷山、政和和永春地区。政和、福鼎和永春地区茶树样本少,检测到的单倍型少。Hap1和Hap3为常见单倍型,表明这两个单倍型相对稳定。研究表明,植物DNA单倍体多样性(hd)的平衡值为0.67,表明51个福建茶树的单倍型多样性(Hd=0.525)水平低于平均值,从一定程度上说明福建茶种的遗传多样性是较低的[13]。
遗传距离、遗传分化系数和基因流是衡量群体多态性的重要参数。51个福建茶树样本根据原产地分为5个群体;永春和建阳茶树样本数量各1个,不能构成群体,不能反映出永春和建阳地区的遗传距离、遗传分化系数和基因流。
遗传距离表明群体间或个体间的遗传区别,它是探究遗传多样性的前提,也可以反映群体间演化过程[14]。武夷山与其他4个茶树群体间的遗传距离(0.001 5~0.003 3)大于这4个茶树群体两两之间的遗传距离(0.000 3~0.002 5);福安与福鼎茶树群体间的遗传距离为0.000 3;福安与政和茶树群体间的遗传距离为0.002 2;福安与福鼎茶树群体亲缘关系较近,而与政和茶树群体亲缘关系较远。通过分析种群内及种群间遗传多样性分析,可以为资源圃内的茶树引种提供参考。
遗传分化系数(Fst)和基因流(Nm)表征群体间遗传分化程度。当Fst介于0~0.05,群体间差异小;当Fst介于0.05~0.15,群体间分化程度低;当Fst介于0.15~0.25,说明群体间分化程度中等;当Fst大于0.25时,表明群体间分化程度高[15]。当Nm大于4,表明群体随机交配;当Nm小于1,表明群体可能朝着遗传分化的方向发展。武夷山与安溪、福鼎、政和茶树群体间Fst均小于0.05,Nm均大于4,表明武夷山与这3个茶树群体之间遗传分化很小,基因交流频繁。福安与福鼎茶树群体间的Fst为0.107 41,Nm为2.083 40,表明福安和福鼎茶树群体之间存在低度分化,有不同程度的交流。福安与政和茶树群体间Fst为0.016 17,Nm为15.210 73,表明福安和政和茶树群体之间无差异并随机交配。出现以上现象的原因:一方面可能与茶树栽培的选育方法有关,除自然条件外不同群落的迁移和杂交,骨干亲本相似;也存在人工引种使不同地区的茶树不断杂交,不同群体的茶树基因交流频繁,群体亲缘关系密切[16]。另一方面,在实验期间,茶树的样本数量因地区而异,对茶树群体结构和遗传分化的研究在一定程度上被削弱。
通过福建茶树两两序列变异的中性检验及错配分布曲线分析结果表明,福建茶树群体在进化过程中经历了群体扩张。出现扩张事件的原因可能是经过长期的育种栽培,一些有良好品质的福建茶树被大规模种植,遗传多样性降低。

