NADPH依赖型谷氨酸脱氢酶的辅酶特异性改造
陆利兵, 周海胜, 吴坚平, 杨立荣
(浙江大学 化学工程与生物工程学院 生物工程研究所,杭州 310027)
非蛋白质氨基酸作为手性结构单元,可用于制备多种药物分子,在医药、农药、食品等行业中发挥着重要作用[1-6]。相比化学合成和手性拆分,酶催化不对称合成制备手性非蛋白质氨基酸,具有立体选择性严格、反应条件温和以及过程绿色等优点,是一种潜在的优势方法[7-12]。利用谷氨酸脱氢酶(glutamate dehydrogenase,GDH,EC 1.4.1.2-1.4.1.4)催化酮酸生成相应的非蛋白质氨基酸具有过程简单、原料转化率高、底物谱广等优势[13-16]。但目前开发应用的谷氨酸脱氢酶基本都是NADPH辅酶依赖型,相对于辅酶NADH,NADPH存在价格高昂、稳定性差等劣势,限制了谷氨酸脱氢酶的应用。
将谷氨酸脱氢酶从NADPH依赖性改造为NADH依赖性,能显著降低过程成本,提其高工业化应用前景。虽然NADPH依赖型谷氨酸脱氢酶辅酶特异性的分子改造未见报道,但其他烟酰胺辅酶依赖型酶蛋白的辅酶特异性改造已有很多成功的实例[17-19]。1990年,Scrutton等[20]首次报道了运用于辅酶特异性改造的蛋白质工程。诺贝尔奖得主Arnold等[21]设计了一个辅酶特异性改造的在线设计工具——cofactor specificity reversal-structural analysis and library design (CSR-SALAD),实现了多种氧化还原酶的辅酶特异性改变。华东理工大学的许建和团队在此基础上建立了Cofactor specificity reversal: small-and-smart library design (CSR-SaSLiD)策略,成功实现了7β-羟基类固醇脱氢酶从NADPH特异性到NADH特异性的改变,并应用于熊去氧胆酸的生产[22]。
本实验室先前对来源于Pseudomonasputida的NADPH特异性的谷氨酸脱氢酶(PpGDH)进行了分子改造,拓宽了其底物谱[13-14,23]。本研究拟对PpGDH进行辅酶特异性改造,以获得NADH依赖型突变体;并尝试通过分子结构解析和动力学参数测定,阐明辅酶特异性改变的机理。
1 材料与方法
1.1 菌株与培养基
菌株:来源于Pseudomonasputida的谷氨酸脱氢酶基因(NCBI登录号为NP_742836.1)构建于表达载体pET-28a(+),其表达宿主菌株为E.coliBL21(DE3),由本实验室保藏。LB液体培养基(g/L):酵母粉5,胰蛋白胨10,NaCl 10,调pH值至7.0,固体培养基添加2%的琼脂粉,各培养基分别添加终浓度为50 mg/L的卡那霉素。
1.2 试剂
2-羰基-4-(羟基甲基膦酰基)丁酸(PPO)由本实验室合成;L-草铵膦购自阿拉丁试剂(上海)有限公司;烟酰胺类辅酶(NAD+,NADP+,NADH,NADPH)购自深圳邦泰生物工程有限公司;卡那霉素、异丙基-β-D-硫代半乳糖苷(IPTG)、琼脂粉购自北京鼎国生物技术有限责任公司;PrimeSTAR©MAX DNA Polymerase购自大连Takara公司;质粒DNA提取试剂盒购自杭州Axygen公司;5×Cell Buffer、Exnase II、Fast Digest DPNI购自美国Thermo Fisher Scientific公司;α-酮戊二酸、苯乙醛酸、丙酮酸、3-甲基-2-氧丁酸、4-甲基-2-氧戊酸、三甲基丙酮酸购自阿拉丁试剂(上海)有限公司;2-氧代戊酸、3-甲基-2-氧戊酸、2-氧基-4-苯基丁酸购自梯希爱(上海)化成工业发展有限公司;其余试剂为国产分析纯。
1.3 同源重组及高通量筛选
通过质粒DNA提取试剂盒提取含有PpGDH基因的质粒pET-28a(+)。以提取的质粒为模板,以5′-gcg-gctcggactttgacccgRWKggcaagagcgacgccgaagt-3′(K137X-F)、5′-gcgtcccactgggcgtcggtcagcc cggcttctgcatacaaggtaccttcGYY-MTCagacagcgagatcaccttgc-3′(D264X/S265X/R293X-R)为引物扩增线性化短片段;以5′-cgggtcaaagtccgagccgcccttgccgccgcccatggg-3′(K137X-R)、5′-accgacgcccagtgggacgccttgatggagctgaaaaacgtcaagcgcgga-VRKatcagcgagctggccgggcaa-3′ (D264X/S265X/R293X-F)为引物扩增线性化长片段,长片段经消化后与短片段进行同源重组(表1),重组后的产物转入表达宿主E.coliBL21(DE3)中,获得相应的突变库文库。以PPO为底物,通过以NADH减少量为基准的高通量方法进行初筛,通过HPLC测定产品L-草铵膦的生成量进行复筛。引物合成及DNA测序由杭州擎科梓熙生物技术有限公司完成。

表1 同源重组反应体系
1.4 重组GDH的表达、纯化
表达重组GDH的大肠杆菌在LB固体培养基中37 ℃培养过夜;挑取单菌落至LB液体培养基中(试管),37 ℃培养7~8 h后再转接至LB液体培养基中(摇瓶),37 ℃培养至OD600为0.6~0.8,将温度降至18 ℃,并加入终浓度为0.5 mmol/L的IPTG诱导16 h。离心收集细胞后进行蛋白纯化,蛋白纯化按周海胜等[24]的操作进行。
1.5 酶活测定

1.6 酶学性质研究

最适pH值及稳定性:测定最适pH值确定范围为3.0~10.0时,所用反应缓冲液如下:柠檬酸-磷酸氢二钠缓冲液(pH 3.0~6.0),磷酸盐缓冲液(pH 6.0~8.0),Tris-HCl缓冲液(pH 8.0~9.0),甘氨酸-NaOH缓冲液(pH 9.0~10.0),其余条件与酶活检测体系(以PPO为底物)一致,以酶活最高为100%,计算相对活力。pH稳定性通过测定酶蛋白在不同pH缓冲液中保存24 h后剩余的酶活进行表示。
1.7 动力学参数测定

1.8 分子同源建模和分子对接
原始PpGDH的三维同源模型是谷氨酸棒状杆菌的谷氨酸脱氢酶晶体结构(PDB ID: 5IJZ,一致率为71.4%)为模板在SWISS-MODEL服务器https:∥swissmodel.expasy.org/生成的。PpGDH突变体的结构是在同源模型的基础上使用Accelrys Discovery Studio 2.5中的Build mutants package构建的。
分子对接是通过Discovery Studio中的CDOCKER模块进行。受体蛋白通过去除所有束缚水分子,加入氢原子,施加CHARMm力场进行优化;PPO分子通过施加CHARMm力场进行优化。分子对接姿势根据分数函数进行排序,分数函数用于预测分子在酶活性位点的结合亲和性。使用Pymolwin处理复合物数据。
2 结果与分析
2.1 PpGDH的辅酶特异性改造
将PpGDH的蛋白PDB文件输入http:∥www.che.caltech.edu/groups/fha/CSRSALAD/index.html,获得可能改变辅酶特异性的4个位点K137、D264、S265及R293,网站建议筛选库大小为768个单菌落[21]。为提高筛选效率,可以通过简并密码子策略来提高突变文库的质量[25]。按1.3的方法以K137X-F、D264X/S265X/R293X-R为引物扩增短片段,以K137X-R、D264X/S265X/R293X-F为引物扩增长片段,将长、短片段进行同源重组,建立辅酶特异性改造突变库。
通过对900个单菌落进行高通量初筛后获得14个对PPO催化活力增强的转化子,经过HPLC复筛,获得了6个酶活提升不太明显(<300%)的阳性突变体[图1(a)],以及5个酶活明显增强的阳性突变体见图1(b)。原始PpGDH在辅酶NADH存在的条件下对PPO几乎没有活力,Asp264、Arg293这两点对PpGDH的辅酶特异性有较大影响,其中单点突变体D264V获得的NADH酶活最大,达到140 U/L,两点突变株D264Y/R293I酶活达到32.5 U/L。

(a)筛选获得的6个酶活提升不明显的突变株;(b)筛选获得的5个酶活提升明显的突变株。图1 氨酸脱氢酶及突变体对PPO催化活力Figure 1 Catalytic activity of glutamate dehydrogenase and the mutant toward PPO
2.2 PpGDH-D264V动力学参数测定
为了解释辅酶特异性改变的原因,分别测定原始PpGDH及突变体D264V对NADH及NADPH的动力学参数。如表2所示,相对于原始PpGDH,突变体D264V对NADH、NADPH的Km与kcat值发生了较为明显的变化。D264V对NADH的催化效率(kcat/Km)较原始PpGDH提升了近9倍,对NADPH的催化效率较原始PpGDH降低了近180倍。D264V相对于原始PpGDH,对NADH的偏好性(Ratio ofkcat/Km)增强了1 607倍,表明D264V具有较为明显的辅酶特异性改造效果。
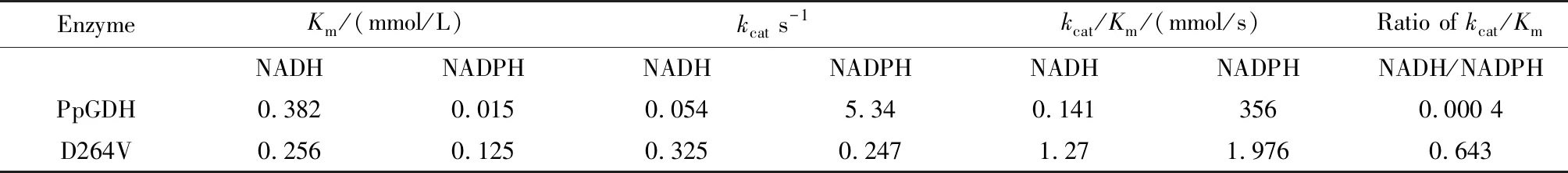
表2 原始PpGDH及突变体对NADH和NADPH的动力学参数
2.3 PpGDH-D264V的辅酶特异性转变的机理解析
为了解析D264V单点突变改变辅酶特异性的原因,基于DS分子对接和PYMOL作图,分析原始PpGDH及突变体与辅酶因子(NADPH/NADH)的结合模式。由图2(a)可知,NADPH的2′-磷酸基与邻近残基形成氢键而稳定存在,而在图2(c)中,NADPH的2′-磷酸基由于空间位阻和静电排斥而降低了与突变体D264V的相互作用。Asp264突变为Val264后,与NADH的腺苷核糖的2′-和3′-羟基形成稳定的氢键,见图2(b)和(d)。
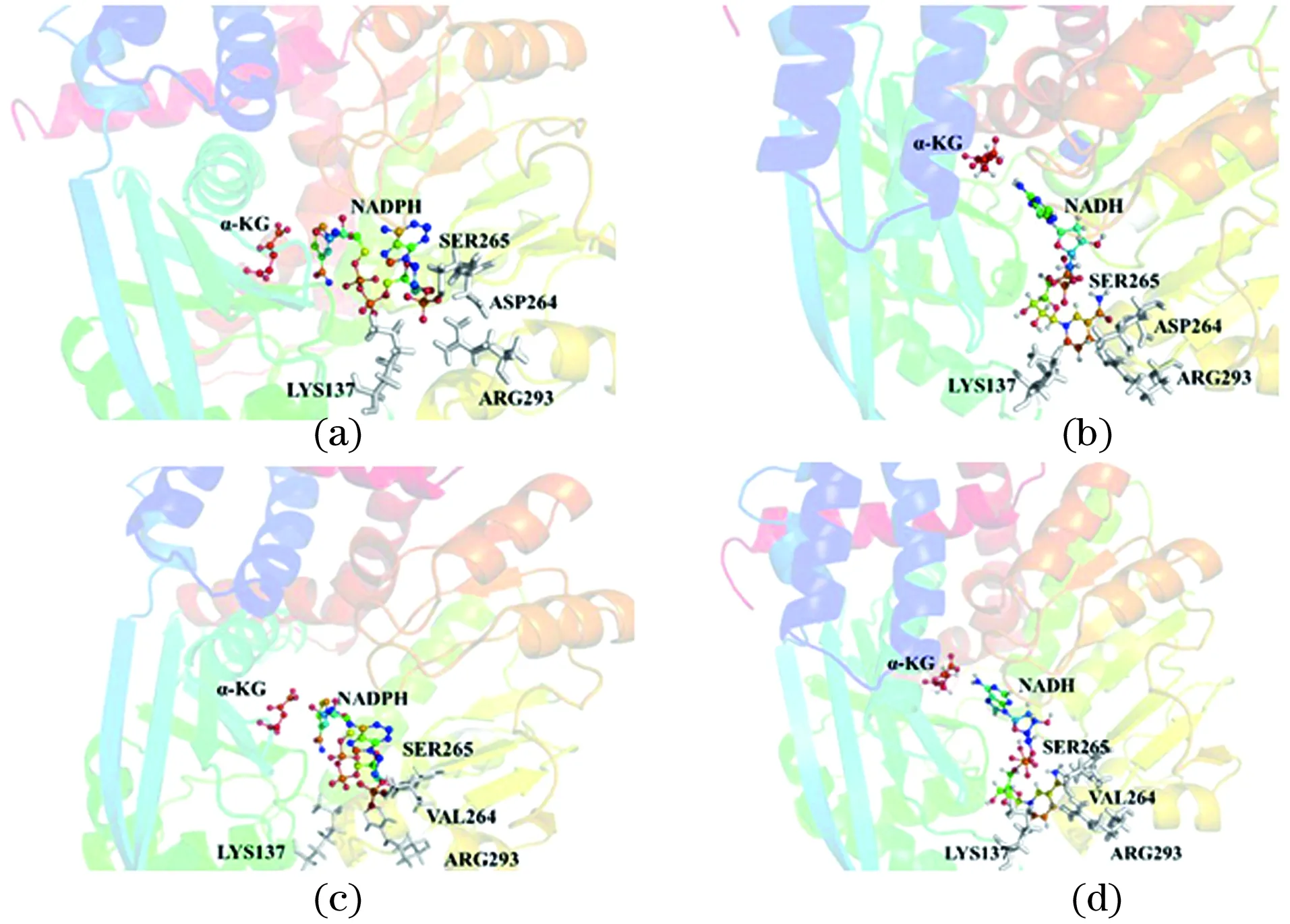
图2 原始PpGDH(a,b)、突变体D264V(c,d)与NADPH(左)和NADH(右)结合模式分析Figure 2 Binding mode of NADPH(left)and NADH(right)in original type(a, b), the mutant D264V(c, d)
2.4 PpGDH-D264V酶学性质研究
2.4.1 最适温度与温度稳定性

2.4.2 最适pH值及稳定性
酶改造会影响构象变化,从而对酶本身的最适pH值及稳定性产生影响。如图4(a)所示,PpGDH-D264V催化PPO还原胺化的最适pH值为8.0,其在pH 6~8具有良好的稳定性,35 ℃保存24 h后仍保留80%以上的酶活,故后续催化反应在最适pH值附近(pH 7.5~8.0)进行。与PpGDH[图4(b)]相比,最适pH值仍为8.0,在碱性环境下pH稳定性有所增强。
2.4.3 PpGDH-D264V底物特异性研究
以不同的α-酮酸为底物、NADH为辅酶,分别测定原始PpGDH和突变体D264V的酶活。从表3可以看出,突变体D264V较原始酶相比,在以NADH为辅酶催化各种底物酮酸的活力均有不同程度的增加,表明突变体D264V实现了对原始酶蛋白的辅酶特异性转变,尤其是可以以NADH为辅酶制备多种非蛋白质氨基酸,如L-草铵膦、L-正缬氨酸、L-叔亮氨酸、L-高苯丙氨酸以及L-苯甘氨酸;同时也表明在线工具计算突变位点、获得相应的辅酶特异性改造突变体的方法是可行的。
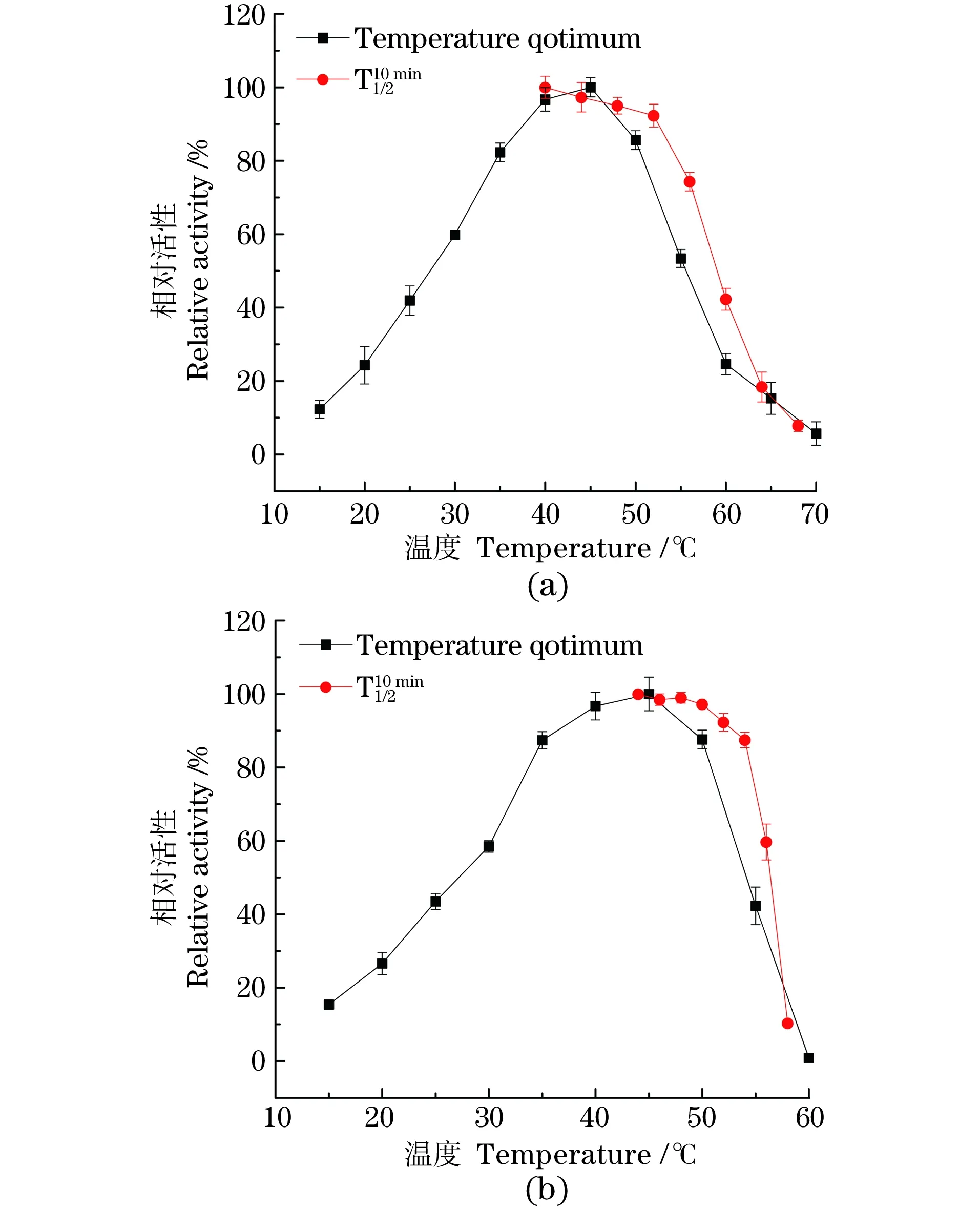
图3 PpGDH-D264V(a)和PpGDH(b)最适温度及稳定性Figure 3 Temperature optimum and of original type(b)and the mutant(a)

图4 PpGDH-D264V(a)和PpGDH(b)最适pH值及稳定性Figure 4 pH optimum and pH stability of original type(b)and the mutant(a)

表3 底物特异性研究
3 结论
选择NADPH依赖性的谷氨酸脱氢酶PpGDH作为蓝本,通过半理性设计改造其辅酶特异性,实现了谷氨酸脱氢酶从NADPH依赖型到NADH依赖型的转变,降低了其应用过程中的辅酶成本。研究发现Asp264、Arg293对PpGDH的辅酶特异性有较大影响,获得了最优突变体D264V,其NADH酶活(以PPO为底物)达到0.65 U/mg。通过酶催化动力学参数测定发现,与原始PpGDH相比,突变体D264V对NADH的偏好性(Ratio ofkcat/Km)增强了1 607倍。基于分子对接可知,突变体NADH偏好增强的原因为Val264与NADH的腺苷核糖的2′-和3′-羟基形成稳定的氢键。对D264V突变体进行酶学性质表征:其最适温度为45 ℃、最适pH值为8.0,并具有较为广泛的底物谱,可用于制备多种非蛋白质氨基酸产品,如L-草铵膦、L-正缬氨酸、L-叔亮氨酸、L-高苯丙氨酸以及L-苯甘氨酸,为谷氨酸脱氢酶的工业应用奠定了基础。

