小鼠CCL2蛋白原核表达及纯化分析
马振玲, 王 雷, 乔柳惠, 刘 薇
(河南农业大学 生命科学学院,郑州 450002)
CCL2(CC chemokine ligand 2),又称为单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP1),是C-C趋化因子的一员,能够募集单核细胞、巨噬细胞等到炎症部位并调节它们的活性,成纤维细胞、上皮细胞、单核细胞和肿瘤细胞均能够表达CCL2[1-2]。CCL2在多种肿瘤如结直肠癌、乳腺癌、卵巢癌中高表达,与患者不良预后密切相关[3]。研究表明,CCL2在急性髓系白血病(acute myeloblastic leukemia,AML)、急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)中同样发挥重要功能。AML患者血浆中CCL2含量比正常对照组显著性升高,且CCL2促进单核细胞向AML细胞的迁移[4-5]。同时,CCL2在AML、ALL患者血浆、骨髓及转移部位高表达,提示CCL2与白血病耐药、不良预后呈正相关。以上研究主要集中于CCL2在白血病中的表达量分析,但是CCL2在白血病中的作用机制报道较少。深入研究CCL2在白血病中的作用机制,有助于我们从细胞因子角度开展药物靶向治疗,为白血病的治疗、预后提供新的思路和分子靶点。
前期研究发现,CCL2在白血病骨髓微环境中表达显著性升高,而CCL2的来源以及在白血病中的调控机制尚不清楚[6]。肿瘤微环境中CCL2表达上调的可能原因:(1)肿瘤细胞本身表达CCL2;(2)肿瘤细胞受到刺激产生大量CCL2;(3)基质细胞出于对刺激的应激反应产生CCL2[7]。为了探索外源性CCL2在白血病中的功能,本研究构建了pGEX-4T-CCL2原核表达载体,并在大肠杆菌BL21(ED3)中表达和纯化了CCL2融合蛋白,初步检测了CCL2重组蛋白对白血病细胞黏附和细胞迁移的影响,旨在为CCL2在白血病功能及机制的深入研究提供材料和奠定基础。
1 材料与方法
1.1 材料
原核表达载体pGEX-4T-1、Escherichiacoli(E.coli)DH5α、E.coliBL21(DE3)菌株和C1498细胞为本实验室保存,pECMV-CCL2-m-FLAG载体购自淼灵质粒共享平台。引物合成及DNA测序由郑州瑞优生物科技有限公司完成。KOD高保真酶购自ToYoBo生物科技有限公司。限制性内切酶BamH Ⅰ、XhoⅠ、核酸外切酶Ⅲ购自NEB有限公司。DNA Marker购自博迈德生物有限公司。质粒提取试剂盒、DNA凝胶回收试剂盒购自天根生化科技有限公司。谷胱甘肽琼脂糖凝胶(Glutathione Sepharose 4B)购自GE Healthcare公司。IPTG、考马斯亮蓝R-250购自赛国生物科技。蛋白Marker购自赛默飞世尔科技公司。抗GST标签单克隆抗体购自北京全式金生物科技有限公司。抗CCL2单克隆抗体购自武汉三鹰生物技术有限公司。HRP标记山羊抗小鼠IgG、ECL化学发光检测试剂购自庄盟生物。其他常规试剂为分析纯。
1.2 方法
1.2.1 引物设计及小鼠CCL2基因扩增
根据小鼠CCL2mRNA序列(NM_011333)设计引物,mCCL2-F:5′- CGCGTGGATCCATGCAGGTC-3′,mCCL2-R:5′- GGCCGCTCGAGCTAGTTCACTGT-3′(下划线为BamH Ⅰ和XhoⅠ酶切位点,前5个碱基为与载体重复序列),由郑州瑞优生物科技有限公司合成。以pECMV-CCL2-m-FLAG载体为模板,PCR扩增小鼠CCL2基因。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,25个循环;72 ℃再延伸5 min。扩增完成之后,PCR产物用1.0%的琼脂糖凝胶电泳检测,切胶并用DNA凝胶回收试剂盒回收。
1.2.2 LIC法构建重组载体pGEX-4T-CCL2
pGEX-4T-1载体用BamH Ⅰ和XhoⅠ于37 ℃酶切2 h,用1.0%琼脂糖凝胶检测并切胶回收。将PCR回收产物与载体双酶切回收产物按5∶1的比例混合,加入核酸外切酶Ⅲ冰上放置1 h,加入1 μL 0.5 mmol/L EDTA(pH 8.0),60 ℃处理5 min终止反应。连接产物转化E.coliDH5α感受态细胞,在氨苄青霉素LB平板上筛选,阳性克隆经菌液PCR、双酶切鉴定和DNA测序。
1.2.3 重组蛋白的诱导表达
将pGEX-4T-CCL2重组质粒转化E.coliBL21(DE3)感受态细胞,挑取单菌落接种于含氨苄青霉素的LB液体培养基中,37 ℃振荡培养过夜。次日,按1∶100的比例接种于2×YTA培养液中,37 ℃培养2~3 h至OD600达到0.6~0.8,取一个试管作为阴性对照,其余组加入IPTG至终浓度为0.1、0.3或0.5 mmol/L,20 ℃~28 ℃诱导5~10 h。离心收集菌液,超声波破碎,4 ℃、12 000 r/min离心10 min收集上清液。加入4×SDS loading buffer,100 ℃煮沸10 min进行10% SDS-PAGE蛋白电泳检测。考马斯亮蓝R-250染色3 h,脱色液脱色处理后分析融合蛋白表达情况。
1.2.4 重组蛋白的纯化及鉴定
按照上述条件诱导100 mL菌液,离心收集,超声裂解菌液,4 ℃、12 000 r/min离心10 min收集上清液。取1 mL Glutathione Sepharose 4B装入5 mL层析柱中,于4 ℃加入5倍柱床体积的PBS平衡。将收集的蛋白上清液过柱,反复将流穿液过柱3次,用5 mL PBS洗涤3次,最后用2 mL还原谷胱甘肽洗脱液洗脱,收集样品进行10% SDS-PAGE蛋白电泳检测。将蛋白条带转至PVDF膜上,经5%牛血清白蛋白封闭2 h后,4 ℃孵育小鼠抗GST单克隆抗体、小鼠抗CCL2单克隆抗体过夜。1×TBST洗膜3次,每次12 min;加入HRP标记山羊抗小鼠IgG室温孵育2 h,1×TBST洗膜3次,每次12 min。最后用ECL发光试剂显影。
1.2.5 CCL2对C1498细胞黏附的检测
C1498细胞计数,按照每孔10 000个细胞接到96孔板中,设置GST蛋白为对照组,在实验组中加入200、500 ng的CCL2重组蛋白,3 h后吸去培养基加入CCK8或者用化学发光仪检测荧光情况,分析细胞黏附能力。
1.2.6 CCL2对C1498细胞迁移的检测
将微孔直径为8 μm的transwell小室放置于24孔板中,在下室加入不同浓度(200和500 ng/mL)的重组CCL2蛋白,并以GST蛋白作为阴性对照,上室加入不含血清的C1498细胞,放置于37 ℃培养箱中,24 h后计数下室细胞,分析外源CCL2对白血病细胞迁移能力的调控作用。
2 结果与分析
2.1 小鼠CCL2基因扩增
以含目的基因的pECMV-CCL2-m-FLAG载体为模板进行小鼠CCL2基因的扩增,PCR产物经1%琼脂糖凝胶电泳,如图1所示,在250~500 bp且靠近500 bp处出现条带,与预期目的片段大小(447 bp)相一致。

M:DNA Marker;1:PCR产物。图1 小鼠CCL2基因PCR扩增Figure 1 Amplification of mouse CCL2
2.2 pGEX-4T-CCL2原核表达载体的构建
将连接产物转化E.coliDH5α感受态细胞,挑取阳性克隆接种于含氨苄青霉素的LB液体培养基中,进行菌液PCR鉴定。结果[图2(a)]显示,1~5号菌液PCR产物经1%琼脂糖凝胶电泳,在接近500 bp处可见特异性条带,条带大小与预期片段大小相符。选取1~3号克隆提质粒,进行双酶切鉴定。经BamH Ⅰ和XhoⅠ双酶切后产生了约500 bp的片段,与PCR扩增的目的片段大小一致[图2(b)]。最后对1~3号克隆送公司测序,与GenBank报道序列比对结果显示一致,表明成功构建了pGEX-4T-CCL2原核表达载体。
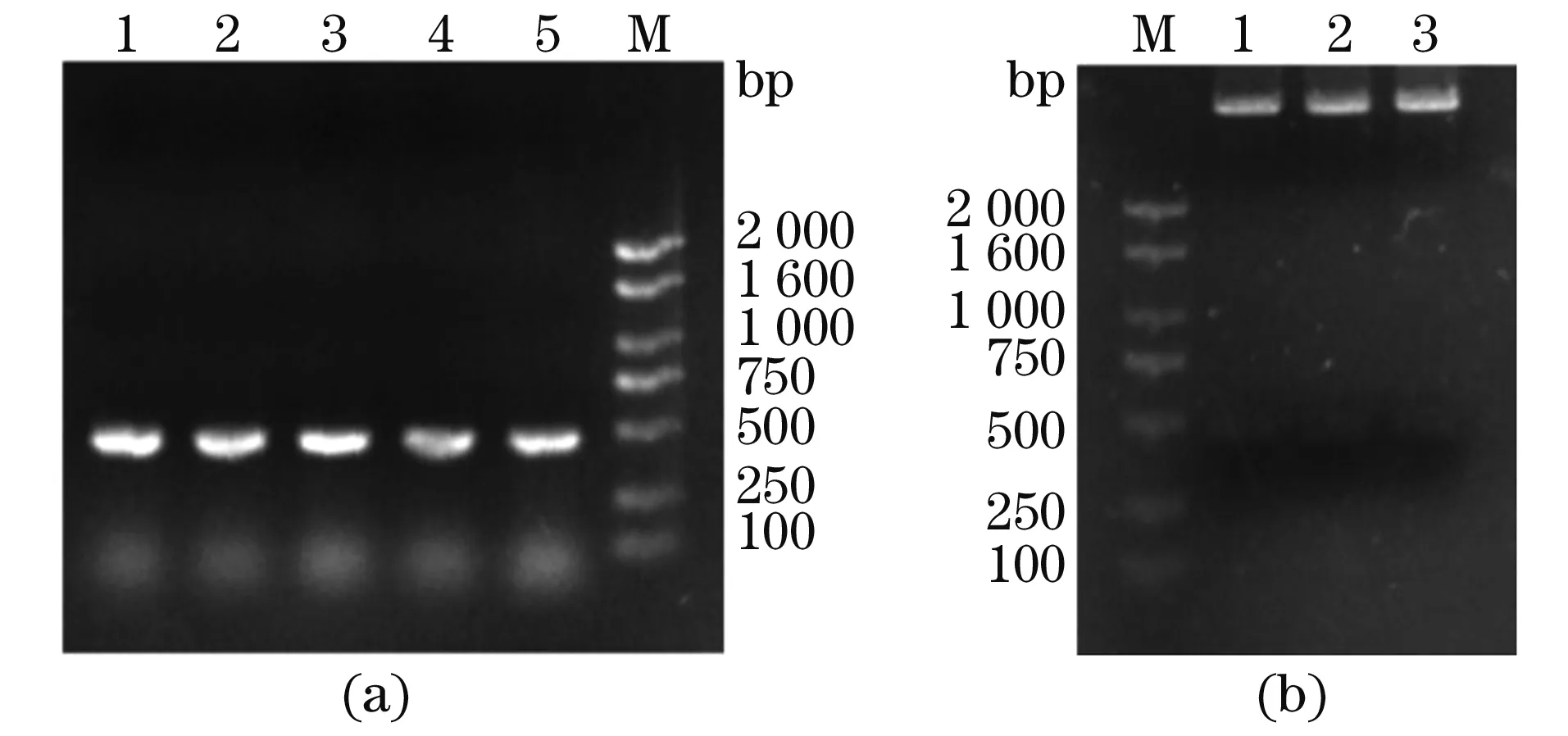
(a)菌液PCR鉴定(M:DNA Marker,1~5:菌液PCR产物);(b)重组质粒pGEX-4T-CCL2双酶切(M:DNA Marker,1~3:双酶切克隆)。图2 pGEX-4T-CCL2重组子的鉴定Figure 2 Identification of pGEX-4T-CCL2
2.3 GST-CCL2融合蛋白的表达
分别用不同温度(28 ℃、20 ℃),以及不同IPTG浓度(0.1、0.3 和0.5 mmol/L)诱导表达融合蛋白,取样进行SDS-PAGE电泳并经考马斯亮蓝R-250染色。结果发现IPTG浓度对GST-CCL2融合蛋白的表达影响不大。在28 ℃诱导表达6 h没有可溶性GST-CCL2表达,当温度降到20 ℃时,SDS-PAGE显示在40 ku处有与GST-CCL2理论分子质量(41.3 ku)相似的可溶性蛋白存在,而未诱导组则未见蛋白条带(图3)。

(a)28 ℃诱导GST-CCL2融合蛋白的表达(M:蛋白分子量标准,1~4分别为0、0.1、0.3和0.5 mmol/L IPTG);(b)20 ℃诱导GST-CCL2融合蛋白的表达(M:蛋白分子量标准,1~4分别为0、0.1、0.3和0.5 mmol/L IPTG,箭头所指为GST-CCL2)。图3 SDS-PAGE电泳检测GST-CCL2融合蛋白的表达Figure 3 SDS-PAGE analysis of the GST-CCL2 expression
2.4 GST-CCL2融合蛋白的纯化及鉴定
大量诱导菌液,超声波裂解后离心取上清液过Glutathione Sepharose 4B凝胶柱,用还原型谷胱甘肽洗脱,结果显示成功纯化出GST-CCL2融合蛋白[图4(a)],并成功纯化出GST蛋白[图4(b)]。GST-CCL2融合蛋白经Western Blot检测,分别孵育GST和CCL2抗体,化学发光显色后结果如图4(c)和(d)所示,融合蛋白可以与GST抗体发生特异性反应[图4(c)],也可与CCL2抗体发生特异性反应[图4(d)]。除了GST-CCL2与GST抗体结合外,还有部分GST蛋白出现特异性结合,说明在纯化过程中可能有融合蛋白由于GST标签丢失而不能通过亲和层析纯化。

(a)SDS-PAGE检测GST-CCL2[M:蛋白分子量标准,1:0 mmol/L IPTG,2:0.1 mmol/L IPTG,3:流穿液,4:凝胶株,5:洗脱液(箭头所指为GST-CCL2)];(b)SDS-PAGE检测GST[M:蛋白分子量标准,1:0 mmol/L IPTG,2:0.1 mmol/L IPTG,3:洗脱液(箭头所指为GST)]; (c)GST抗体Western Blot检测GST-CCL2[1:0 mmol/L IPTG,2:0.1 mmol/L IPTG,3:洗脱液(箭头所指为GST-CCL2)];(d):CCL2抗体Western Blot检测GST-CCL2[1:0 mmol/L IPTG,2:0.1 mmol/L IPTG,3:洗脱液(箭头所指为GST-CCL2)]。图4 GST-CCL2融合蛋白的纯化与鉴定Figure 4 Purification and identification of GST-CCL2 fusion protein
2.5 CCL2对C1498细胞黏附的检测
为了检测外源性CCL2对白血病细胞黏附的影响,利用重组蛋白处理进行细胞黏附实验。在C1498细胞中加入200 和500 ng小鼠CCL2重组蛋白,以GST蛋白为阴性对照,结果如图5所示。说明CCL2能够促进C1498细胞黏附。

(a)200 ng CCL2重组蛋白对C1498细胞黏附的影响;(b)500 ng CCL2重组蛋白对C1498细胞黏附的影响。** 为P<0.01,*** 为P<0.001。图5 CCL2对白血病细胞黏附的影响Figure 5 Effect of CCL2 on leukemia cell adhesion
2.6 CCL2对C1498细胞迁移的检测
为了检测外源性CCL2对白血病细胞迁移的作用,利用重组蛋白进行细胞迁移实验。加入200 和500 ng小鼠CCL2重组蛋白,同时设立GST蛋白为阴性对照组。结果显示CCL2能够促进C1498细胞迁移(图6)。
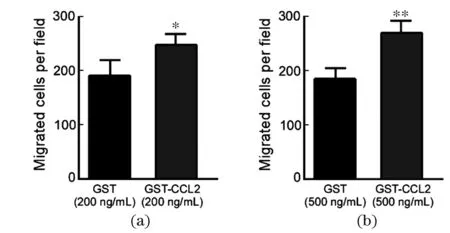
(a)200 ng CCL2重组蛋白对C1498细胞迁移的影响;(b)500 ng CCL2重组蛋白对C1498细胞迁移的影响。* 为P<0.05,** 为P<0.01。图6 CCL2对白血病细胞迁移的影响Figure 6 Effect of CCL2 on leukemia cell migration
3 讨论与结论
本研究采用不依赖连接反应克隆(ligation-independent cloning,LIC)的方法构建原核表达载体,在设计引物时在目的片段的5′端添加与载体同源黏性末端,依赖核酸外切酶Ⅲ的3′-5′外切酶活性,利用带缺口和突出端的DNA复合物在细菌中能够被有效修复的特点,高效地得到了重组质粒。LIC法不需要连接酶的参与,并且克服了经典连接克隆方法长片段连接大载体难度大、酶切位点有限、受酶切位点限制大的缺点,使得基因的克隆更加灵活、快捷及高效[8]。我们随机挑选了5个克隆摇菌后进行菌液PCR鉴定,结果显示5个克隆都是阳性;进一步选取3个克隆提质粒进行双酶切鉴定,结果均为阳性,最终测序结果也表明序列及插入方向的正确性。目前,LIC法已被广泛地用于GST、His标签以及基因敲除载体构建中[9-11]。
pGEX-4T-1作为常用的表达GST融合蛋白的原核表达载体,具有增加重组蛋白可溶性的优点。但很多GST融合蛋白表达过程中容易发生GST标签的丢失,导致部分重组蛋白不能高效的纯化,WB结果显示GST-CCL2存在标签丢失和降解的现象,具体原因还不明确[12-13]。在表达纯化GST-CCL2时发现,温度对重组蛋白的表达具有明显的影响。在28 ℃诱导条件下,SDS-PAGE结果显示没有可溶性蛋白存在,当温度降至20 ℃时可以获得可溶性GST-CCL2蛋白,说明优化诱导温度在蛋白纯化过程中发挥重要作用。天然CCL2富含苏氨酸、丝氨酸,约有50%蛋白在不同位点发生不同程度的糖基化修饰[14]。有研究发现啮齿动物CCL2突变缺失糖基化的C末端后,不能发生二聚化/寡聚化,但具有更高的趋化作用,揭示CCL2介导的信号传递需要CCL2以单体形式存在[15]。Ruggiero 等[16]在酵母中表达人源CCL2,产生了不同的糖基化重组蛋白混合物,体外趋化实验显示,相对于大肠杆菌中表达的非糖基化CCL2,糖基化CCL2活性降低了4~20倍,但是在37 ℃长时间孵育能够保持稳定性。NEEDHAM 等[17]通过LCR/MEL系统表达的糖基化和非糖基化人CCL2具有同等的生物学活性。在纯化CCL2重组蛋白过程中发现CCL2容易降解,可能与CCL2未发生糖基化修饰有密切关系。
目前,多项研究表明肿瘤组织中不同细胞来源的CCL2可以促进肿瘤细胞增殖、转移以及侵袭,小鼠实验也发现用CCL2或CCR2中和型抗体阻断CCL2/CCR2轴,能够明显抑制肿瘤的增殖,并且抑制肿瘤的转移[18]。在乳腺癌、前列腺癌、肺癌等恶性肿瘤的临床动物学实验中,阻断CCL2/CCR2轴均能够显著性减弱肿瘤的生长和转移,目前已经开展了靶向阻断肿瘤患者CCL2/CCR2轴的一期、二期临床试验,开发相关药物[19-21]。CCL2在白血病中的功能及机制报道较少,有研究表明白血病细胞的黏附能力与疾病的发生密切相关,ALL细胞可以表达不同的黏附整合蛋白,如T细胞急性淋巴细胞白血病(T cell acute lymphoblastic leukemia,T-ALL)中的LFA-1、B细胞急性淋巴细胞白血病(B cell acute lymphoblastic leukemia,B-ALL)中的VLA-4[22],与白血病的发生发展密切相关。研究发现外源性CCL2能够促进白血病细胞的黏附和迁移,初步揭示了CCL2促进白血病细胞浸润的机制,下一步将深入研究CCL2在白血病中作用的分子机理。趋化因子在肿瘤发生发展及治疗中的功能已经引起越来越多学者的关注。Dong等[23]研究发现,骨髓微环境中Ptpn11发生激活突变时,可以导致造血干细胞的异常最终形成白血病。间充质祖细胞/干细胞中Ptpn11发生突变时,能够引起CCL3的持续表达,进而募集单核细胞至造血微环境,而单核细胞产生的interleukin-1β以及其他炎症因子使恶变造血干细胞过度激活,进而形成白血病。CCL3受体拮抗剂能够有效逆转由骨髓微环境中Ptpn11突变引起的白血病,CCL3可作为白血病治疗的潜在靶点。本研究为深入研究CCL2在白血病发生中的作用机制提供材料并奠定基础,将有助于我们进一步阐明白血病的发病机理,为白血病的临床靶向治疗、预后和预防提供新的思路和分子靶点。

