庐山石韦的化学成分研究
何康 范琳琳 伍天苔 申琳燕 简洁 邹娟
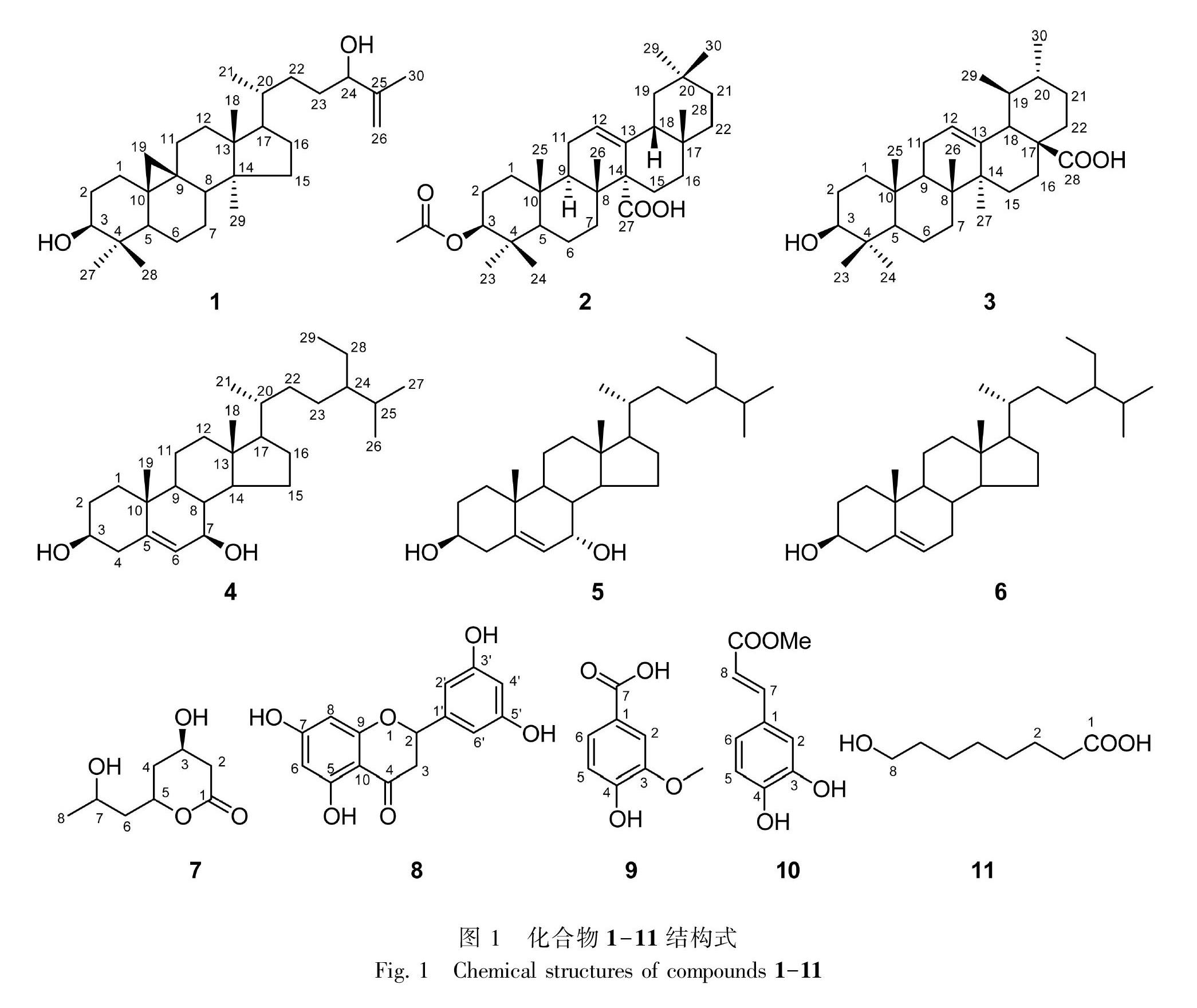
摘 要: 庐山石韦(Pyrrosia sheareri)为贵州少数民族常用药材,但其化学成分研究较少。为更深入研究其化学成分,该文采用大孔吸附树脂、硅胶色谱、葡聚糖凝胶LH-20色谱等分离纯化技术对其乙醇提取物进行分离纯化,采用波谱数据分析及参考文献比对等方法对分离得到的化合物进行结构鉴定。结果表明:从庐山石韦全草中分离得到11个化合物,分别鉴定为环阿尔廷-25-烯-3β,24-二醇(1)、3β-羟基齐墩果-12-烯-27-羧酸(2)、乌索酸(3)、7β-羟基谷甾醇(4)、7α-羥基谷甾醇(5)、β-谷甾醇(6)、3,7-二羟基-5-辛内酯(7)、5,7,3′,5′-三羟基二氢黄酮(8)、香草酸(9)、咖啡酸甲酯(10)、8-羟基辛酸(11)。其中,化合物1和2均为首次从石韦属植物中分离得到,化合物1、2、4、5、7、8、10、11均为首次从庐山石韦中分离得到。
关键词: 庐山石韦, 民族药, 化学成分, 分离纯化, 结构鉴定
中图分类号: Q946
文献标识码: A
文章编号: 1000-3142(2021)11-1862-06
Chemical constituents from Pyrrosia sheareri
HE Kang1, FAN Linlin2, WU Tiantai1, Shen Linyan1, JIAN Jie1, ZOU Juan1*
( 1. Guizhou University of Traditional Chinese Medicine, Guiyang 550025, China; 2. Guizhou
Health Vocational College, Tongren 554309, Guizhou, China )
Abstract: Pyrrosia sheareri is widely used as folk herbs in minority areas of Guizhou Province. However, its chemical constituents are rarely reported. To further study the chemical constituents of P. sheareri, macroporous adsorption resins, silica-gel and sephadex LH-20 columns were employed to isolate and purify chemical constituents of P. sheareri. The structures of obtained compounds were identified by comprehensive spectroscopic analyses and confirmed by comparison of their spectral data with those in the literature. The results were as follows: Eleven compounds were isolated and elucidated respectively as cycloart-25-en-3β,24-diol (1), 3β-acetoxyolean-12-en-27-oic acid (2), ursolic acid (3), 7β-hydroxysitosterol (4), 7α-hydroxysitosterol (5), β-sitosterol (6), 3,7-dihydroxy-5-octanolide (7), 5,7,3′,5′-tetrahydroxy-flavanone (8), vanillic acid (9), caffeic acid methyl ester (10), 8-hydroxyoctanoic acid (11). Compounds 1, 2, 4, 5, 7, 8, 10 and 11 were isolated from this plant for the first time, and compounds 1 and 2 were isolated from this genus for the first time.
Key words: Pyrrosia sheareri, ethnic medicine, chemical constituents, isolation and purification, structure identification
水龙骨科(Polypodiaceae)石韦属(Pyrrosia)植物全世界有100多种,中国现知有37种,贵州约有13种,分布广泛且资源丰富(ECFC,1988),其中庐山石韦(Pyrrosia sheareri)是贵州石韦属植物中资源最丰富的品种之一,在全省均有分布(贵州省中药研究所,1992;邱德文和杜江,2005;潘炉台,2012)。石韦属植物大多数种具有药用价值,并在中国民族民间普遍作为利尿通淋、清热止血药使用,其疗效在《本草纲目》和《神农本草经》等本草古籍中早有记载,其中庐山石韦既被《中国药典》收载(国家药典委员会,2005),同时也为贵州少数民族常用药,苗族称其为“啊咳知”,用于治疗感染及腹泻(贵州省中药研究所,1992),在仡佬族用于抗感染(赵俊华等,2003),以及在毛南族用于治疗支气管炎(孙济平,2006)。
现有研究表明,该属植物中的化学成分主要为三萜类、黄酮类、口山酮类等(Hikinoet al., 1963;韩基善和王明时,1984;陈丽君等,2011),从该属植物中发现的化学成分较少,特别是对庐山石韦的化学成分研究只有零星报道,研究不够深入(韩基善和王明时,1984)。基于庐山石韦在贵州少数民族地区的广泛应用和确切疗效,为更深入研究该民族药的化学成分,阐明其物质基础,本研究通过大孔吸附树脂、硅胶、葡聚糖凝胶等分离技术对其全草的乙醇提取物进行了分离纯化,从中分离得到11个化合物(图1),并经波谱分析和文献比对鉴定了化合物的结构。所得化合物的类型包括三萜、甾体、黄酮、内酯和酚酸等,其中化合物1和2均为首次从石韦属植物中分离得到,化合物1、2、4、5、7、8、10、11均为首次从该种植物中分离得到(图1)。本研究结果进一步丰富了该民族药的化学成分,为其后续的开发与利用奠定了科学基础。
1 仪器与材料
AV-400型超导核磁共振仪(德国Bruker);JEOL 5973 MSD型质谱仪(美国安捷伦公司);J209A-4型植物粉碎机(河南黄骅齐家务科学仪器厂);Buchi R215实验室规模旋转蒸发仪(瑞士步琪实验室仪器公司);Sephadex LH-20葡聚糖凝胶LH-20(美国通用电气医疗集团);GF254制备薄层板及200~300目柱色谱用硅胶(青岛海洋化工有限公司);D101大孔树脂(天津南开化工厂);显色剂为10%硫酸-乙醇溶液,NMR测试溶剂为氘代试剂,其余试剂均由工业纯经重蒸处理后使用。
实验药材于2015年9月采自贵州遵义,原植物经贵州中医药大学赵俊华教授鉴定为水龙骨科(Polypodiaceae)石韦属(Pyrrosia)庐山石韦(Pyrrosia sheareri)。
2 提取与分离
取干燥庐山石韦全草28 kg,粉碎(60~80目)后用90%乙醇/水回流提取3次(每次1 h),合并提取液并过滤,减压浓缩得浸膏(4.2 kg)。浸膏水溶后经D101大孔树脂柱层析,分别经水、50%乙醇和90%乙醇梯度洗脱,得50%和90%乙醇部分。90%乙醇部分(182 g)经硅胶柱层析,二氯甲烷/乙酸乙酯(100∶0→7∶3)梯度洗脱,得6个流分Fr. A90~F90。Fr. B90经重结晶得到化合物6(4.3 g)。Fr. C90经硅胶柱层析,石油醚/乙酸乙酯(100∶1→8∶2)梯度洗脱,再经葡聚糖凝胶LH-20纯化,得化合物1(19 mg)、2(10 mg)、3(28 mg)。Fr. D90经硅胶柱层析,石油醚/乙酸乙酯(100∶1→7∶3)梯度洗脱,再经葡聚糖凝胶LH-20纯化,得化合物4和5(266 mg)。50%乙醇部分(1 187 g)经硅胶柱层析,二氯甲烷/甲醇(95∶5→9∶1)梯度洗脱,得4个流分Fr. A50~E50。Fr. A50经硅胶柱层析,二氯甲烷/乙酸乙酯(100∶1→8∶2)梯度洗脱,再用葡聚糖凝胶LH-20纯化,得化合物7(16 mg)和9(23 mg)。Fr. B50经硅胶柱层析,二氯甲烷/乙酸乙酯(8∶2)梯度洗脱,得化合物10(50 mg)。Fr. C50经硅胶柱层析,二氯甲烷/乙酸乙酯(7∶3)梯度洗脱,得化合物8(138 mg)。Fr. D50经硅胶柱层析,二氯甲烷/乙酸乙酯(8∶2)梯度洗脱,得化合物11(11 mg)。
3 结构鉴定
化合物1 C30H50O2,白色粉末(氯仿)。ESI-MS m/z: 465.4 [M+Na]+。1H-NMR (400 MHz, CDCl3) δ: 4.96 (1H, brs, H-26a), 4.86 (1H, brs, H-26b), 4.04 (1H, t, J = 6.5 Hz, H-24), 3.33-3.29 (1H, m, H-3), 1.75 (3H, s, H-27), 0.99 (6H, s, H-18, 30), 0.91 (3H, s, H-28), 0.86 (3H, d, J = 5.2 Hz, H-21), 0.82 (3H, s, H-29), 0.58 (1H, d, J = 4.2 Hz, H-19a), 0.35 (1H, d, J = 4.2 Hz, H-19b)。13C-NMR (100 MHz, CDCl3) δ: 32.1 (C-1), 30.5 (C-2), 79.0 (C-3), 40.6 (C-4), 47.2 (C-5), 21.3 (C-6), 26.2 (C-7), 48.1 (C-8), 20.1 (C-9), 26.2 (C-10), 26.6 (C-11), 33.0 (C-12), 45.4 (C-13), 49.0 (C-14), 35.7 (C-15), 28.3 (C-16), 52.3 (C-17), 18.2 (C-18), 29.5 (C-19), 36.1 (C-20), 18.4 (C-21), 32.0 (C-22), 31.8 (C-23), 76.5 (C-24), 147.9 (C-25), 111.6 (C-26), 17.7 (C-27), 19.5 (C-28), 25.6 (C-29), 14.2 (C-30)。以上光譜数据与文献(李宛霏等,2016)中cycloart-25-en-3β,24-diol基本一致,故将其鉴定为cycloart-25-en-3β,24-diol。
化合物2 C32H50O4,白色粉末(氯仿)。ESI-MS m/z: 497.4 [M-H]-。1H-NMR (400 MHz, CDCl3) δ: 5.70 (1H, dd, J = 11.2, 2.5 Hz, H-12), 4.51 (1H, dd, J = 11.5, 4.8 Hz, H-3), 2.13 (1H, dd, J = 13.5, 5.8 Hz, H-9), 2.06 (3H, s, H-1′), 1.04 (3H, s, H-26), 1.00 (3H, s, H-25), 0.86 (3H, s, H-24), 0.85 (9H, s, H-23, 28, 30), 0.83 (3H, s, H-29), 0.80 (1H, t, J = 2.5 Hz, H-5)。13C-NMR (100 MHz, CDCl3) δ: 38.1 (C-1), 23.6 (C-2), 80.8 (C-3), 37.6 (C-4), 55.1 (C-5), 18.2 (C-6), 36.4 (C-7), 39.9 (C-8), 46.9 (C-9), 37.0 (C-10), 22.7 (C-11), 126.1 (C-12), 137.4 (C-13), 55.8 (C-14), 22.2 (C-15), 27.6 (C-16), 32.9 (C-17), 49.2 (C-18), 43.8 (C-19), 31.1 (C-20), 34.3 (C-21), 36.6 (C-22), 28.2 (C-23), 16.5 (C-24), 16.8 (C-25), 18.1 (C-26), 180.9 (C-27), 28.3 (C-28), 33.4 (C-29), 23.6 (C-30), 21.4 (C-1′), 171.3 (C-2′)。以上光谱数据与文献(Sun et al., 2003)中3β-acetoxyolean-12-en-27-oic acid基本一致,故将其鉴定为3β-acetoxyolean-12-en-27-oic acid。
化合物3 C30H48O3,白色粉末(氯仿)。1H-NMR (400 MHz, Pyridine-d5) δ: 0.92, 1.05, 1.08, 1.25, 1.27 (each 3H, s, 5×CH3), 1.03 (3H, d, J = 6.4 Hz, H-29), 0.98 (3H, d, J = 6.3 Hz, H-30), 3.48 (1H, dd, J = 10.6, 5.5 Hz, H-3), 5.52 (1H, brs, H-12)。13C-NMR (100 MHz, Pyridine-d5) δ: 39.9 (C-1), 28.6 (C-2), 78.6 (C-3), 39.6 (C-4), 56.3 (C-5), 19.3 (C-6), 30.5 (C-7), 34.1 (C-8), 48.5 (C-9), 37.9 (C-10), 17.9 (C-11), 126.1 (C-12), 139.8 (C-13), 43.0 (C-14), 29.3 (C-15), 25.4 (C-16), 40.4 (C-17), 54.0 (C-18), 40.0 (C-19), 39.9 (C-20), 31.6 (C-21), 37.8 (C-22), 29.2 (C-23), 17.1 (C-24), 16.2 (C-25), 18.0 (C-26), 24.4 (C-27), 180.4 (C-28), 24.1 (C-29), 21.9 (C-30)。以上光谱数据与文献(林晓莹等,2017)中ursolic acid基本一致,故将其鉴定为ursolic acid。
化合物4 C29H50O2,白色粉末(氯仿)。ESI-MS m/z: 431.4 [M+H]+。1H-NMR (400 MHz, CDCl3) δ: 5.35 (1H, brs, H-6), 3.54 (1H, m, H-3), 3.85 (1H, m, H-7), 1.02 (3H, s, H-19), 0.95 (3H, d, J = 6.7 Hz, H-21), 0.86 (3H, t, J = 7.2 Hz, H-29), 0.84 (3H, d, J = 6.8 Hz, H-26), 0.82 (3H, d, J= 6.8 Hz, H-27), 0.72 (3H, s, H-18)。13C-NMR (100 MHz, CDCl3) δ: 37.0 (C-1), 31.6 (C-2), 71.4 (C-3), 41.7 (C-4), 143.5 (C-5), 125.1 (C-6), 73.4 (C-7), 40.9 (C-8), 48.3 (C-9), 36.5 (C-10), 21.1 (C-11), 39.6 (C-12), 43.0 (C-13), 55.4 (C-14), 26.4 (C-15), 28.6 (C-16), 56.0 (C-17), 11.8 (C-18), 19.2 (C-19), 36.1 (C-20), 19.0 (C-21), 34.0 (C-22), 25.9 (C-23), 45.8 (C-24), 29.1 (C-25), 19.8 (C-26), 19.8 (C-27), 23.1 (C-28), 12.0 (C-29)。以上光譜数据与文献(徐静等,2009)中7β-羟基谷甾醇(7β-hydroxysitosterol)基本一致,故将其鉴定为7β-羟基谷甾醇(7β-hydroxysitosterol)。
化合物5 C29H50O2,白色粉末(氯仿)。ESI-MS m/z: 431.4 [M+H]+。1H-NMR (400 MHz, CDCl3) δ: 5.63 (1H, d, J = 4.6 Hz, H-6), 3.56 (1H, m, H-3), 3.86 (1H, m, H-7), 1.02 (3H, s, H-19), 0.96 (3H, d, J = 6.6 Hz, H-21), 0.87 (3H, t, J = 7.1 Hz, H-29), 0.84 (3H, d, J = 6.8 Hz, H-26), 0.84 (3H, d, J = 6.8 Hz, H-27), 0.72 (3H, s, H-18)。13C-NMR (100 MHz, CDCl3) δ: 37.0 (C-1), 31.4 (C-2), 71.3 (C-3), 42.0 (C-4), 146.3 (C-5), 123.9 (C-6), 69.8(C-7), 37.5 (C-8), 42.3 (C-9), 37.4 (C-10), 20.7 (C-11), 39.2 (C-12), 42.2 (C-13), 49.4 (C-14), 24.3 (C-15), 28.3 (C-16), 55.7 (C-17), 18.3 (C-18), 11.6 (C-19), 36.4 (C-20), 18.8 (C-21), 33.9 (C-22), 25.9 (C-23), 45.8 (C-24), 28.6 (C-25), 19.8 (C-26), 18.8 (C-27), 23.1 (C-28), 11.8 (C-29)。以上光谱数据与文献(傅淋然等,2015)中7α-羟基谷甾醇(7α-hydroxysitosterol)基本一致,故将其鉴定为7α-羟基谷甾醇(7α-hydroxysitosterol)。
化合物6 C29H50O,白色粉末(氯仿)。用显色剂10%硫酸/乙醇溶液显色,在薄层板上为紫红色单一斑点。在紫外波长254 nm和365 nm下观察均没有荧光。将样品与β-谷甾醇标准品作TCL对照,用三种展开剂(石油醚/二氯甲烷、石油醚/乙酸乙酯、石油醚/丙酮)展开,跟β-谷甾醇标准品的Rf值一致,有且只有一个斑点,斑点颜色也相同,因此确定该化合物为β-谷甾醇。
化合物7 C8H14O4,白色粉末(氯仿)。用显色剂10%硫酸/乙醇溶液显色,在薄层板上为棕色单一斑点。ESI-MS m/z: 175.1 [M+H]+。1H-NMR (400 MHz, CDCl3) δ: 4.87 (1H, brd, J = 4.1 Hz, H-5), 4.34 (1H, dd, J = 5.8, 3.9 Hz, H-3), 3.89 (1H, m, H-7), 2.81 (1H, d, J = 12.7 Hz, H-2a), 2.72 (1H, dd, J =12.7 Hz, 3.5 Hz, H-2b), 2.01 (1H, d, J = 9.8 Hz, H-4a), 1.97 (1H, d, J = 9.8 Hz, H-4b), 1.88 (1H, d, J = 9.2 Hz, H-6a), 1.53 (1H, brd, J = 9.2 Hz, H-6b),1.21 (3H, d, J = 6.1 Hz, H-8)。13C-NMR (100 MHz, CDCl3) δ: 169.9 (C-1), 36.6 (C-2), 66.1 (C-3), 29.7 (C-4), 73.3 (C-5), 38.7 (C-6), 62.1 (C-7), 21.5 (C-8)。以上光谱数据与文献(Li et al., 2016)中3,7-dihydroxy-5-octanolide基本一致,故将其鉴定为3,7-dihydroxy-5-octanolide。
化合物8 C15H12O6,白色粉末(氯仿)。用显色剂10%硫酸/乙醇溶液显色,在薄层板上为棕色单一斑点。ESI-MS m/z: 287.1 [M-H]-。1H-NMR (400 MHz, Pyridine-d5) δ: 6.44 (1H, d, J = 2.2 Hz, H-4′), 6.34 (1H, d, J = 2.0 Hz, H-2′, 6′), 5.47 (1H, d, J = 2.0 Hz, H-8), 5.45 (1H, d, J = 2.0 Hz, H-6), 5.47 (1H, dd, J = 12.7, 3.0 Hz, H-2), 3.29 (1H, dd, J = 17.0, 12.8 Hz, H-3a), 2.89 (1H, dd, J = 17.0, 3.1 Hz, H-3b)。13C-NMR (100 MHz, Pyridine-d5) δ: 80.4 (C-2), 44.0 (C-3), 197.6 (C-4), 165.6 (C-5), 97.1 (C-6), 168.8 (C-7), 96.6 (C-8), 165.4 (C-9), 103.4 (C-10), 119.2 (C-1′), 117.0 (C-2′), 148.3 (C-3′), 131.2 (C-4′), 147.9 (C-5′), 115.8 (C-6′)。以上光譜数据与文献(Zheng et al., 2008)中5,7,3′,5′-tetrahydroxy-flavanone基本一致,故将其鉴定为5,7,3′,5′-tetrahydroxy-flavanone。
化合物9 C8H8O4,淡黄色粉末(甲醇)。用显色剂10%硫酸/乙醇溶液显色,在薄层板上不显色,用碘显色呈橘黄色斑点。ESI-MS m/z: 167.0 [M-H]-。1H-NMR (400 MHz, CD3OD) δ: 3.82 (3H, s, -OCH3), 7.43-7.40 (2H, m, H-2, 6), 6.80 (1H, d, J = 8.1 Hz, H-5)。13C-NMR (100 MHz, CD3OD) δ: 122.6 (C-1), 115.8 (C-2), 151.7 (C-3), 146.2 (C-4), 117.4 (C-5), 123.6 (C-6), 168.8 (-COOH), 52.5 (-OCH3)。以上光谱数据与文献(曹雷雷等,2015)中vanilic acid基本一致,故将其鉴定为vanilic acid。
化合物10 C10H10O4,白色粉末(甲醇)。用显色剂10%硫酸/乙醇溶液显色,在薄层板上为淡棕色斑点。ESI-MS m/z: 193.0 [M-H]-。1H-NMR (400 MHz, CD3OD) δ: 7.53 (1H, d, J = 15.8 Hz, H-8), 6.24 (1H, d, J = 15.9 Hz, H-7), 7.04 (1H, d, J = 2.2 Hz, H-2), 6.93 (1H, dd, J = 8.2, 2.1 Hz, H-6), 6.78 (1H, d, J = 8.2 Hz, H-5), 3.74 (3H, s, -OCH3)。13C-NMR (100 MHz, CD3OD) δ: 127.7 (C-1), 115.1 (C-2), 146.7 (C-3), 149.5 (C-4), 116.4 (C-5), 122.9 (C-6), 146.9 (C-7), 114.8 (C-8), 52.0 (-OCH3), 169.7 (C=O)。以上光谱数据与文献(Toshihiro et al., 1999)中caffeic acid methyl ester基本一致,故将其鉴定为caffeic acid methyl ester。
化合物11 C8H16O3,白色粉末(甲醇)。用显色剂10%硫酸/乙醇溶液显色,在薄层板上为紫红色单一斑点。ESI-MS m/z: 159.1 [M-H]-。1H-NMR (400 MHz, CD3OD) δ: 3.53 (2H, t, J = 6.7 Hz, H-8), 2.27 (2H, t, J = 7.4 Hz, H-2), 1.59 (2H, d, J = 7.1 Hz, H-3), 1.54-1.49 (2H, m, H-7), 1.37-1.32 (6H, m, H-4, 5, 6)。13C-NMR (100 MHz, CD3OD) δ: 177.8 (C-1), 35.0 (C-2), 26.1 (C-3), 30.6 (C-4, 5), 26.9 (C-6), 33.7 (C-7), 63.0 (C-8)。以上光谱数据与文献(Tani et al., 2009)中8-hydroxyoctanoic acid基本一致,故将其鉴定为8-hydroxyoctanoic acid。
4 讨论与结论
本研究采用大孔树脂吸附法对庐山石韦的乙醇提取物进行极性分段,再用硅胶柱色谱、葡聚糖凝胶LH-20柱色谱等分离技术对其化学成分进行了分离纯化,从中分离得到11个化合物,包括3个三萜、3个甾体、1个黄酮和4个其他类化合物。其中,化合物1和2均为首次从石韦属植物中分离得到,化合物1、2、4、5、7、8、10、11均为首次从该种植物中分离得到。基于该药利尿通淋、清热止血的功效以及在贵州少数民族地区治疗感染、腹泻和支气管炎的用药经验和疗效,对所得化合物进行文献调研,发现部分化合物具有抗菌和抗炎活性。化合物3具有抗菌生物活性,同时能改善泌尿系统感染患者的临床症状,并对D-半乳糖诱导的炎症反应具有保护效应,还能抑制额前皮质NF-κBp65的核转位,减弱大脑的炎症反应,显示抗炎活性(董小英等,2017);化合物6具有类似于氢化可的松的抗炎作用,也可提高脂多糖(LPS)诱导的J774A1巨噬细胞抗炎因子IL-10的活性,减小趋化因子和促炎因子活性,同时增强酪氨酸磷酸酶(SHP-1)活性,抑制核转录因子(NF-κB)迁移(刘威良等,2019);化合物9具有抗菌活性,并能抑制感染性结石形成,对大鼠膀胱感染性结石有显著治疗作用(李承勇等,2019)。以上报道与该药在药典中的功效记载以及在贵州少数民族地区的用法和疗效相吻合。这些化合物的发现为其临床应用提供了理论依据,也为该民族药的开发利用奠定了科学基础。
参考文献:
CHEN LJ, MA YJ, LI YP, et al., 2011. Advance on the chemical and pharmacological studies on plants of Pyrrosia genus [J]. J Anhui Agric Sci, 39(10): 5786-5787. [陈丽君, 马永杰, 李玉鹏, 等, 2011. 石韦属植物化学和药理研究进展 [J]. 安徽农业科学, 39(10): 5786-5787.]
CAO LL, TIAN HY, WANG YS, et al., 2015. Chemical constituents in the fruits of mangrove plant Sonneratia apetala Buch. Ham. [J]. J Trop Ocean, 34(1): 77-82. [曹雷雷, 田海妍, 王友绍, 等, 2015. 红树植物无瓣海桑果实的化学成分研究 [J]. 热带海洋学报, 34(1): 77-82.]
DONG XY, PENG GL, TANG SQ, 2017. Research progress on biological function of ursolic acid [J]. Guangdong Feed, 26(12): 25-27. [董小英, 彭国良, 唐胜球, 2017. 乌索酸生物学功能的研究进展 [J]. 广东饲料, 26(12): 25-27.]
Editorial Committee of Flora of China (ECFC), 1988. Flora Reipublicae Popularis Sinicae [M]. Beijing: Science Press, 6(2): 116. [中国科学院中国植物志编辑委员会, 1988. 中国植物志 [M]. 北京: 科学出版社, 6(2): 116.]
FU LR, MA QY, HUANG SZ, et al., 2015. Chemical constituents from stems of Cipadessa cinerascens [J].Chin Trad Herbal Drugs, 46(5): 633-638. [傅淋然, 马青云, 黄圣卓, 等, 2015. 灰毛浆果楝茎的化学成分 [J]. 中草藥, 46(5): 633-638.]
Guizhou Institute of Traditional Chinese Medicine, 1992. Miao medicine science [M]. Guiyang: Guizhou National Press: 283. [贵州省中药研究所, 1992. 苗族医药学 [M]. 贵阳: 贵州民族出版社: 283.]
HIKINO H, MEGURO K, TAKEMOTO T, 1963. Isolation of diploptene from Pyrrosia lingua farwell [J]. Chem Pharm Bull, 11(3): 409-410.
HAN JS, WANG MS, 1984. Chemical constituents of Pyrrosia sheareri (BAK.) CHING [J]. J Nanjing Coll Pharm, 15(1): 40-44. [韩基善, 王明时, 1984. 庐山石韦化学成分的研究 [J]. 南京药学院学报, 15(1): 40-44.]
LI CY, HAO C, SHI S, et al., 2019. The intervention effect of vanillic acid on bladder infective calculus in rats [J]. Chin Rem Clin, 19(5): 714-715. [李承勇, 郝川, 史舒, 等, 2019. 香草酸对大鼠膀胱感染性结石的干预研究 [J]. 中国药物与临床, 19(5): 714-715.]
LI WF, ZOU J, LI JX, et al., 2016. Chemical constituents from Pteris deltodon [J]. Chin Trad Herb Drugs, 47(8): 1278-1281. [李宛霏, 邹娟, 李继新, 等, 2016. 岩凤尾蕨化学成分的研究 [J]. 中草药, 47(8): 1278-1281.]
LI YC, TIAN K, SUN LJ, et al., 2016. A new hexacyclic triterpene acid from the roots of Euscaphis japonica and its inhibitory activity on triglyceride accumulation [J]. Fitoterapia, 109: 261-265.
LIN XY, ZHUANG PY, GOU LX, et al., 2017. Chemical constituents from Chloranthus japonicus [J]. Chin Trad Patent Med, 39(12): 2542-2546. [林晓莹, 庄鹏宇, 苟丽霞, 等, 2017. 银线草的化学成分研究 [J]. 中成药, 39(12): 2542-2546.]
LIU WL, JI Y, HUANG AX, 2019. Research and development progress of β-sitosterol [J]. Farm Prod Proc, 2(1): 77-82. [刘威良, 姬昱, 黄艾祥, 2019. β-谷甾醇的研究及开发进展 [J]. 农产品加工, 2(1): 77-82.]
PAN LT, 2012. Medicinal ferns of Guizhou [M]. Guiyang: Guizhou Science Press: 311. [潘炉台, 2012. 贵州药用蕨类植物 [M]. 贵阳: 贵州科技出版社: 311.]
QIU DW, DU J, 2005. Chinese materia medica-Miao national herbs [M]. Guiyang: Guizhou Science Press: 178. [邱德文, 杜江, 2005. 中华本草 苗药卷 [M]. 贵州: 贵州科技出版社: 178.]
SUN HX, ZHANG JX, YE YP, et al., 2003. Cytotoxic pentacyclic triterpenoids from the rhizome of Astilbe chinensis [J]. Helv Chim Acta, 86(7): 2414-2423.
State Pharmacopoeia Committee, 2005. Pharmacopoeia of the People’s Republic of China [M]. Beijing: China Medical Science Press (Part I): 136. [国家药典委员会, 2005. 中华人民共和国药典(第一部) [M]. 北京: 中国医药科技出版社: 136.]
SUN JP, 2006. Maonan medicine science [M]. Guiyang: Guizhou National Press: 246. [孙济平, 2006. 毛南族医药 [M]. 贵州: 贵州民族出版社: 246.]
TOSHIHIRO F, KAZUHIRO F, HIROKO F, et al., 1999. Antiproliferative constituents from Umbelliferae plants. V. A new furanocoumarin and falcarindiol furanocoumarin ethers from the root of Angelica japonica [J]. Chem Pharm Bull, 47(1): 96-100.
TANI H, TAKAHASHI S, HASUMI K, et al., 2009. Isolation of (E)-9,10-dihydroxy-2-decenoic acid from Royal jelly and determination of the absolute configuration by chemical synthesis [J]. Tetrahedron-Asymmetry, 20(4): 457-460.
XU J, WEI PZ, LIU ZL, et al., 2009. Chemical components of Glechoma biondiana [J]. Acta Bot Boreal-Occident Sin, 29(9): 1898-1903. [徐靜, 魏娉芝, 刘珍伶, 等, 2009. 白透骨消化学成分的研究 [J]. 西北植物学报, 29(9): 1898-1903.]
ZHAO JH, PAN LT, ZHANG JM, 2003. Gelao medicine science [M]. Guiyang: Guizhou National Press: 210. [赵俊华, 潘炉台, 张景梅, 2003. 仡佬族医药 [M]. 贵州: 贵州民族出版社: 210.]
ZHENG ZP, CHENG KW, CHAO JF, et al., 2008. Tyrosinase inhibitors from Paper mulberry (Broussonetia papyrifera) [J]. Food Chem, 106(2): 529-535.
(责任编辑 李 莉)

