OrfA与E2F5的互作关系及其对肺腺癌细胞增殖的影响
穆 璐,张潇筠,韩宝泉,陈昱光,张智英,徐 坤
(西北农林科技大学 动物科技学院,陕西 杨凌712100)
大眼狮鲈鱼皮肤肿瘤病毒(walleye dermal sarcoma virus,WDSV)所诱导的皮肤肿瘤(WDS)具有季节性生长的特点,即秋季发生、春季萎缩、夏季基本消失。WDSV基因组除了包含病毒复制所必需的gag、pol和env基因外,还有orfA、orfB和orfC3个辅助基因。研究表明,萎缩期WDS中辅助基因的表达量比生长期肿瘤高100倍以上[1],说明这些辅助基因在肿瘤萎缩过程中起着极其重要的作用。其中,orfA是目前研究报道最多的WDSV辅助基因,但是对其功能的认识目前尚存在争议[2]。
WDSV OrfA蛋白与哺乳动物细胞D型周期蛋白具有一定的相似性,在酵母中表达OrfA能够补偿酵母D型周期蛋白缺陷,因此OrfA也被称为逆转录病毒周期蛋白(retroviral cyclin,RV-cyclin)[3]。Lairmore等[4]提出orfA是致癌基因,因其发现orfA转基因小鼠生长迟缓、毛囊数减少,雌鼠失去泌乳功能,尾巴剪切后出现鳞状上皮增生。Rovnak及其团队[5-9]经过一系列研究发现,OrfA能够通过其C端激活域(activation domain,AD)与TATA结合蛋白相关因子9(TATA binding protein-associa-ted factor 9,TAF9)结合,利用其N端细胞周期蛋白盒(cyclin box)与细胞周期蛋白依赖性激酶3和8(cyclin-dependent kinases 3 and 8,CDK3 and CDK8)相互作用,参与宿主细胞的基因表达调控。有研究还发现,OrfA能够增强直肠癌细胞中CDK8介导的血清应答基因(immediate early genes,IEGs)的转录延伸和再起始效率,推测其与肿瘤的形成有关[10]。但是,这些证据尚不能充分支持orfA是致癌基因的假说。
此外,早期研究发现,OrfA能够在鱼皮肤细胞W12及小鼠细胞NIH 3T3中抑制WDSV启动子(LTR)和一些真核启动子的活性,并抑制W12和NIH 3T3细胞的正常生长[11-12]。Quackenbush等[13]的相关研究也表明,OrfA能够在多种哺乳动物和鱼的细胞中抑制WDSV启动子及NF-κB依赖性启动子的活性。但对orfA转基因斑马鱼的相关研究结果与转基因小鼠结果相反,其研究结果表明,orfA基因的表达不仅没有引起斑马鱼组织增生,反而能够在致癌物质处理下抑制肝癌的发生[14-15]。因此,并不能排除orfA作为抑癌基因通过调控WDSV和宿主基因诱导肿瘤萎缩的可能性。另有研究发现,稳定转染全长WDSV克隆和orfA基因对SPC-A-1及Hela细胞具有一定的毒性,但是未检测到细胞凋亡现象[16],相关结果尚待商榷。
为了进一步探讨WDSV OrfA的作用机制,本课题组前期通过酵母双杂交(yeast two-hybrid,Y2H)筛选试验初步发现了OrfA与转录因子E2F5的互作关系[17-18]。E2F家族成员具有调控细胞周期的重要功能,同时还是肿瘤抑制蛋白和肿瘤病毒转化蛋白的分子靶标[19-20]。作为E2F家族的一员,E2F5可与肿瘤抑制蛋白因子p130和p107相互作用[21]。此外,E2F5与多种癌症发生有关,是一种潜在的致癌因子[22-24]。因此,推测OrfA极有可能通过与E2F5互作调控肿瘤细胞增殖,进而影响肿瘤的发生或萎缩。
本研究通过酵母双杂交回转试验和免疫共沉淀(Co-immunoprecipitation,Co-IP)试验,进一步确认OrfA与E2F5的互作关系,并分析过表达orfA基因对E2F5蛋白表达较高的SPC-A-1细胞增殖的影响,以期为后续深入研究orfA基因在肿瘤发生和萎缩过程中的功能奠定基础。
1 材料与方法
1.1 材 料
所用HEK293T细胞、Hela229宫颈癌细胞、A375恶性黑色素瘤细胞、SMMC-7721肝癌细胞和SPC-A-1肺腺癌细胞,均购自中国科学院典型培养物保藏委员会细胞库,经本课题组传代冻存。pLenti-EF1α-Blank、pGBKT7、pGBKT7-orfA、pGADGH、pPrey-E2F5、pGADGH-E2F5、pGBKT7-53和pGADT7-T载体,AH109酵母菌株、DH5α大肠杆菌,均为本课题组前期保存;RNA分离试剂TRizol Reagent,购自Invitrogen公司;定量试剂TB Green®Premix Ex TaqTMII (Tli RNaseH Plus)及逆转录试剂盒,购自TaKaRa公司;质粒小提试剂盒,购自Omega公司;细胞培养用试剂,购自Gibco公司;RIPA裂解缓冲液,购自普利莱基因技术有限公司;Protein G Agarose、Cell Counting Kit-8及Propidium Iodide检测试剂,购自碧云天生物有限公司;GAPDH抗体(鼠)、c-Myc标签抗体(兔)和一步法快速WB(HRP)试剂盒(羊抗鼠、羊抗兔),购自康为世纪公司;E2F5单克隆抗体(鼠),购自Abcam公司;Western Blot用PVDF膜、ECL显色液,购自Millipore公司;其他试剂均为分析纯或更高级别试剂。试验所用引物由杨凌奥科生物有限公司合成,工作浓度为10 μmol/L。
1.2 方 法
1.2.1orfA与E2F5基因过表达载体的构建 (1)orfA基因过表达载体pLenti-EF1α-orfA的构建。以质粒pGBKT7-orfA为模板,使用上游引物(5′-TTGCGTACGATGGAGGAGCAGAAGCTGA-TC-3′)和下游引物(5′-CGCGGATCCTCCTATTGGATCGACGACGTTG-3′)扩增c-Myc标签与orfA基因(GenBank登录号AF033822.1)片段,长度为969 bp。采用普通PCR,反应条件为:94 ℃预变性5 min;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,35个循环;最后72 ℃终延伸10 min。PCR产物通过BsiWⅠ/BamHⅠ双酶切定向克隆到pLenti-EF1α-Blank载体中,构建获得orfA基因过表达载体pLenti-EF1α-orfA。
(2)E2F5基因过表达载体pLenti-EF1α-E2F5的构建。以质粒pGADGH-E2F5为模板,使用上游引物(5′-TTGCGTACGCCGCGGGGCCGGGA-3′)和下游引物(5′-CGCGGATCCATAATTTAGTA-TCTGGACATC-3′)扩增E2F5基因片段,长度为1 071 bp。采用降落式PCR(touchdown PCR,TD PCR),反应条件为:94 ℃预变性5 min;94 ℃变性30 s,68 ℃退火30 s,72 ℃延伸45 s,16个循环,每个循环退火温度降低1 ℃;然后94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸45 s,20个循环;最后72 ℃终延伸10 min。PCR产物通过BsiWⅠ/BamHⅠ双酶切定向克隆到pLenti-EF1α-Blank载体中,构建获得E2F5基因过表达载体pLenti-EF1α-E2F5。
1.2.2 不同类型细胞系中E2F5蛋白表达的检测 选用HEK293T细胞、Hela229宫颈癌细胞、A375恶性黑色素瘤细胞、SMMC-7721肝癌细胞和SPC-A-1肺腺癌细胞5种细胞系进行E2F5蛋白表达水平的检测。细胞培养条件均为:体积分数90% DMEM培养基,体积分数10% FBS,100 μg/mL的青链霉素,体积分数5% CO2,温度37 ℃。待细胞密度为70%~90%时,去除培养基,加入1~2 mL体积分数0.25%含EDTA的胰酶消化1~2 min,4 ℃条件下以800g离心5 min收集细胞,使用RIPA裂解液按说明书操作提取总蛋白。然后采用Wes-tern Blot按照标准试验步骤检测5种细胞系中E2F5及GAPDH蛋白的表达水平,并进行灰度分析,从中选取E2F5蛋白表达量最高的细胞系备用。
1.2.3 OrfA与E2F5互作关系的验证 (1)酵母双杂交试验。按质粒组合分组,分别为阴性对照组pGBKT7/pGADGH、试验组1 pGBKT7-orfA/pGADGH、试验组2 pGBKT7/pGADGH-E2F5、试验组3 pGBKT7-orfA/pGADGH-E2F5和阳性对照组pGBKT7-53/pGADT7-T。每组质粒总质量为5 μg,2个质粒物质的量比为1∶1,总体积50 μL。采用醋酸锂法按标准试验步骤转化AH109酵母菌株,涂布腺嘌呤核苷酸(Ade)和组氨酸(His)缺陷型SD固体培养基(SD/-Ade-His)平板,30 ℃倒置培养3~5 d,筛选转化阳性克隆菌落。每个转化分别挑取3个阳性克隆菌落,接种到2 mL SD/-Ade-His液体培养基中,30 ℃、200 r/min过夜摇菌;采用分光光度计测OD600,调整所有菌液浓度至一致。每5个不同的酵母转化子菌液为一组,分别按10倍梯度倍比稀释至10 000倍;每个浓度梯度取5 μL菌悬液平行点布于腺嘌呤核苷酸(Ade)、组氨酸(His)、亮氨酸(Leu)和色氨酸(Trp)缺陷型SD固体培养基(SD/-Ade-His-Leu-Trp)平板上;30 ℃倒置培养3~4 d,观察并拍照。
(2)免疫共沉淀试验。根据1.2.2节的试验结果,选用SPC-A-1肺腺癌细胞进行免疫共沉淀试验。设置试验组pLenti-EF1α-orfA/pLenti-EF1α-E2F5、pLenti-EF1α-orfA/pLenti-EF1α-Blank和对照组pLenti-EF1α-Blank,按Lipofectamine 3000说明书操作步骤转染SPC-A-1细胞;60 h后按1.2.1节中方法收集细胞总蛋白,采用E2F5单克隆抗体(鼠)按照Protein G Agarose说明书步骤进行免疫沉淀;对共沉淀复合物进行SDS-PAGE电泳,采用c-Myc标签抗体(兔)作为一抗、HRP偶联羊抗兔IgG作为二抗进行Western Blot检测。
1.2.4 过表达orfA基因对SPC-A-1细胞增殖的影响 (1)CCK-8检测试验。按照CCK-8试剂盒说明书操作步骤,采用Lipofectamine 3000将pLenti-EF1α-orfA载体及骨架载体pLenti-EF1α-Blank(对照组)分别转染SPC-A-1细胞24,48,72 h后,消化收集转染细胞并稀释至密度为20 μL-1;以每孔100 μL细胞悬液重新接种于96孔板中进行培养,待细胞贴壁后,每孔加入10 μL CCK-8溶液,在细胞培养箱内避光孵育1 h,在450 nm波长处测定吸光度。每组6个重复,根据吸光度值评估OrfA过表达对SPC-A-1细胞增殖的影响。
(2)细胞周期流式检测试验(PI单染色法)。按照PBS/PI/RNAase为100∶5∶1的体积比配制PI染液,用锡箔纸包裹避光保存。用pLenti-EF1α-Blank和pLenti-EF1α-orfA载体分别转染SPC-A-1细胞,培养48 h后收集细胞,1 200 r/min低速离心3 min,PBS清洗2遍,弃上清保留细胞沉淀。使用300 μL PBS重悬细胞沉淀,并逐滴加入到700 μL无水乙醇(预冷)中,轻轻混匀,4 ℃过夜固定。将过夜处理的细胞1 200 r/min低速离心3 min,弃上清,每管加入100 μL PI染液重悬细胞,置于37 ℃水浴锅中孵育30 min。最后使用孔径0.05 mm滤网过滤细胞,并进行流式细胞仪计数分析。
1.2.5orfA基因过表达对SMAD4和caspase-3表达的影响 用pLenti-EF1α-Blank和pLenti-EF1α-orfA载体分别转染SPC-A-1细胞,培养48 h后收集细胞;采用TRizol和逆转录试剂盒按照说明书步骤操作,提取总RNA并进行反转录,制备获得相应的cDNA。采用BIO-RAD CFX96系统和SYBR Green荧光染料法进行实时定量PCR。以GAPDH基因作为内参对照,分别检测SMAD4和caspase-3基因的表达情况。每个检测最少设3个平行重复,采用2-ΔΔCt法进行数据分析。
所用引物序列为,GAPDH-F:5′-AGGTCGGTGTGAACGGATTTG-3′,GAPDH-R:5′-GGGGT-CGTTGATGGCAACA-3′;SMAD4-F:5′-CTCAT-GTGATCTATGCCCGTC-3′,SMAD4-R:5′-AGGT-GATACAACTCGTTCGTAGT-3′;CASP3-F:5′-CAGAACTGGACTGTGGCATTG-3′,CASP3-R:5′-GCTTGTCGGCATACTGTTTCA-3′。
1.3 数据统计与分析
所有试验均最少设3个平行或独立重复;数值均以“平均值±标准差(SEM)”表示,采用非配对双尾t检验进行差异显著性分析。
2 结果与分析
2.1 orfA与E2F5基因过表达载体的构建与验证
以质粒pGBKT7-orfA为模板,采用普通PCR扩增c-Myc标签与orfA基因序列,定向克隆到pLenti-EF1α-Blank载体中,获得orfA基因过表达载体pLenti-EF1α-orfA(图1-A)。
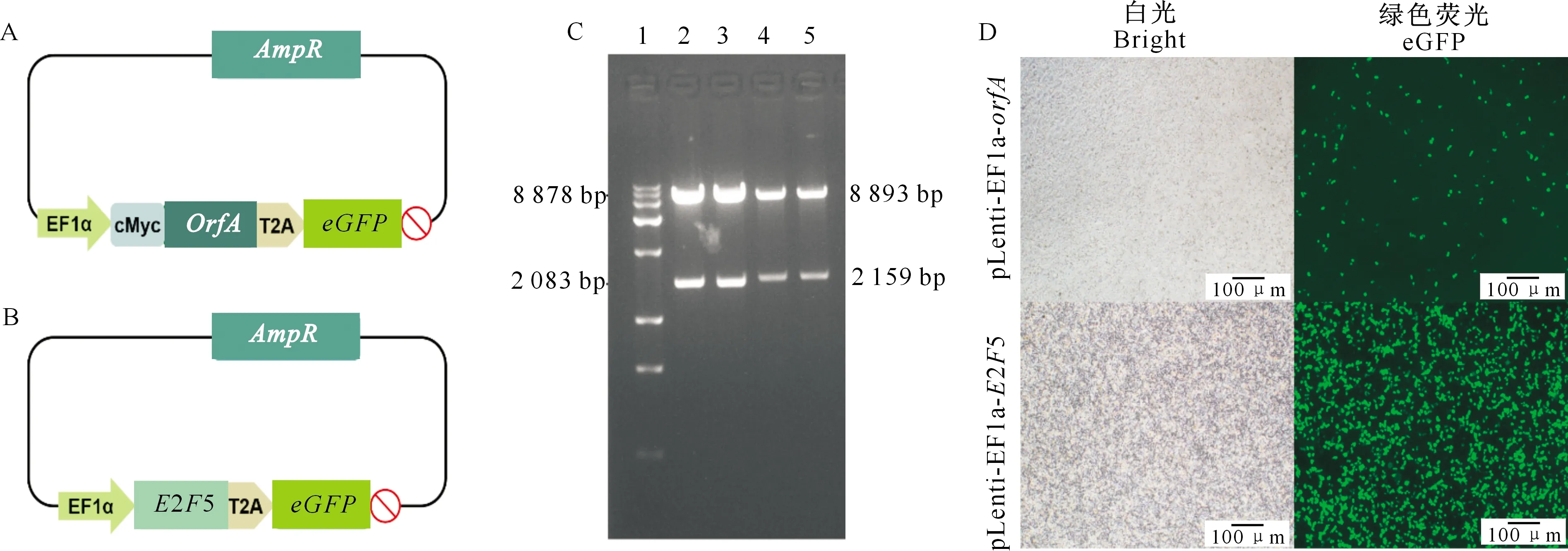
A.pLenti-EF1α-orfA质粒示意图谱;B.pLenti-EF1α-E2F5质粒示意图谱;C.pLenti-EF1α-orfA与pLenti-EF1α-E2F5双酶切鉴定: 1.Trans 15K DNA Marker,2~3.pLenti-EF1α-orfA质粒的AgeⅠ/XbaⅠ酶切条带,4~5.pLenti-EF1α-E2F5质粒的AgeⅠ/ BamHⅠ酶切条带;D.质粒转染SPC-A-1细胞24 h后荧光显微镜观察,比例尺=100 μmA.Schematic of tpLenti-EF1α-orfA plasmid;B.Schematic of pLenti-EF1α-E2F5 plasmid; C.The agarose gel electrophoretogram result of double-digested pLenti-EF1α-orfA and pLenti-EF1α-E2F5 plasmids:1.Trans2K Plus Ⅱ DNA Marker,2-3.The pLenti-EF1α-orfA plasmid digested by AgeⅠ/XbaⅠ, 4-5.pLenti-EF1α-E2F5 plasmid digested by AgeⅠ/BamHⅠ;D.The SPC-A-1 cells photographed by fluorescence microscope 24 h after transfection;Scale bar=100 μm图1 orfA与E2F5基因过表达载体的构建与鉴定Fig.1 Construction and verification of plasmids for E2F5 and orfA overexpression
采用AgeⅠ/XbaⅠ进行双酶切鉴定,酶切条带为8 878和2 083 bp(图1-C泳道2和3),结果鉴定正确;进一步测序结果表明,orfA基因序列无突变。转染进SPC-A-1细胞24 h后,荧光显微镜下观察有绿色荧光(图1-D),表明pLenti-EF1α-orfA载体中OrfA-eGFP阅读框正确,能够有效表达。以质粒pGADGH-E2F5为模板,采用降落式PCR扩增E2F5基因的全长序列,定向克隆到pLenti-EF1α-Blank载体中,获得E2F5基因过表达载体pLenti-EF1α-E2F5(图1-B)。采用AgeⅠ/BamHⅠ进行双酶切鉴定,酶切条带为8 893和2 159 bp(图1-C泳道4和5),结果鉴定正确;进一步测序结果表明,E2F5基因序列无突变;转染进SPC-A-1细胞24 h后,荧光显微镜下观察有绿色荧光细胞,且明显比pLenti-EF1α-orfA组增多(图1-D),表明pLenti-EF1α-E2F5载体中E2F5-eGFP阅读框正确,能够有效表达且效果优于OrfA-eGFP。
2.2 不同类型细胞系中E2F5蛋白的表达量检测
对HEK293T细胞、Hela229宫颈癌细胞、A375恶性黑色素瘤细胞、SMMC-7721肝癌细胞和SPC-A-1肺腺癌细胞中的E2F5蛋白表达量进行Wes-tern Blot检测,以GAPDH作为内参,结果如图2-A所示,SMMC-7721和A375因细胞生长状态较差,Western Blot检测效果不理想;但在 HEK293T、Hela229和SPC-A-1细胞中均检测到了明显的E2F5表达。灰度分析结果(图2-B)显示,SPC-A-1细胞中E2F5蛋白表达量相对较高,细胞生长状态良好,因此选取SPC-A-1细胞进行后续研究。
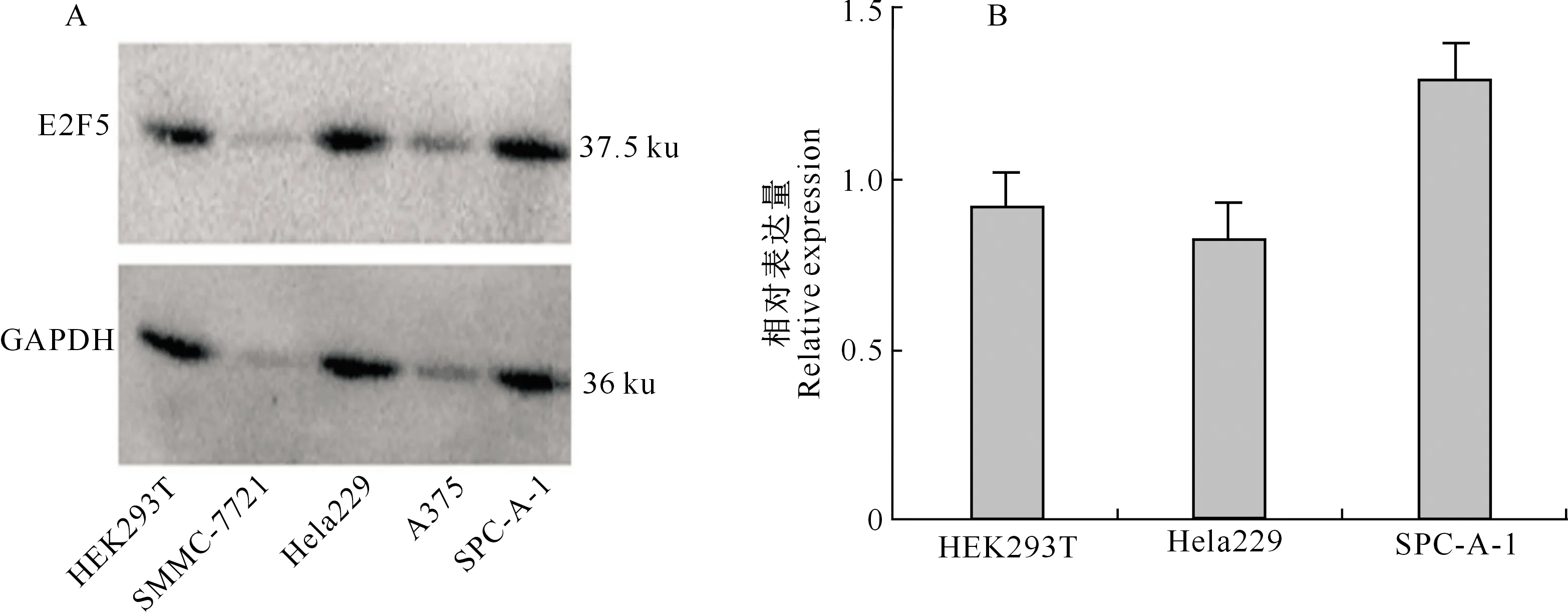
A.Western Blot检测结果;B.蛋白相对表达量结果A.Result of Western Blot assay;B.Statistical analysis of relative expression of E2F5 protein图2 不同细胞系中E2F5蛋白的表达情况Fig.2 Expression of E2F5 protein in different cell lines
2.3 WDSV OrfA与E2F5的相互作用
如图3-A中AH109回转试验结果所示,虽然pGBKT7-orfA/pGADGH-E2F5转化组效果明显,但是pGBKT7-orfA/pGADGH转化组也有较小的酵母菌落长出,说明OrfA具有微弱的自激活作用,极有可能与E2F5互作,但仍有待进一步核实。

A.酵母双杂交回转试验结果;B.OrfA和E2F5免疫共沉淀试验检测结果:M.Protein marker,1.pLenti-EF1α-orfA/pLenti-EF1α-E2F5转染组, 2.pLenti-EF1α-orfA/pLenti-EF1α-Blank转染组,3.pLenti-EF1α-Blank对照组,+.基因过表达,-.基因未过表达A.Result of Y2H transformation assay;B.Result of Co-IP assay for OrfA and E2F5 interaction:M.Protein marker,1.The transfection group of pLenti-EF1α-orfA/pLenti-EF1α-E2F5,2.The transfection group of pLenti-EF1α-orfA/pLenti-EF1α-Blank, 3.The control transfection group of pLenti-EF1α-Blank,+.Gene was overexpressed,-.Gene was not overexpressed
本研究通过免疫共沉淀试验进一步验证OrfA与E2F5的互作关系,结果如图3-B所示,pLenti-EF1α-orfA/pLenti-EF1α-E2F5转染组OrfA和E2F5免疫共沉淀的效果显著,在未过表达E2F5基因的pLenti-EF1α-orfA/pLenti-EF1α-Blank转染组沉淀复合物中也明显检测到了OrfA-E2F5融合蛋白,表明WDSV OrfA与转录因子E2F5确实存在互作关系。
2.4 过表达orfA基因对SPC-A-1细胞增殖的影响
采用CCK-8试剂盒检测过表达orfA基因对SPC-A-1细胞增殖的影响,结果(图4-A)表明,在SPC-A-1细胞被转染24,48和72 h后,与pLenti-EF1α-Blank空载体对照组相比,转染pLenti-EF1α-orfA载体的OrfA过表达组细胞存活率均显著增加。采用PI染色法结合流式细胞术分析过表达orfA基因对SPC-A-1细胞周期的影响,结果如图4-B所示,与对照组相比,转染pLenti-EF1α-orfA载体的OrfA过表达组G1期细胞占比显著减少,S期及G2期细胞占比略微增大。综合2个试验的结果,推测过表达orfA基因能够促进SPC-A-1细胞增殖。
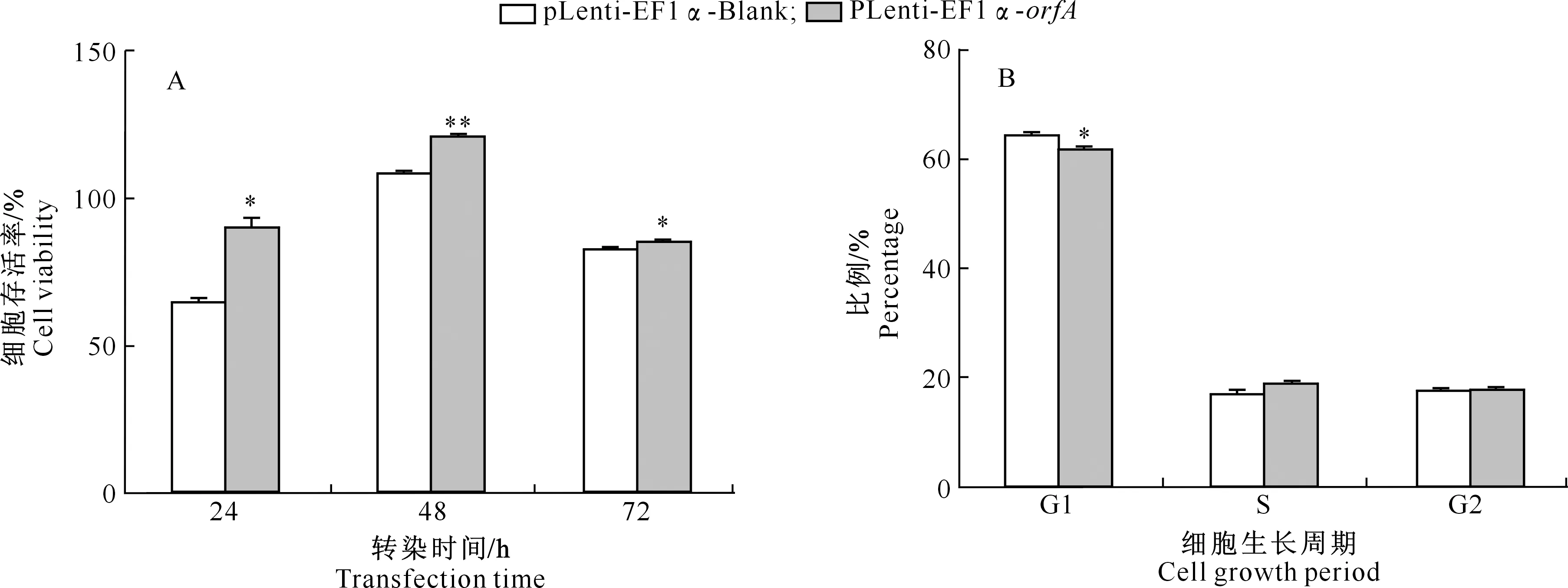
A.CCK-8试验检测结果;B.细胞周期流式检测结果;*代表差异显著(P<0.05),**代表差异极显著(P<0.01),下图同A.Result of the CCK-8 assay;B.Result of the cell cycle analysis by flow cytometry;* represents a significant difference (P<0.05),** represents a highly significant difference (P<0.01),The same below
2.5 过表达orfA基因对SMAD4和caspase-3表达的影响
用RT-qPCR检测orfA基因过表达对SMAD4基因和caspase-3基因表达的影响,结果(图5)表明,转染orfA基因过表达载体pLenti-EF1α-orfA的SPC-A-1细胞中,SMAD4基因mRNA相对表达量显著提高,而caspase-3基因mRNA相对表达量则极显著降低,暗示WDSV OrfA可能通过抑制SPC-A-1细胞凋亡促进其增殖。
3 讨 论
由WDSV引起的WDS具有季节性生长特点,WDSV的3个辅助基因orfA、orfB和orfC在WDS的发生和自然萎缩过程中起着关键作用。其中关于orfA基因的研究报道较多,但目前对其致癌性仍缺乏统一的认知。一些研究结果推测orfA基因具有抑制肿瘤的作用[11-16],而另一些研究则倾向于认为orfA是致癌基因[4-10]。
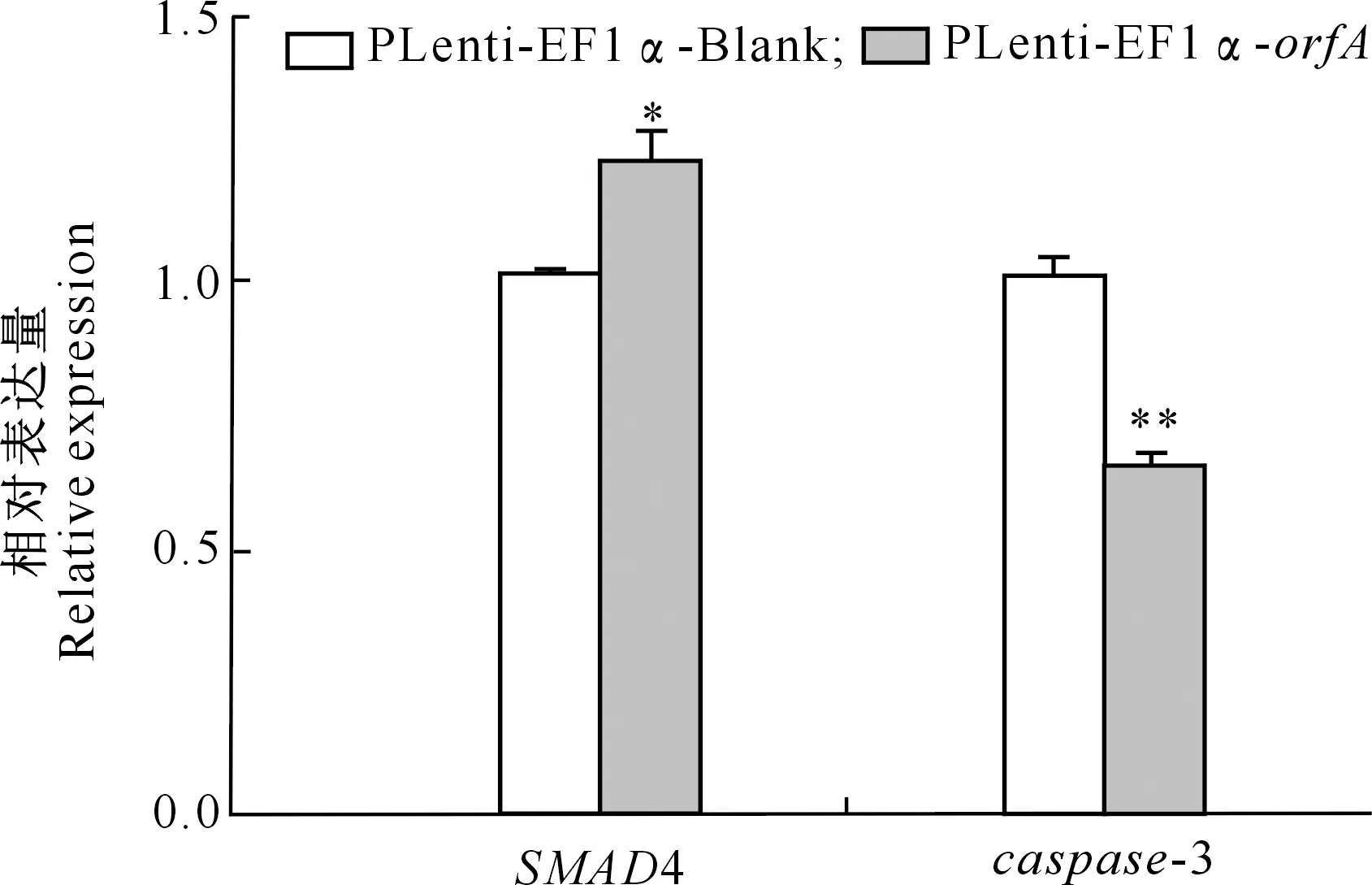
图5 过表达orfA基因对SMAD4和caspase-3 基因表达的影响Fig.5 Effect of orfA overexpression on SMAD4 and caspase-3 mRNA expression
本课题组前期通过酵母双杂交筛选初步发现并验证了OrfA与转录因子E2F5的互作关系[17-18]。E2F家族是极其重要的转录因子家族,参与细胞周期、发育和肿瘤发生等多种细胞调控过程[20]。不同的E2F成员包含1个或多个高度保守的DNA结合域[21]。E2F5作为E2F家族的一员,与E2F4同源性较高,两者均能与肿瘤抑制蛋白因子p130和p107相互作用[19]。许多microRNA通过干扰E2F5基因的表达来抑制多种肿瘤细胞的增殖和迁移[25-28]。本研究在酵母双杂交回转试验中发现,OrfA具有微弱的自激活作用,这与OrfA蛋白C端含有非典型激活域的报道[7]一致。因此,虽然pGBKT7-orfA/pGADGH-E2F5转化组菌落生长效果明显,但OrfA是否与E2F5直接互作仍有待核实;免疫共沉淀试验结果最终明确了二者的互作关系。
本研究筛选出E2F5蛋白表达量较高的SPC-A-1细胞,对其进行CCK-8细胞增殖检测试验和细胞周期流式检测试验,初步证明过表达orfA基因可能促进SPC-A-1细胞的增殖。这与前人“稳定转染全长WDSV克隆和orfA基因”的研究结果[16]相反。究其原因,可能与检测手段、细胞转染效率、orfA基因表达载体及表达效率等不同有关。本研究发现,E2F5基因过表达载体中E2F5-eGFP融合蛋白的表达效果明显强于orfA基因过表达载体中OrfA-eGFP。推测是因为WDSV基因组orfA基因序列密码子在人源细胞中的表达受到了一定程度的限制,在后续研究中将考虑依据目标细胞种属进行相应的密码子优化。
SMAD蛋白是TGF-β家族下游的受体信号转导分子,其中SMAD4作为通用型SMAD蛋白,与R-SMAD聚合后以二聚体的形式在细胞核内积累并调控靶基因转录[29]。研究表明,E2F4、E2F5与SMAD4及p107等因子在TGF-β信号通路中均发挥重要作用[30]。Caspase-3作为细胞凋亡过程中最主要的终末剪切酶,是各种因素诱导细胞凋亡的最终执行者,因此是细胞凋亡检测中最常见的标记分子。本研究发现,orfA基因过表达能够显著提高SMAD4基因的表达,但极显著降低caspase-3基因的表达,暗示WDSV OrfA可能通过与E2F5互作调节SMAD4和caspase-3基因的表达,进而抑制SPC-A-1细胞凋亡并促进其增殖,但具体分子机理有待进一步研究。
——一道江苏高考题的奥秘解读和拓展

