马泰勒虫RON2基因的原核表达及生物信息学分析
张 伟,范士龙,韦丽婷,芦 星,王金明,李思媛,呼尔查, 马 英,张梦圆,宋瑞其,张 杨,巴音查汗,刘丹丹
(新疆农业大学 动物医学学院,新疆 乌鲁木齐 830052)
马泰勒虫(Theileriaequi)是一种哺乳动物胞内寄生的血液原虫,属于顶复门梨形虫目(Piroplasmida)[1-2],寄生于马、驴、骡、斑马等马属动物的红细胞和单核巨噬系统的细胞内,由蜱传播[3-4]。该病以高热稽留、贫血、黄疸、淋巴结肿大等为主要临床症状,急性病例多导致流产和死亡[5]。由于媒介蜱的广泛存在,马泰勒虫病的发病率不断上升,流行区域也不断扩大,严重制约了马产业的发展[6]。目前对于该病的防治,主要以药物治疗为主,但不能有效预防该病的感染。病原对宿主细胞的入侵是建立感染体系的重要步骤[7],因此能否有效阻断马泰勒虫对宿主细胞的入侵,是预防该病感染的关键。
关于马泰勒虫所属顶复门原虫入侵宿主细胞的机制,在对弓形虫(Toxoplasma)和疟原虫(Plasmodium)棒状体颈部蛋白(rhoptry neck proteins,RONs)的研究中,通过电镜观察、免疫荧光和免疫共沉淀等方法,证实了 RON2 蛋白能够与其他入侵蛋白发生特异结合,进而参与虫体入侵宿主细胞的过程[8]。RONs由内质网和高尔基体加工合成后转运至棒状体内储存,受Ca2+信号刺激后,在棒状体的颈部经蛋白酶水解加工后分泌到细胞外,包括RON1~RON8[9-11]。其中RON2可与微线体分泌的顶膜抗原1(AMA1)共同作用形成“运动结合体(moving juction,MJ)”[12],并与宿主细胞发生黏附作用,虫体随之进入宿主细胞后形成纳虫空泡,完成入侵过程[11,13]。在梨形虫中,目前大部分研究只针对RON2基因进行序列分析[14],仅在分歧巴贝斯虫(Babesiadivergens)中验证了RON2蛋白与AMA1蛋白互作,并参与了虫体的入侵过程[15];此外在东方巴贝斯虫(Babesiaorientalis)中成功构建了RON2重组蛋白,并通过Far-western 试验,证明重组RON2 蛋白可以和全虫抗原中天然状态下的 AMA1蛋白相互作用[16]。但是,关于马泰勒虫RON2蛋白的研究目前尚未见报道。
为了探究马泰勒虫RON2基因编码蛋白的功能和结构,本试验以马泰勒虫美国WA株基因组数据为模板,与顶复门原虫RON2基因本地数据库进行BLAST比对,设计特异引物分别从供试马泰勒虫新疆株基因组DNA和cDNA中扩增RON2基因序列,并以RON2基因序列为分子标记对顶复门原虫的遗传进化关系进行分析,构建原核重组质粒,进行原核表达,最后利用生物信息学技术对其进行蛋白结构分析及互作蛋白预测,以期为进一步研究新疆马泰勒虫RON2基因在虫体入侵宿主细胞中的功能和作用奠定基础。
1 材料与方法
1.1 样品与试剂
马泰勒虫(新疆塔城株)阳性马匹抗凝全血,采集于新疆塔城地区。
pMD19-T载体、T4 DNA连接酶、大肠杆菌DH5α感受态细胞、DL8000/2000 DNA Marker、Prime Script lst Strand cDNA Synthesis Kit、LA Taq、Trizol通用型RNA快速提取试剂盒,均购自宝生物工程(大连)有限公司;DNA胶回收试剂盒和质粒提取试剂盒,均购自Omega Bio-Tek公司;基因组DNA提取试剂盒Gentra Puregene DNA Purification Kit,购自QIAGEN公司。
1.2 引物合成与设计
以GenBank中公布的马泰勒虫美国WA株(Theileriaequistrain WA,XM004830215.1)RON2基因序列为模板,BLAST比对东方泰勒虫(Theileriaorientalis,XM009690549.1)、环形泰勒虫(Theileriaannulata,XM949595.1)、小泰勒虫 (Theileriaparva,XM760448.1)RON2基因组数据,以获得的RON2保守基因序列为模板,用Pri-mer Premier 5.0软件设计特异性引物(表1),送武汉生工生物工程公司合成。

表1 本研究所用引物信息Table 1 Information of primers used in this study
1.3 RON2基因的克隆
按试剂盒说明从马泰勒虫阳性全血中分别提取基因组DNA和RNA,以提取的总RNA为模板反转录cDNA。以基因组DNA和cDNA为模板,进行PCR扩增;将PCR产物纯化回收后按试剂盒说明连接至pMD19-T载体,连接产物转化入大肠杆菌DH5α感受态细胞。挑取阳性菌落,经PCR鉴定,将阳性转化子送生工生物工程(上海)股份有限公司进行测序。
1.4 RON2基因序列比对和系统发生树的构建
利用MEGA 7.0软件分析RON2基因的核苷酸序列和氨基酸序列,构建Maximum Parsimany(MP)系统发生树,分析顶复门寄生虫的分类进化关系。运用DNAStar Lasergene v7.1中Megalign软件的Clustal W算法,分别对顶复门原虫RON2基因的核苷酸和氨基酸序列进行相似性分析。
1.5 RON2基因截短重组蛋白的表达与纯化
分别提取阳性克隆和表达载体pET-32a质粒DNA,用EcoR Ⅰ和XhoⅠ对pET-32a质粒和目的基因DNA进行双酶切,将酶切后产物连接,转化到E.coliBL21(DE3)感受态细胞内,进行PCR和酶切鉴定。将鉴定为阳性的菌液送往生工生物工程(上海)股份公司测序。将测序正确的重组菌100 μL接种到10 mL Amp/LB培养基内于37 ℃培养,待细菌OD值达到0.6时,加入终浓度为1 mmol/L的IPTG进行诱导表达,分别在诱导0,1,2,3,4,5,6 h取1 mL菌液留样;将经诱导表达的菌液12 000 r/min离心2 min,弃上清液,制样进行SDS-PAGE分析。
将测序正确的重组菌1 mL接种到100 mL Amp/LB培养基内于37 ℃ 培养,待细菌OD值达到0.6时,加入终浓度为1 mmol/L的IPTG诱导4 h,离心收集菌体并超声破碎,取包涵体沉淀,使用 His 标签蛋白纯化试剂盒纯化His-RON2融合蛋白,操作步骤按照试剂盒说明书进行,最后收集流穿液、洗涤液、洗脱液进行 SDS-PAGE,分析纯化效果。
1.6 RON2蛋白编码蛋白的预测与分析
利用ProtParam(http://au.expasy.org)在线分析RON2蛋白的物理和化学性质(包括相对分子质量、等电点等),利用ProtScale(http://web.expasy.org/protscale/)程序分析RON2的亲疏水性,运用SOSUI(http://bp.nuap.nagoya-u.ac.jp/sosui/)程序分析RON2蛋白的可溶性,使用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)软件分析RON2蛋白跨膜区,使用Bcepred软件和DNASTAR的Protean分析RON2蛋白的亲疏水性、柔韧性和表面可及性,用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/)和PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)分析二级结构,利用SSWISS-MODEL(https://swissmode-l.ex-pasy.org/interactive)分析RON2的三级结构,利用CLUSTAL W和Jalview 2.0软件分析三级结构的氨基酸序列,运用DNASTAR软件中的Jameson-Wolf方法预测RON2蛋白的B细胞抗原表位,利用Net-Phose3.1 Server和Net-NGIyc1.0 Server在线软件预测RON2蛋白的磷酸化位点和糖基化位点,利用STRING(https://string-db.org/cgi/network)数据库分析RON2蛋白的相互作用关系。
2 结果与分析
2.1 马泰勒虫新疆株RON2基因的克隆结果
PCR结果显示,从马泰勒虫新疆株基因组DNA中均扩增出一条约3 920 bp的目的片段(图1-A)。用3对引物分段扩增马泰勒虫新疆株基因组cDNA,分别获得约为1 500,1 400和2 000 bp的3个目的片段(图1-B)。将3个片段测序并拼接,发现与基因组DNA扩增获得的序列相一致,表明马泰勒虫新疆株RON2基因具有完整的开放阅读框(3 920 bp)。pMD19-T-RON2菌液PCR结果显示,在3 920 bp处出现了目的片段(图1-C)。测序结果经BLAST分析显示,基因序列与基因组DNA和cDNA的PCR扩增结果一致,表明成功构建了pMD19-T-RON2克隆载体,序列信息已上传至GenBank数据库,NCBI基因登录号为MT939257。
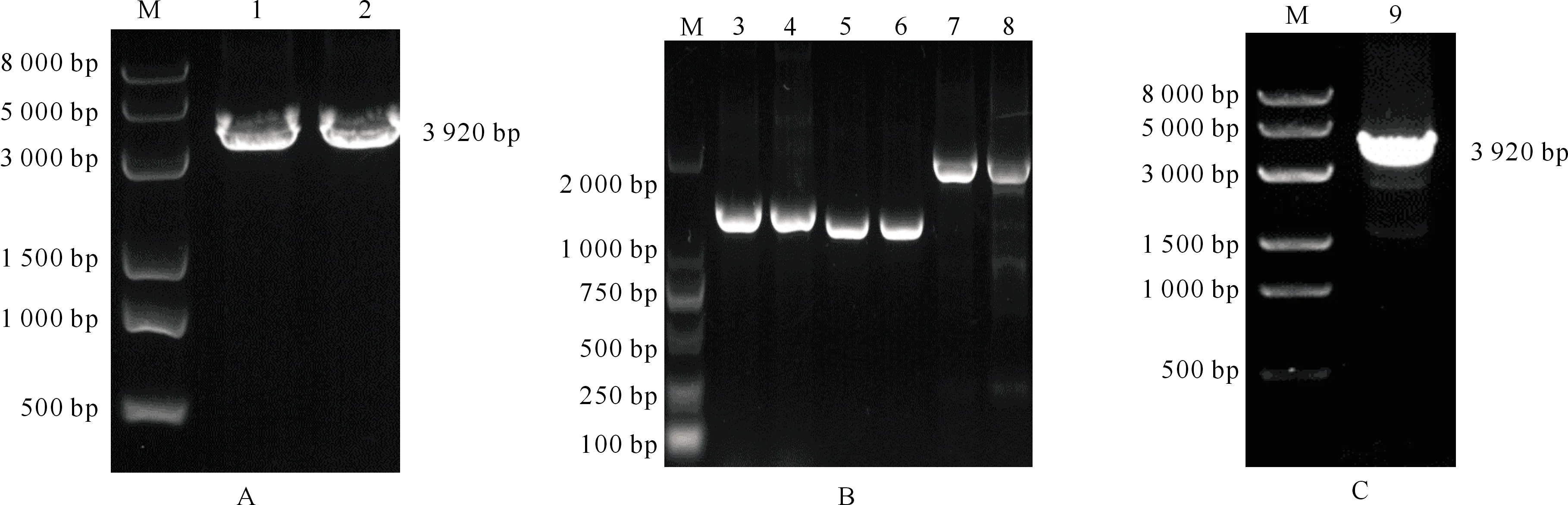
A.基因组DNA的PCR扩增;B.RON2基因组cDNA的PCR扩增:3-4.RON2基因5′端, 5-6.中段扩增,7-8.RON2基因3′端;C.pMD-19-T-RON2菌液PCR扩增结果;M.DNA MarkerA.PCR amplification of genomic DNA;B.PCR amplification of RON2 genomic cDNA:3-4.The 5′ end of RON2 gene, 5-6.Midcourse amplification,7-8.The 3′end of RON2 gene;C.PCR amplification of pMD19-T-RON2 bacterial fluid;M.DNA Marker
2.2 RON2基因序列比对及系统发生树
利用MEGA 7.0软件,以顶复门原虫RON2基因为分子标记,分别以核苷酸序列和氨基酸序列构建MP系统发生树,结果(图2和图3)均显示,不同属原虫被分为5个分支;在进化关系上,巴贝斯虫属和泰勒虫属较为接近,同属于梨形虫范畴,马泰勒虫新疆株属于泰勒虫属,与马泰勒虫美国WA株位于同一分支。

图2 基于RON2核苷酸序列构建的顶复门原虫系统发生树Fig.2 Phylogenetic tree of apolitophyta based on RON2 nucleotide sequences

图3 基于RON2氨基酸序列构建的顶复门原虫系统发生树Fig.3 Phylogenetic tree of apolitophyta based on RON2 amino acid sequences
对马泰勒虫新疆株RON2基因及GenBank中公布的顶复门原虫RON2同源基因序列进行相似性分析,结果(表2)显示,马泰勒虫新疆株与13种顶复门原虫RON2基因的核苷酸和氨基酸序列相似性分别为31.2%~82.7%和23.8%~79.5%,与泰勒虫属中的环形泰勒虫、小泰勒虫、东方泰勒虫、马泰勒虫美国WA株RON2基因核苷酸和氨基酸序列相似性分别为63.5%~82.7%和48.9%~79.5%,与巴贝斯虫属中的分歧巴贝斯虫、牛巴贝斯虫、莫氏巴贝斯虫、羊巴贝斯虫未定种RON2基因核苷酸和氨基酸序列相似性分别为57.6%~66.3%和44.8%~54.1%。其中与马泰勒虫美国WA株核苷酸、氨基酸序列的相似性最高,分别为82.7%和79.5%;与约氏疟原虫(Plasmodiumyoelii)核苷酸、氨基酸相似性最低,分别为31.2%和23.8%。

表2 14种顶复门原虫RON2基因核苷酸和氨基酸序列的相似性分析Table 2 Similarity analysis of nucleotide and amino acid sequences of RON2 gene of 14 protozoa %
2.3 RON2融合蛋白的表达与纯化
SDS-PAGE 分析结果(图4-A)显示,以终浓度1 mmol/L IPTG于37 ℃诱导重组菌液4 h时,蛋白表达量最高,诱导后的表达产物大小约26 ku。经过超声破碎、离心后分别收集上清和沉淀,进行SDS-PAGE检测,结果(图4-B)显示重组蛋白主要存在于沉淀中,为包涵体蛋白,使用His标签试剂盒对包涵体纯化的效果良好。

A.His-RON2诱导时间优化:1.未诱导,2~7.分别为诱导1,2,3,4,5,6 h; B.His-RON2可溶性与纯化:1.未诱导,2.破碎后沉淀,3.破碎后上清,4.沉淀纯化,M.120 ku 蛋白 MarkerA.Induction time of His-RON2 was optimized:1.No induction,2-7.Induced for 1,2,3,4,5 and 6 h,respectively; B.His-RON2 solubility and purification:1.No induction,2.Precipitation after crushing,3.Supernatant after crushing, 4.Precipitation purification,M.120 ku protein Marker
2.4 RON2基因编码蛋白的生物信息学分析
2.4.1 理化性质 利用在线软件ProtParam对马泰勒虫RON2蛋白的理化性质进行分析,结果表明RON2蛋白由1 305个氨基酸组成,包含20种氨基酸,分子式为C6637H10423N1807O1944S49,分子质量为148 206.65 u。RON2蛋白含有负电荷氨基酸残基数(Asp+Glu) 144个,正电荷氨基酸残基 (Arg+Lys) 177个(表3),理论等电点为9.27,脂肪族氨基酸指数为81.10,总平均亲水性为-0.403(负值代表亲水性,正值代表疏水性),不稳定指数为41.08,属于不稳定蛋白。

表3 RON2蛋白的氨基酸分析Table 3 Amino acid analysis of RON2 protein
2.4.2 疏水性和可溶性 利用ProtScale在线工具使用Hphob./Kyte & Doolittle算法预测表明,在RON2蛋白中,亲水性氨基酸均有分布,在第1 090位氨基酸处疏水值最大,为2.333;第31-32位氨基酸处疏水值最小,为-3.811(图5)。利用SOSUI在线软件,预测RON2蛋白的平均疏水性为-0.402,与ProtParam的预测结果一致,显示该蛋白属于可溶性蛋白。

图5 RON2蛋白亲疏水性分析Fig.5 Hydrophilic and hydrophobic analysis of RON2
2.4.3 跨膜区 利用TMHMM程序分析可知,RON2蛋白有1个跨膜区,位于1 201-1 223氨基酸处,与该蛋白的ProtScale疏水性区域预测结果基本一致,表明RON2蛋白可能属于跨膜蛋白。
2.4.4 亲疏水性、表面可及性和柔韧性 利用Bcepred程序分析发现,RON2蛋白共含有27个亲水性参数得分1.5以上的区域,35个柔韧性参数得分1.2以上的区域,26个表面可及性参数得分1.4以上的区域。与采用DNASTAR的Protean对RON2亲疏水性、柔韧性和表面可及性的分析结果一致。
2.4.5 二级结构预测 利用SOPMA程序分析发现,RON2蛋白的α螺旋有761个氨基酸(占58.31%),延伸链有115个氨基酸(占8.81%),β转角有58个氨基酸(占4.4%),无规则卷曲有371个氨基酸(占28.43%)。用PSIPRED在线软件分析的结果与SOPMA一致。
2.4.6 三级结构预测 利用ExPASY提供的SWISS-MODEL软件预测马泰勒虫RON2蛋白的三级结构,同源建模结果表明,该蛋白的部分三级结构与其他顶复门原虫RON2蛋白的部分三级结构相似,其中与恶性疟原虫相似性最高,具有类似的空间结构[17](图6-A)。对预测出的部分三级结构氨基酸序列,利用CLUSTAL W和Jalview 2.0软件对其同源序列进行进一步分析,结果表明马泰勒虫RON2蛋白该部分不仅在三级结构与其他顶复门原虫具有相似性,在氨基酸一级结构上也具有高度的保守性,均含有1对半胱氨酸(图6-B)。

A.马泰勒虫与恶性疟原虫RON2蛋白部分三级结构的比较,马泰勒虫新疆株RON2为浅蓝色,恶性疟原虫RON2为绿色; B.顶复门原虫RON2蛋白部分氨基酸序列对比A.Comparison of tertiary structure of RON2 protein between Theileria equi Xinjiang strain (light blue) and Plasmodium falciparum (green);B.Amino acid sequence analysis of RON2 protein of protozoan acromion图6 马泰勒虫新疆株RON2蛋白部分三级结构及其三级结构氨基酸序列对比Fig.6 Comparison of partial tertiary structure and amino acid sequence of RON2 protein of Theileria equi Xinjiang strain
2.4.7 B细胞抗原表位预测 利用DNASTAR软件中的Jameson-Wolf抗原指数算法预测结果显示,RON2含有38个B细胞抗原表位,其中平均值为0.479,最小值0.175,最大值0.672,预测得分0.6以上的有7个氨基酸区域(5-95,138-178,188-245,377-397,360-393,417-434,463-503)。
2.4.8 磷酸化位点和糖基化位点预测 利用Net-Phose3.1 Server在线软件预测RON2蛋白的磷酸化位点,结果显示,当潜在磷酸化位点阈值为0.5时,RON2蛋白存在132个潜在的磷酸化位点,包括78个丝氨酸(Ser)位点、20个苏氨酸(Thr)位点和34个酪氨酸(Tyr)位点。采用Net-NGIyc1.0 Ser-ver预测RON2蛋白的糖基化位点,发现其含有6个糖基化位点。
2.4.9 相互作用关系预测 利用STRING在线软件预测RON2蛋白的相互作用关系,结果(图7)显示该蛋白与AMA1、RON1、RON2、RON4和RON6等蛋白存在相互作用关系,说明可能与这些蛋白共同发挥着类似的功能。

图7 RON2蛋白相互作用关系预测Fig.7 Prediction of RON2 protein interactions
3 讨 论
疟原虫(Plasmodium)、隐孢子虫(Cryptosporidium)、弓形虫(Toxoplasma)、艾美耳球虫(Eimeria)、新孢子虫(Neospora)、泰勒虫(Theileria)和巴贝斯虫(Babesia)等均属于顶复门原虫,寄生于人与动物的组织器官中,对宿主的生命健康有巨大的威胁[17]。顶复门原虫具有相似的分泌细胞器,棒状体是顶复门原虫最为重要的分泌细胞器之一[18]。Cao等[19]首次在弓形虫和疟原虫中发现,RON2参与了虫体对宿主的入侵过程。戚南山[20]最早在柔嫩艾美耳球虫中发现了RON2基因,且EtRON2在未孢子化卵囊中转录水平最高,其功能可能是为子孢子阶段的入侵分泌蛋白。王旭[21]利用酵母双杂交、免疫共沉淀、GST-pull down、双分子荧光等技术验证了EtRON2与EtAMA1之间的相互作用,证明阻断两者相互作用后,可以对子孢子的入侵有一定抑制作用。研究人员通过小鼠和山羊免疫试验,证明新孢子虫AMA1与RON2蛋白具有较好的免疫保护性,可有效降低感染率[22]。但是对于马泰勒虫RON2蛋白是否参与入侵过程尚未见报道。
为了了解马泰勒虫RON2蛋白在入侵过程中的作用,本试验以马泰勒虫新疆株RON2基因序列(NCBI基因登录号MT939257)为材料进行分析,由于该基因无内含子,因此截取跨膜区胞内部分序列构建pET-32a-RON2融合重组蛋白,最终成功得到分子质量约为26 ku的重组蛋白,为包涵体蛋白,该蛋白与Malobi等[23]在东方巴贝斯虫中构建的His-RON2融合重组蛋白可溶性相似。但黄源[16]构建的GST-RON2融合重组蛋白在上清中表达明显,说明融合重组蛋白的标签不同,可能会对RON2重组蛋白的表达有较大影响。顶复门原虫RON2基因核苷酸和氨基酸多序列比对及MP系统发生树结果显示,马泰勒虫新疆株与马泰勒虫美国WA株同源性最高,核苷酸与氨基酸序列相似度分别高达82.7%和79.5%,与泰勒虫属、巴贝斯虫属RON2基因核苷酸和氨基酸序列相似性分别高于63.5%,48.9%和57.6%,44.8%,该结果与徐建林等[14]对羊巴贝斯虫RON2基因的研究结果基本一致。由此可见,RON2基因在顶复门原虫中具有高度保守性,在相近种属之间保守性更高,且蛋白结构也具有保守性[24],可以作为种属鉴定的分子特征。据此推测与其他顶复门原虫一样,RON2蛋白在马泰勒虫入侵宿主细胞过程中发挥着重要作用。
马泰勒虫RON2蛋白是一种碱性、不稳定亲水性跨膜蛋白。在预测B细胞抗原线性表位的重要参数中,亲水性被认为是抗原表位形成的重要因素[25]。可及性和柔韧性反映了蛋白质的弯曲和折叠能力,与二级结构的形成有密切的关系[26]。本研究发现,RON2蛋白具有多个亲水性与柔韧性区域,表明RON2蛋白具有形成抗原表位的结构基础。通常α螺旋、β折叠因其结构规则限制,多位于蛋白质内部,不易与抗体结合,而β转角和无规则卷曲多暴露在球蛋白表面,易与抗体结合,因而成为抗原表位的可能性较大[27]。本研究发现,RON2蛋白二级结构中α螺旋占比较大,β转角和无规则卷曲占比较小,说明其抗原表位分布较少;RON2含有38个B细胞表位,但大多参数得分较低,表明RON2蛋白整体抗原效果较弱;RON2蛋白具有132个潜在磷酸化修饰位点,还具有跨膜功能,表明该蛋白在参与信号转导、基因表达和细胞周期的生命调节过程中有巨大的潜力。
马泰勒虫RON2蛋白与其他顶复门原虫相同,都有1对半胱氨酸,并且空间结构为“发卡样”,在疟原虫和弓形虫上均有此发现[17,28]。对疟原虫和弓形虫的RON2蛋白研究表明,在该蛋白跨膜区有高度保守的氨基酸序列,包含1对半胱氨酸,半胱氨酸之间会形成二硫键,并且形成发卡样折叠,嵌插在宿主细胞膜表面,是RON2与AMA1发生相互作用形成移动连接体的重要结构,也是虫体入侵宿主细胞的关键结构[29-30]。本研究发现,RON2与其他入侵相关蛋白存在着相互作用关系,表明RON2可能与这些蛋白发挥类似作用,参与了虫体对宿主细胞的侵袭[7]。上述结果表明,马泰勒虫RON2蛋白与疟原虫和弓形虫具有相似的蛋白结构,但在入侵宿主细胞的过程中,马泰勒虫RON2蛋白是否与AMA1产生相互作用,进而形成入侵关键结构,还有待验证。
本研究获得马泰勒虫新疆株棒状体颈部蛋白RON2基因序列,并成功获得分子质量为26 ku的RON2融合重组蛋白。RON2基因具有较高的保守性,可以作为鉴定顶复门原虫种属的分子标记;其编码蛋白是一种碱性、不稳定亲水性跨膜蛋白,二级结构以α螺旋为主,亲水性较低,抗原性较弱,三级结构与其他顶复门原虫具有类似的特殊空间结构和氨基酸序列,并与其他入侵蛋白存在相互作用关系。

