运输应激对山羊小肠形态和热休克蛋白表达的影响
郑文亚,李国生,刘 犇,2,3*,方满新,2,胡迎东,2,胡 威,2,彭瑞妮,2,3,高 凡
(1.宜春学院生命科学与资源环境学院,江西宜春 336000;2.江西绿科农牧科技有限公司,江西宜春 336000;3.江西省高等学校硒农业工程技术研究中心,江西宜春 336000)
现代动物生产中,养殖场与市场、屠宰场之间的畜禽安全运输是十分重要的一个环节[1]。然而在运输过程中,各种不良因素会导致动物的压力增加,如陌生环境、禁食缺水、通风不良、高温或低温、动物的装卸、噪声以及车厢环境的污染均会危害动物福利[2],增加发病率和死亡率[3]。而小肠作为消化、吸收和营养物质代谢的重要场所[4],极易成为热应激、运输应激和缺氧应激等不良反应的靶器官[5],某些消化系统疾病通常是由这些反应引起的,例如食欲不振或亢进、腹泻或便秘等,严重时可能导致动物死亡。研究表明,运输应激损害大鼠小肠并破坏某些重要基因的表达[6]。
热休克蛋白(HSPs)作为主要的应激相关蛋白,由于其在细胞中的生理和保护作用通常被称为分子伴侣[7]。当细胞处于应激状态时,HSPs 水平升高,促进蛋白质的正确折叠,维持蛋白质的天然结构和功能[8]。对于某些由应激引起的胃肠道疾病,如胃溃疡等,HSPs 可能起重要的保护作用[9]。此外,HSPs 家族中不同成员在正常和应激条件下表现出不同的功能[10]。其中,HSP90在细胞适应应激,维持正常细胞功能中起重要作用[11],HSP70 家族被认为是细胞内有效的应激缓冲体系[12],而HSP27 在细胞发育、免疫功能调节和疾病防治中均发挥重要作用[13]。本研究旨在探讨运输应激对山羊小肠显微和超微结构的损伤及其对热休克蛋白表达的影响,对于临床上缓解运输应激所带来的危害有重要意义。
1 材料与方法
1.1 主要试剂 苏木精、伊红染液购自北京梦怡美生物科技有限公司,小鼠SP 免疫组化试剂盒及浓缩二氨基联苯胺(DAB)显色液购自北京中杉金桥生物技术有限公司,HSP27(ab79868)、HSP70(ab5439)、HSP90(ab13492)以及山羊抗小鼠IgG(ab6789)购自abcam 公司,小鼠抗β-actin 内参蛋白(BM0627)和免疫印迹技术彩色预染蛋白Marker(AR1113)购自博士德生物,4× 蛋白上样缓冲液(AI11800A)购自TAKARA 公司,超敏化学发光检测试剂盒(GS0720)购自US EVERBRIGHT INC 公司。
1.2 实验动物处理 随机选择体重(13.89±2.96 kg)、体况相似的12 只健康赣西公山羊,分为3 组,分别为对照组(不运输)、运输应激2 h 组、运输应激6 h 组,每组4 只,温度28~32℃(实验时间为2018 年7 月28日),禁食、禁水以35~45 km/h 的速度进行公路运输。颈部快速放血致死后迅速采取山羊十二指肠、空肠和回肠,部分放入4% 多聚甲醛和2.5% 戊二醛中固定,部分放入液氮中速冻后转入-80℃超低温冰箱保存,用于后续实验。
1.3 病理学研究 将4%多聚甲醛溶液固定48 h 以上的十二指肠、空肠及回肠组织,流水冲洗24 h 以上,后经脱水、透明、浸蜡、包埋制成组织切片,进行HE 染色后于光学显微镜下进行拍照,观察其病理变化。将2.5%戊二醛固定液中固定72 h 的十二指肠、空肠及回肠组织置于1%的锇酸中固定,常规脱水、包埋后用超薄切片机进行切片,经醋酸铀-枸橼酸铅染色后置于透射电镜下观察并进行拍摄。
1.4 免疫组织化学 将制备好的小肠组织石蜡切片进行烘片、脱蜡、微波抗原修复后,依据小鼠SP 免疫组织化学试剂盒操作要求进行操作,HSP27、HSP70、HSP90 均按1:400 稀释,设置阴性对照(一抗用PBS代替)。DAB 显色后苏木精复染,盐酸酒精分化,返蓝后脱水、透明、封片,立即进行观察和拍照,出现黄色或棕色即为阳性表达。
1.5 免疫印迹技术 取小肠组织充分研磨碾碎、加入裂解液裂解后用组织细胞总蛋白抽提试剂盒按操作步骤提取总蛋白,采用BCA 法测定蛋白浓度,并将实验组和对照组的总蛋白浓度调为一致。将制备好的蛋白液上样后采用聚丙烯酰胺凝胶电泳2 h,PVDF 膜湿转50 min,TBST 洗涤后封闭2 h,将膜裁剪成适宜大小后用TBST洗涤3 次,10min/ 次;4℃条件下放入一抗(HSP27、HSP70、HSP90 分别按1:5000、1:1000、1:1000 稀释)与小鼠抗β-actin(1:1000 稀释)孵育18 h,TBST 洗涤3 次,10min/次;室温下孵育山羊抗小鼠IgG(HSP27、HSP70、HSP90 分别以1:8000、1:20000、1:2000 稀释)、内参蛋白(1:1000 稀释)2h,TBST 洗涤3 次,10min/次。最后将PVDF 膜按照HRP-ECL 化学发光试剂盒的说明进行成像,AI600 化学发光成像仪拍照。用Image Pro Plus 6.0 软件对采集的条带图像进行密度值分析,目的蛋白与相对应的内参蛋白条带的密度值比值记为测试值。
1.6 实时荧光定量PCR 实时荧光定量PCR 在之前报道方法[14]的基础上进行了改进。使用组织RNA 试剂盒(R6812,Omega,USA)分离总RNA,并使用第一链cDNA 合成的逆转录反应预混液试剂盒(AT301,TransGen,China)逆转录为cDNA。使用Top Green qPCR SuperMix 试剂盒(AQ131,TransGen)在CFX96 TouchTM实时系统(Bio-Rad,USA)上扩增cDNA,表1 列出了所使用的引物序列。通过2-ΔΔCt方法分析实时荧光定量PCR 的数据,将相对表达水平标准化为β-肌动蛋白的表达水平。

表1 实时荧光定量PCR 引物序列
1.7 统计分析 使用SPSS 18.0 软件进行数据分析,单因素方差分析后再进行LSD 多重比较。数据表示为平均值±标准差,P<0.05 表示有显著差异,P≥0.05 表示无显著差异。
2 结果
2.1 运输应激山羊小肠的显微病理学观察 如图1 所示,与对照组相比,运输应激后小肠组织结构均有损伤,主要发生在固有层,固有层炎性细胞浸润十分明显,十二指肠和空肠多为淋巴细胞和浆细胞浸润,回肠主要为中性粒细胞、嗜酸性粒细胞和淋巴细胞浸润,此外,固有层充血出血,腺上皮破损、变性。十二指肠和空肠固有层细胞变性坏死,中央乳糜管扩张,部分管腔中可见坏死脱落的细胞碎屑(图1-B1),炎性细胞浸润明显(图1-C1),毛细血管充血出血(图1-B2),肠上皮细胞发生坏死、融合(图1-C2)。少量回肠黏膜上皮细胞变性坏死,固有层炎性细胞浸润(图1-B3、1-C3),腺体结构不完整,严重者腺体结构崩解,腺上皮细胞变性坏死,胞核碎裂溶解,胞质淡染出现空泡化,毛细血管充血出血(图1-B3)。

图1 山羊小肠显微病理学观察(HE 染色,400×)
2.2 运输应激山羊小肠的超微病理学观察 透射电镜观察发现,运输应激组十二指肠柱状上皮细胞微绒毛弯曲、倒伏,线粒体增生、肿胀和空泡化,内质网结构不完整、膜破裂,细胞核固缩、核膜内陷,染色质凝集边移,电子密度增高(图2 A1-C1)。空肠上皮细胞微绒毛也发生弯曲、倒伏,大量高电子密度的神经内分泌颗粒出现在细胞顶部,线粒体增殖聚集,呈圆形、细长型或S 形,部分出现肿胀、嵴断裂、内部结构模糊等现象,细胞核异常,有不同程度的固缩、坏死和凋亡,电子密度高(图2 A2-C2)。回肠柱状上皮细胞微绒毛弯曲、倒伏,部分核浓缩、形状不规则,核膜内陷或破裂,异染色质凝集边移,胞质中可见较多囊泡和小管,糖原丰富,线粒体增生,集中在微绒毛下方,形态各异,部分线粒体肿胀、嵴消失、内部结构模糊(图2 A3-C3)。

图2 山羊小肠超微病理学观察(醋酸铀-枸橼酸铅染色)
2.3 山羊小肠三种热休克蛋白的表达定位 HSP27 在十二指肠肠绒毛黏膜上皮细胞表达,且主要在胞质中表达,呈黄色,固有层白细胞有少量表达,在肠腺周围组织中表达较多,呈黄色或浅黄色(图3-A1、B1、C1);HSP70 在十二指肠主要表达于绒毛黏膜上皮细胞胞浆中,呈黄色,在固有层有少量白细胞表达,呈黄色或棕黄色,其他部位则无表达(图3-D1、E1、F1);HSP90 在十二指肠的表达主要出现在肠绒毛黏膜上皮细胞胞核及胞质中,呈浅黄色(图3-G1、H1、I1)。空肠HSP27 主要表达部位在肠绒毛黏膜上皮细胞胞质,而基底部、小肠腺周围组织表达较少(图3-A2、B2、C2);空肠HSP70 主要在肠绒毛黏膜上皮细胞胞质中表达,在固有层仅肠绒毛处有少量白细胞表达,其他部位则无表达(图3-D2、E2、F2);HSP90 在肠绒毛上皮及小肠腺上皮细胞表达,表达主要在细胞核,呈棕色或浅棕色(图3-G2、H2、I2)。HSP27 在回肠肠绒毛黏膜上皮细胞胞质有表达,呈深棕色或棕色,固有层结缔组织、坏死脱落的细胞碎屑以及白细胞均有表达,呈棕黄色,小肠腺上皮也有表达,呈浅黄色,小肠腺周围白细胞及结缔组织表达呈棕黄色(图3-A3、B3、C3);HSP70 在回肠表达量少,仅在肠绒毛黏膜上皮细胞胞质有表达,呈黄色或浅黄色(图3 D3、E3、F3);HSP90 在回肠主要在肠绒毛黏膜上皮细胞胞核表达,呈棕色或棕黄色,在小肠腺上皮也表达,呈棕色或浅棕色,在集合淋巴小结中,大量淋巴细胞表达,胞核呈棕色(图3G3、H3、I3)。
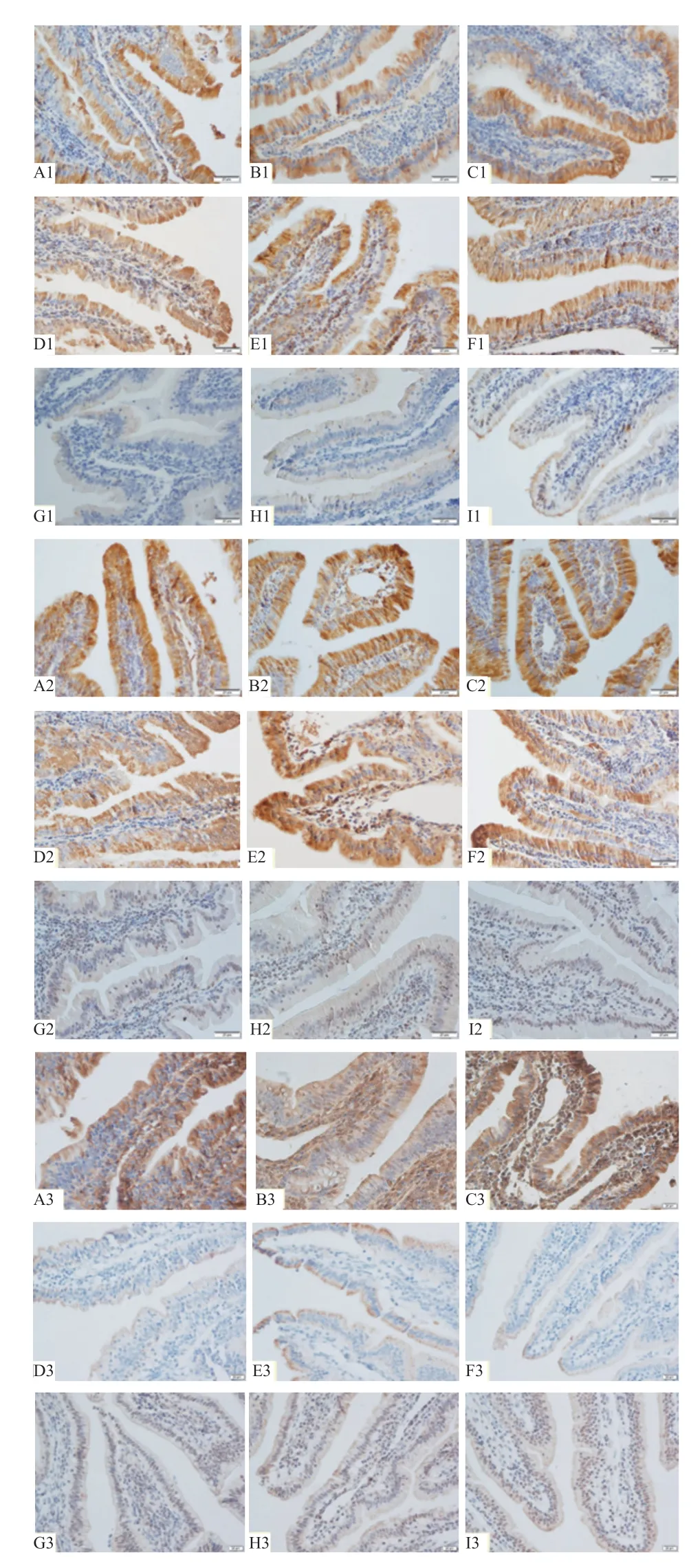
图3 山羊小肠HSP27、HSP70 和HSP90 蛋白的表达情况(400×)
2.4 山羊小肠热休克蛋白mRNA 和蛋白的定量表达情况与对照组相比,运输应激后山羊十二指肠中HSP27 的mRNA 水平在2、6 h 运输应激组均上调(P<0.05),HSP70 仅在6 h 运输应激组上调(P<0.05),而HSP90 mRNA 水平无显著变化(图4-A),运输应激后HSP27、HSP70 蛋白表达水平无变化,而6 h 运输应激组HSP90 蛋白表达水平增加(P<0.05,图4-B、C)。与对照组相比,运输2 h 组山羊空肠HSP90 mRNA 水平上调(P<0.05),运输2 h 组和6 h 组HSP70 mRNA水平均增加(P<0.05,图4-D),但3 种蛋白的表达量均没有变化(P>0.05,图4-E、F)。与对照组回肠相比,HSP27 mRNA 和蛋白水平在2 h 组均下调(P<0.05),HSP70 mRNA 和蛋白水平在2 h 组增加(P<0.05),HSP90 mRNA 和蛋白水平在2 h、6 h 运输应激后均无变化(图4-G、H、I)。
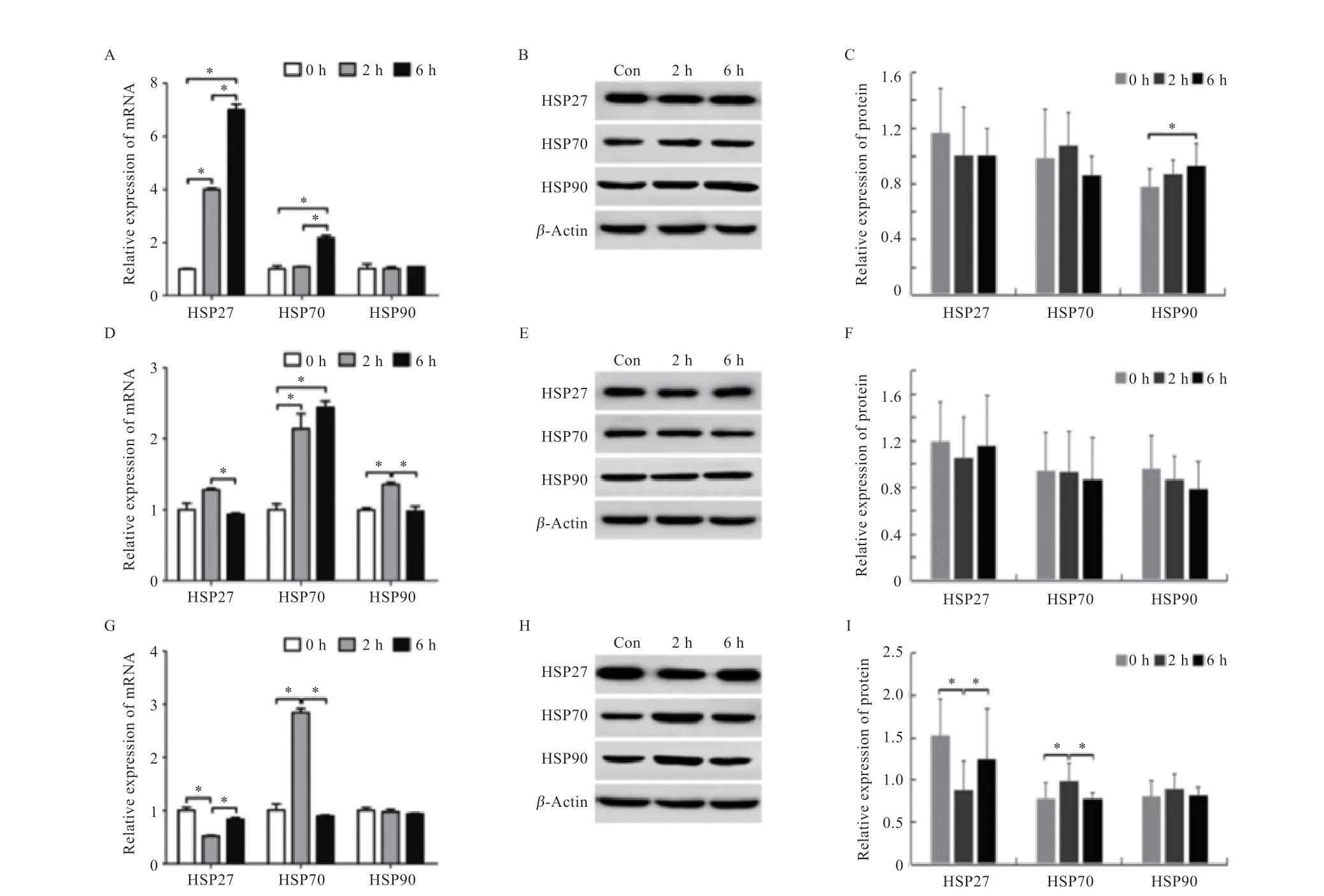
图4 运输应激对山羊小肠HSP27、HSP70 和HSP90 mRNA 和蛋白水平的影响
3 讨 论
运输常导致动物体重下降、免疫力降低和肉品质下降[15-16],还会破坏反刍动物瘤胃生态系统的稳定,使菌群发生变化、释放内毒素、对病原微生物的抵抗能力减弱,从而增加消化道感染的风险[15,17]。肠道具有营养吸收和屏障2 个重要功能[2],尤其是肠道屏障功能的完整性对机体健康十分重要[18-19],肠道屏障功能受损后极易引起各种胃肠道及胃肠道之外的疾病,包括肝病、代谢综合征与肥胖症等[20-22]。有研究报道大鼠空肠在运输后出现损伤,可能与细胞凋亡、氧化应激及激素失衡有关[6];此外,热应激时猪肠道也会出现明显损伤,包括肠绒毛顶端受损、上皮细胞脱落、肠黏膜固有层暴露、绒毛高度和隐窝深度降低等[23-24]。本研究发现运输后小肠绒毛结构不完整,细胞坏死脱落,出现较多的炎性细胞浸润及充血出血现象,肠上皮细胞微绒毛倒伏弯曲,胞核固缩,线粒体肿胀、嵴断裂,以上结果表明运输应激对山羊小肠造成了一定的结构损伤,将会致使肠道通透性增加、细菌发生易位,影响其吸收和屏障功能,从而造成运输后腹泻等疾病发生率升高[25]。
HSPs 能够作为分子伴侣参与蛋白质的折叠、转运和分配,在各种不良环境条件下,HSPs 可从细胞中释放,维持细胞内环境的稳态,并可激活多种调控蛋白,阻断细胞凋亡[26]。不同家族的HSPs 在正常或应激条件下其功能也不一样,其中HSP90 对细胞发挥正常功能以及对应激的适应起着重要作用,HSP90 作为分子伴侣,可以保护蛋白质免受降解,并能与多种信号分子形成复合物,以维持细胞的生长和生存[27],HSP90 在体外保护小肠上皮细胞免受过氧化氢或吲哚乙酸诱导的细胞损伤方面发挥重要作用,通过调控HSP90 过表达可提高对小肠上皮细胞的保护作用[28]。另有研究发现在猪运输应激过程中,由于胃及心脏中HSP90 水平都显著下降,造成其消化道和心脏出现损伤[27,29]。本研究发现运输6 h 后山羊十二指肠HSP90 蛋白表达水平升高,运输2 h 后山羊空肠HSP90 mRNA 水平上调,HSP90 的上调可能与缓解运输应激造成的肠道损伤有关。
HSP70 能增强细胞对环境变化和致病条件的耐受性,提高细胞存活率[4]。在大鼠早期肠黏膜烫伤模型中,HSP90 和HSP70 总含量显著升高,从而保护肠黏膜细胞和黏膜屏障[30],可见在HSP90 发挥保护作用的同时,肠道细胞还可通过增加HSP70 的表达来抵抗应激。HSP70 被认为是保护肠上皮细胞免受有害物质侵袭,防治溃疡的重要物质,其表达可以促进细胞增殖,抑制细胞凋亡,促进蛋白合成,从而加速溃疡的愈合[4],另外,HSP70 的表达还能够调节肠道内消化酶的活性,从而改善肠道消化吸收功能[5],研究表明HSP70 还可在热应激诱导下通过丝裂原活化蛋白激酶信号通路的激活发挥对大鼠小肠损伤的保护作用[31]。本实验结果显示运输6 h 后山羊十二指肠HSP70 mRNA 水平升高,运输2 h和6 h 后山羊空肠HSP70 mRNA 水平增加,山羊回肠HSP70 mRNA 和蛋白水平在运输2 h 后明显增加,提示HSP70 的上调对运输应激山羊小肠可能起着重要的保护作用。本研究发现运输应激后山羊十二指肠中HSP27的mRNA 水平在2 h 组、6 h 组均升高,HSP27 作为小分子HSPs 家族的一员,能够维持细胞骨架与刺激细胞增殖[26,29],HSP27 主要通过参与细胞死亡途径(如坏死、凋亡或自噬)来保护细胞免受其他致命条件的伤害[32],当肠上皮细胞受损时,HSP27 的磷酸化可作为肠上皮细胞反应激活的一种新型信号通路,使肠道能够快速重建肠上皮黏膜屏障,从而保护肠道的完整性[33]。
总之,运输应激会对山羊小肠显微和超微结构造成一定程度的损伤,运输后三种热休克蛋白表达量的变化提示其可能对运输应激山羊小肠起着一定的保护作用。

