金丝桃苷对小鼠的抗疲劳作用及机制研究
郑传痴,杨 艳,韦 余,周旭美,高健美,
(1.遵义医科大学第二附属医院药剂科,贵州遵义 563000;2.遵义医科大学附属医院药剂科,贵州遵义 563000;3.遵义医科大学药学院,贵州遵义 563000)
疲劳是指机体在生理过程中不能持续其机能在特定水平和(或)不能维持预定的运动强度[1]。若不及时消除疲劳可导致人体的内分泌功能紊乱,免疫力下降,进而引发一系列生理问题,例如失眠、抑郁等。运动性疲劳严重影响人类的健康[2−3],但其病因复杂,目前尚不明确。关于运动性疲劳的产生机制主要包括能源衰竭学说、自由基学说等。其中,氧化应激损伤即体内活性氧(reactive oxygen species, ROS)产生与抗氧化能力之间失衡的状态被认为是运动性疲劳产生的主要原因之一[4−5]。最近研究发现,核因子 E2相关因子(nuclear factor erythroid 2-related factor 2, Nrf2)作为内源性抗氧化途径的中枢转录因子在运动性疲劳中发挥重要作用[6−7]。因此,以Nrf2为作用靶点研究延缓疲劳的产生和促进疲劳的消除具有重大意义。
金丝桃苷是广泛存在于金丝桃科、蔷薇科等植物全草及果实(例如山楂、葡萄、苹果等)中的黄酮类活性成分[8]。近年来研究发现,金丝桃苷具有抗心肌缺血再灌注损伤[9]、抗肿瘤[10]、降压等作用[11]。本团队前期研究发现,金丝桃苷能够改善D-半乳糖导致的衰老模型小鼠的学习记忆功能,其作用与抑制氧化应激损伤有关[12]。但是,金丝桃苷能否通过调控Nrf2信号途径发挥抗小鼠运动性疲劳的作用尚未见报道。因此,本研究采用运动性疲劳小鼠模型研究金丝桃苷的抗疲劳作用及其可能的作用机制,旨在为后续金丝桃苷临床用于抗运动性疲劳提供实验依据。
1 材料与方法
1.1 材料与仪器
金丝桃苷(批号SH8310,经HPLC检测纯度≥98%) 北京索莱宝科技有限公司;SPF级雄性C57BL/6 小鼠(6~8 周龄,18~22 g) 湖南斯莱克景达实验动物有限公司(合格证号:SYXK(湘)2019-0004)。将所有 C57BL/6 小鼠分笼(n=5~6 只/笼)饲养,所有动物在通风良好、恒温((23±1)℃)、恒湿(55%±5%)12 h昼夜交替的房间适应性饲养7 d,实验期间小鼠能够自由进食及饮水;乳酸(lactic acid,LA)、血清尿素氮(blood urea nitrogen, BUN)、肝糖元(liver glycogen, LG)、肌糖元(muscle glycogen,MG)、活性氧簇(reactive oxygen species, ROS)、丙二醛(malonaldehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)试剂盒 上海仁捷生物科技有限公司;Nrf2、HO-1、NQO-1抗体 Abcam公司。
51119670 全波长酶标仪 ThermoFisher Scientific;LE8505自动疲劳转棒仪 瑞沃德生命科技有限公司;1645050电泳仪、GelDoc EZ全自动电泳凝胶成像分析系统 Bio-Rad。
1.2 实验方法
1.2.1 动物分组及给药 采用简单随机法将SPF级雄性C57BL/6小鼠40只随机分为4组:空白组、金丝桃苷低剂量组、金丝桃苷中剂量组和金丝桃苷高剂量组。低、中、高剂量组每天灌胃5、10、20 mg/kg的金丝桃苷,连续给药28 d。空白组灌胃等体积生理盐水。
1.2.2 小鼠疲劳转棒实验 在末次给药30 min后,进行疲劳转棒实验。将各组小鼠置于转棒疲劳仪(转速 30 r/min)上,先进行小鼠疲劳转棒训练 3次(1 次/d)后,末次给药第4 d进行正式实验,记录小鼠运动性疲劳后,从转棒上跌落的时间。
1.2.3 小鼠负重游泳实验 在末次给药30 min后,通过力竭负重游泳实验观察小鼠的耐力。在小鼠尾部固定5%体重的铅线,将各组小鼠置于水深40 cm、水温(25±1)℃的游泳箱中。小鼠从自由游泳开始至沉入水中10 s后不能浮出水面的时间作为小鼠力竭游泳时间。实验结束后,采用2%戊巴比妥钠麻醉小鼠后,眼球取血后,在4 ℃条件下3000 r/min离心10 min取上清;采血后,立即取小鼠肝脏和腓肠肌组织,于−80 ℃冰箱中保存、备用。
1.2.4 生化指标检测 通过ELISA法检测小鼠血清中BUN、LA的含量,肝组织中LG、ROS、MDA、SOD、GSH-Px,肌肉组织中MG的含量,实验步骤严格按照试剂盒说明书方法进行检测。
1.2.5 分子对接技术 通过分子对接技术观察金丝桃苷与Nrf2蛋白结合情况。首先从RSCB数据库(http://www.rcsb.org/)中下载Nrf2蛋白的晶体结构(PDB ID:3WN7),然后,从 PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)中下载金丝桃苷化合物 2D及 3D结构的 SDF格式文件。运用AutoDock vina软件进行分子对接,利用Pymol软件进行对接复合物的可视化分析。
1.2.6 Western blot检测 通过Western blot法检测小鼠肝组织中Nrf2、HO-1、NQO-1的蛋白表达。取小鼠肝组织,加入蛋白裂解液后,离心提取总蛋白并通过BCA试剂盒测定蛋白浓度,加热使其变性后,蛋白上样量30 μg,经12%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分离后,采用半干法将蛋白转印至PVDF膜上。将PVDF膜封闭于含5%脱脂奶粉的三乙醇胺缓冲盐(tris buffered saline/tween, TBST)封闭液中 1 h 后,加入相应的一抗:Nrf2(1:1000)、HO-1(1:1000)、NQO-1(1:1000),在 4 ℃ 条件下孵育一抗过夜,采用TBST洗膜3次后,以辣根过氧化酶标记的二抗室温条件下孵育1 h后,采用ECL发光法经凝胶成像系统曝光显影,采用Image J软件分析内参蛋白和目的蛋白条带的灰度值。
1.3 数据分析
实验数据均采用SPSS 18.0 统计软件进行统计分析,数据采用均数±标准差(±s)表示。多组间比较采用单因素方差分析,方差齐用Bonferroni检验,方差不齐用Dunnett’s T3检验,P<0.05有统计学意义。
2 结果与分析
2.1 金丝桃苷对小鼠转棒时间的影响
通过转棒实验观察金丝桃苷对运动性疲劳小鼠耐力和平衡性的影响。研究结果表明:与空白组比较,给药组小鼠在转棒仪上停留的时间显著(P<0.05)延长且呈剂量依赖性(表1)。
表1 金丝桃苷对小鼠转棒停留时间的影响(n=10, ±s)Table 1 Effects of hyperoside on the rotating rod lasting time of mice(n=10, ±s)

表1 金丝桃苷对小鼠转棒停留时间的影响(n=10, ±s)Table 1 Effects of hyperoside on the rotating rod lasting time of mice(n=10, ±s)
注:与空白组比较,*代表差异显著,P<0.05;**代表差异极显著,P<0.01;表2~表4同。
组别 剂量(mg/kg) 停留时间(s)空白组 109.6±1.5金丝桃苷低剂量组 5 141.4±3.9*金丝桃苷中剂量组 10 188.6±6.8**金丝桃苷高剂量组 20 239.4±6.3**
2.2 金丝桃苷对小鼠力竭游泳时间的影响
通过小鼠力竭游泳实验观察金丝桃苷对运动耐力的影响评价其抗疲劳活性。研究结果显示:与空白组比较,给药组小鼠力竭游泳时间显著(P<0.05)延长并呈剂量依赖性(表2)。
表2 金丝桃苷对小鼠力竭游泳时间的影响(n=10, )Table 2 Effects of hyperoside on the exhaustive swimming time of mice(n=10, )

表2 金丝桃苷对小鼠力竭游泳时间的影响(n=10, )Table 2 Effects of hyperoside on the exhaustive swimming time of mice(n=10, )
组别 剂量(mg/kg) 停留时间(s)空白组 649.2±16.3金丝桃苷低剂量组 5 796.8±14.1*金丝桃苷中剂量组 10 887.3±11.5**金丝桃苷高剂量组 20 966.2±13.1**
2.3 金丝桃苷对小鼠抗疲劳相关生化指标的影响
通过ELISA法观察金丝桃苷对运动性疲劳小鼠血清中LA、BUN的含量、肝组织中LG和腓肠肌组织中MG的含量。研究结果显示:与空白组比较,金丝桃苷显著降低小鼠LA、BUN的含量,升高小鼠肝糖原含量和肌糖原含量(表3)(P<0.05)。
表3 金丝桃苷对小鼠抗疲劳相关生化指标的影响(n=10, ±s)Table 3 Effects of hyperoside on anti-fatigue related indexes of mice(n=10, ±s)

表3 金丝桃苷对小鼠抗疲劳相关生化指标的影响(n=10, ±s)Table 3 Effects of hyperoside on anti-fatigue related indexes of mice(n=10, ±s)
组别 剂量(mg/kg)血清指标 肝脏 腓肠肌LA(mmol/L)BUN(mmol/L)LG(mg/g)MG(mg/g)空白组 9.5±0.4 15.3±0.5 4.2±0.1 2.2±0.1金丝桃苷低剂量组 5 7.4±0.2* 10.4±0.3* 6.4±0.3* 3.8±0.1*金丝桃苷中剂量组 10 6.1±0.2** 8.2±0.2** 8.4±0.1**5.5±0.2**金丝桃苷高剂量组 20 4.2±0.1** 6.2±0.4**11.5±0.9**6.3±0.1**
2.4 金丝桃苷对疲劳小鼠肝组织氧化应激相关指标的影响
通过ELISA法观察金丝桃苷对疲劳小鼠肝组织ROS和MDA的含量、SOD和GSH-Px活力的影响。研究结果表明:与空白组比较,金丝桃苷显著降低小鼠肝组织中ROS和MDA的含量,升高SOD和 GSH-Px 的活力(表4)(P<0.05)。
表4 金丝桃苷对疲劳小鼠肝组织氧化应激相关指标的影响(n=10, )Table 4 Effects of hyperoside on oxidative-related indexes of liver of fatigue mice(n=10, )

表4 金丝桃苷对疲劳小鼠肝组织氧化应激相关指标的影响(n=10, )Table 4 Effects of hyperoside on oxidative-related indexes of liver of fatigue mice(n=10, )
组别 剂量(mg/kg)ROS(U/L)MDA(nmol/L)SOD(U/mg prot)GSH-Px(U/mg prot)空白组 76.4±3.1 7.2±0.1 8.5±0.3 5.4±0.3金丝桃苷低剂量组 5 55.4±2.6*5.1±0.2* 12.3±0.6* 10.5±0.5*金丝桃苷中剂量组 10 27.8±4.5**3.5±0.2**17.9±0.7** 18.5±0.7**金丝桃苷高剂量组 20 19.1±3.4**2.9±0.2**25.6±0.8** 23.9±0.2**
2.5 金丝桃苷与Nrf2蛋白结合情况
通过分子对接技术观察金丝桃苷与Nrf2蛋白结合情况。研究结果显示:金丝桃苷与Nrf2的对接能量为−11.21 kcal/mol,由于其对接能量≤−5 kcal/mol,表明金丝桃苷能够与Nrf2蛋白直接结合。两者的氨基酸结合位点主要包括缬氨酸(Val608)、苏氨酸(Thr560)、丙氨酸(Ala369)、异亮氨酸(Ile559)等(图1)。

图1 金丝桃苷与Nrf2蛋白的分子对接结果Fig.1 The molecular docking results of hyperoside binding with Nrf2
2.6 金丝桃苷对疲劳小鼠Nrf2、HO-1、NQO-1蛋白表达的影响
采用Western blot法检测金丝桃苷对疲劳小鼠Nrf2、HO-1、NQO-1蛋白表达的影响。研究结果显示:与空白组比较,金丝桃苷能够明显下调胞浆中Nrf2的蛋白表达,上调胞核中Nrf2、HO-1、NQO-1的蛋白表达(图2)。
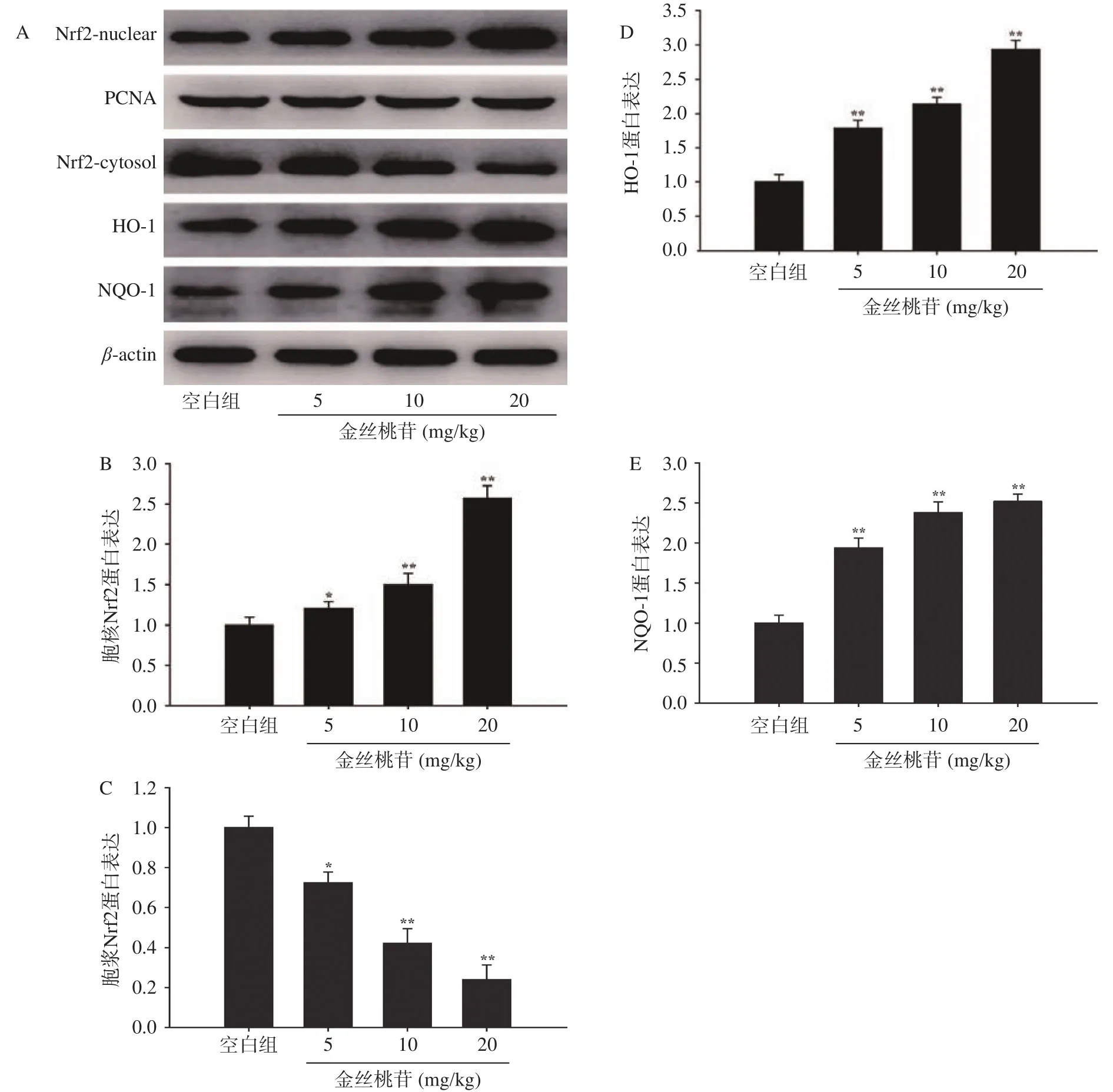
图2 金丝桃苷对疲劳小鼠肝组织中Nrf2、HO-1、NQO-1蛋白表达的影响Fig.2 Effects of hyperoside on the expressions of Nrf2, HO-1, NQO-1 of liver in fatigue mice
3 讨论与结论
运动性疲劳可导致机体能量消耗、尿素氮、乳酸等代谢产物不断累积,体力和工作能力下降,使机体呈现亚健康状态或增加疾病发生的风险[13]。转棒时间和力竭游泳时间长短可直观反映机体的运动能力,是检测药物抗疲劳作用的重要指标[14−15]。本研究结果表明,金丝桃苷能够明显延长小鼠在转棒上停留的时间和力竭游泳时间,提示金丝桃苷能够增强小鼠的运动能力和抗疲劳能力。此外,当机体长时间剧烈运动后,血液中LA大量产生,引起疲劳[16−17]。BUN是机体蛋白质代谢的产物,其含量与运动性疲劳呈正相关,即BUN清除越快,则疲劳消除的就越快[18−19]。糖原是机体重要的能量来源,其中,MG在运动中直接提供能量,LG负责储备能量。MG和LG的含量与抗疲劳能力呈正相关[20−21]。本研究结果表明,金丝桃苷能够明显降低运动性疲劳小鼠LA和BUN的水平,增加MG和LG的含量,表明金丝桃苷有效的提高了机体清除LA和BUN的能力,增强了机体糖原的储备,进而发挥其抗疲劳的作用。
剧烈运动可导致机体ROS产生加速,导致氧化应激损伤。ROS是体内一类氧的单电子还原产物,体内常见的ROS类型主要包括超氧阴离子、过氧化氢(hydrogen peroxide, H2O2)、羟自由基等[22−23]。当运动性疲劳发生时,过量产生的ROS会攻击细胞膜,使脂质过氧化物丙二醛(malondialdehyde, MDA)产生增加;同时,导致机体抗氧化物酶(SOD、GSHPx等)活力降低[24−25]。本研究结果表明,金丝桃苷能够明显降低ROS和MDA的水平,同时,增加SOD和GSH-Px的活力,提示金丝桃苷的抗疲劳作用与其抗氧化能力有关。
Nrf2 属于 cap-‘n’-collar调节蛋白家族,具有高度保守的碱性亮氨酸拉链结构。在机体稳态条件下,Nrf2与胞浆中Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein 1, Keap1)结合而处于无活性状态[26];当机体处于氧化应激状态下,Nrf2与Keap1解离后易位到细胞核,与基因启动子中存在的特定抗氧化反应元件(antioxidant response element, ARE)相互作用,启动其下游的抗氧化酶基因的转录过程,如血红素加氧酶1(heme oxygenase 1, HO-1)、NADPH醌氧化还原酶 1(NADPH quinone oxidoreductase 1, NQO1)等,进而提高细胞的抗氧化应激损伤能力[27−28]。Nrf2信号途径与机体抗氧化能力密切相关,激活Nrf2能够有效抑制氧化应激损伤,进而缓解疲劳[29−30]。但是,金丝桃苷能否通过调控Nrf2信号途径发挥抗疲劳的作用尚不清楚,因此,本研究首先通过分子对接技术分析金丝桃苷与Nrf2的结合情况。研究结果表明金丝桃苷与Nrf2具有较强的亲和力,提示金丝桃苷能够与Nrf2直接结合。基于以上计算机模拟预测结果,本研究进一步通过Western blot法验证金丝桃苷对Nrf2信号途径的影响。研究结果表明金丝桃苷能够上调胞核中Nrf2的水平,下调胞浆中Nrf2的水平,提示金丝桃苷能够促进Nrf2由胞浆易位到胞核。此外,金丝桃苷还可上调HO-1和NQO-1的蛋白表达,提示金丝桃苷能够通过调节Nrf2信号途径发挥抗运动性疲劳小鼠氧化应激损伤的作用。尽管本研究初步明确了金丝桃苷的抗疲劳能力与调控Nrf2有关,但是,其具体作用靶点仍需进一步探索。因此,在未来的研究中将通过Nrf2基因敲除小鼠深入阐明金丝桃苷抗疲劳的作用机制。
综上所述,金丝桃苷具有明显抗小鼠运动性疲劳的作用,该作用与其调控Nrf2信号途径进而增强抗氧化能力有关。

