尿KIM-1,NGAL及β2-MG在糖尿病肾脏疾病早期诊断中价值研究*
马续祥,王道洋,纵晓英,黄玉萍,丁志珍,李 莹,辛 玲
(蚌埠医学院第二附属医院肾内科,安徽 蚌埠 233000)
随着我国经济生活水平上升,居民的饮食结构改变,有学者预测5年后我国糖尿病患病率达到总人口的30%左右[1],其中糖尿病肾脏疾病(DKD)是糖尿病常见并发症之一,随着糖尿病病情的发展,部分患者最终会进入终末期肾脏病(ESRD),需要肾脏替代治疗,给家庭带来巨大的经济负担。因此,早期诊断DKD的出现并及时干预具有重要临床意义。在临床中,对于DKD的诊断传统方法主要依靠尿微量蛋白排泄率(UAER)、尿素(BUN)、血肌酐(SCr)、胱抑素C(Cys-C)、肾小球滤过率(GFR)等项目测定,但对早期肾损伤不够灵敏。肾脏病理检查是诊断DKD的“金标准”,为侵袭性操作,有肾脏出血、感染等风险,穿刺后需要制动、止血等处理,不易作为常规检查手段开展。临床上认为早期DKD主要病变是肾小球,随着研究的深入,发现肾小管功能障碍在早期DKD尿蛋白形成中发挥着重要作用,且肾小管的损伤早于肾小球的损伤。而肾小管功能障碍早期可在尿液中表达,近年来发现肾损伤分子1(KIM-1)、中性粒细胞明胶酶相关脂质运载蛋白(NGAL)、β2微球蛋白(β2-MG)等多种生物学标记物在早期肾损伤中存在高表达,与肾损伤程度呈正相关性[2]。本研究通过检测不同时期UAER的T2DM患者尿液中KIM-1、NGAL、β2-MG水平,观察上述指标与DKD的关系,探讨它们在DKD早期诊断中的价值。
1 资料与方法
1.1一般资料 选取2018年11月至2019年6月入住本院内科的T2DM患者,所有T2DM患者符合糖尿病诊断标准,通过检测UAER≥20 μg/min纳入研究,再根据UAER分为微量蛋白尿组(M组,即UAER为20~<200 μg/min)30例和大量蛋白尿组(L组,即UAER≥200 μg/min) 30例。M组中男16例,女14例;平均年龄(71.33±4.91)岁。L组中男18例,女12例;平均年龄(70.30±8.72)岁。另选取同期本院体检中心健康人员30例作为对照组,其中男16例,女14例;平均年龄(71.93±5.78)岁,生化各项指标均无异常。对照组排除以下疾病:原发或继发性肾脏病,肝脏疾病,自身免疫性疾病,近期有感染,患有肿瘤、心功能不全及其他可累及肾脏病变疾病。三组一般资料比较,差异均无统计学意义(P>0.05)。
1.2方法
1.2.1标本收集 所有受试者均收集早晨第一次中段尿5 mL,放置在塑料离心试剂管中,以1 500 r/min离心5 min,取上清液,标记后放置在-20 ℃冰箱内,避免反复冻融,造成标本误差,以备集中检测KIM-1、NGAL、β2-MG三项指标。
1.2.2标本检测 采用酶联免疫吸附试验(ELISA)法检测尿KIM-1、NGAL水平,试验步骤严格按照试剂说明书进行操作;采用化学发光法检测β2-MG水平。GFR计算采用 GFR(CKD-EPI)方程。

2 结 果
2.1各组受试者年龄及临床指标比较 三组受试者年龄比较,差异无统计学意义(P>0.05);L组BUN水平,两组Cys-C、SCr水平均高于对照组,两组GFR水平均低于对照组,差异均有统计学意义(P<0.05);L组BUN、Cys-C、SCr、GFR水平与M组比较,差异均有统计学意义(P<0.05);M组BUN水平高于对照组,但差异无统计学意义(P>0.05)。见表1。

表1 各组受试者年龄及临床指标比较
2.2各组受试者尿KIM-1、NGAL、β2-MG水平比较 与对照组比较,M、L组患者尿KIM-1、NGAL、β2-MG水平均升高,与M组比较,L组患者尿KIM-1、NGAL、β2-MG水平均升高,差异均有统计学意义(P<0.05)。见表2。

表2 各组受试者KIM-1、NGAL、β2-MG水平比较
2.3T2DM患者尿无创标志物诊断DKD特异度和敏感度 尿液中KIM-1诊断DKD的ROC曲线下面积为0.631,灵敏度为63.3%,特异度为67.4%;尿液中NGAL诊断DKD的ROC曲线下面积为0.922,灵敏度为92.2%,特异度为90.0%;尿液β2-MG中诊断DKD的ROC曲线下面积为0.867,灵敏度为84.5%,特异度为81.3%。见图1。
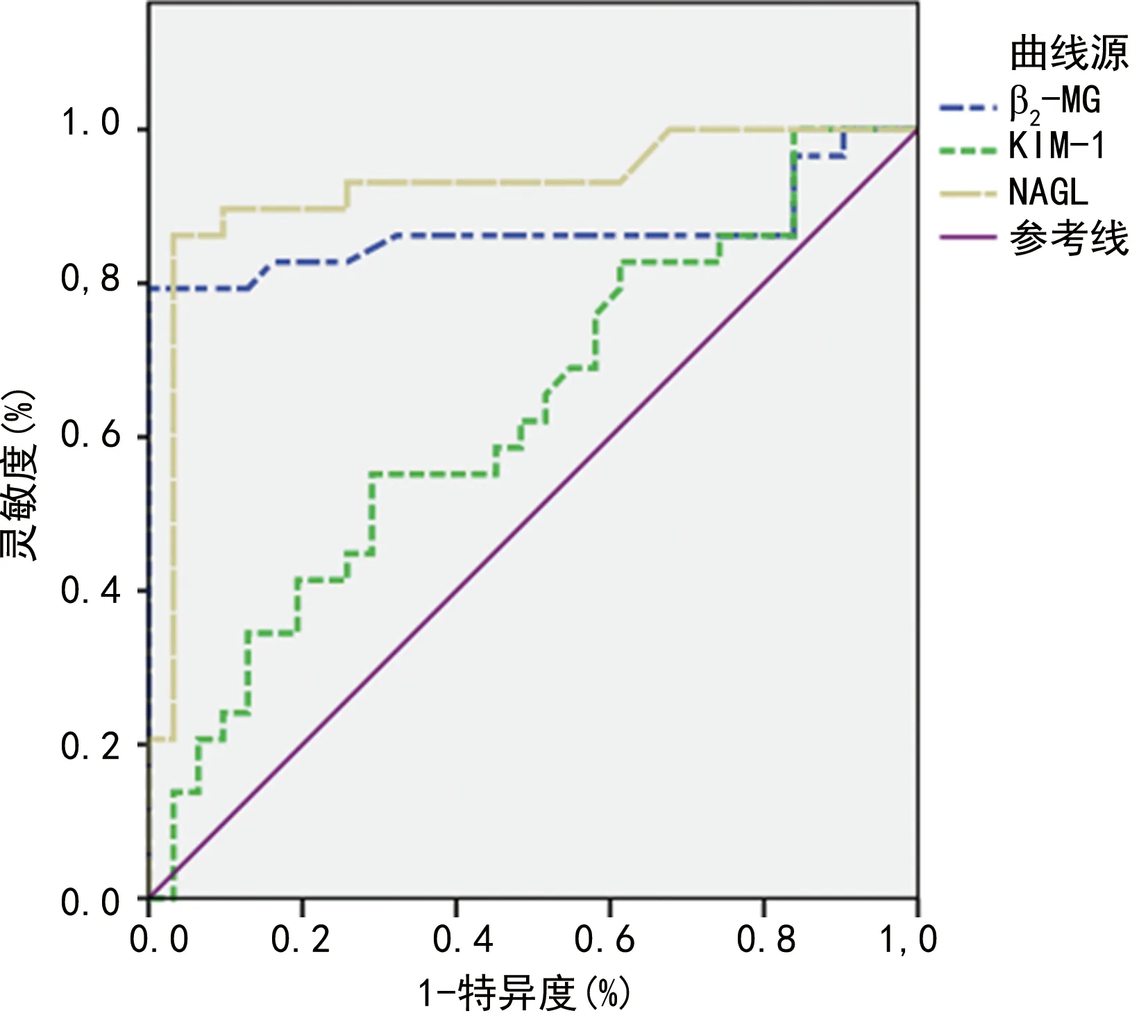
图1 T2DM患者尿无创标志物诊断DKD的ROC曲线
3 讨 论
近年来,对DKD早期出现的生物学标记物的研究尤为关注,包括血液、尿液,以及肾脏组织中的生物学指标研究。其中尿液生物学标记物具有检测方便、无创快捷等优势,而尿KIM-1、NGAL、β2-MG作为重要的生物学标记物在DKD早期诊断中起到重要作用。
KIM-1是一种跨膜糖蛋白,属于免疫球蛋白基因超家族,分为细胞外和细胞质部分,并在肾脏、肝脏和脾脏中表达。其通过分子靶点在肾损伤中发挥作用。KIM-1与其组织水平密切相关,与肾组织损害密切相关。其不仅是急性肾损伤(AKI)的早期生物标志物,对于评估肾脏长期预后也具有潜在的作用[3]。KIM-1可以快速、灵敏、特异地反映各种原因导致肾脏的损伤和恢复的过程,是一种检测早期肾损伤的可靠生物学标志物。研究认为,在各种类型的原发性或继发性肾病中,肾组织的KIM-1表达水平明显升高,包括DKD。同时尿KIM-1与肾组织的KIM-1表达一致,与肾功能呈负相关[4]。在一项动物溶血性AKI实验中,24 h后大鼠尿KIM-1和NGAL水平均明显升高,并随着肾小管持续损伤而升高[5]。国内研究显示,尿KIM-1水平与肾功能呈负相关,与尿酸等呈正相关,与病理指标中IGA分级、肾小球硬化、肾间质纤维化、肾小管萎缩等指标相关性较强,其尿KIM -1水平能够较正确地反映肾间质纤维化的程度[6]。
NGAL是一种脂质运载蛋白,相对分子质量为25×103KD,是在研究调节基质金属蛋白酶9(MMP-9)时被发现,由一条多肽链构成,含有178个氨基酸残基。其广泛分布于机体如呼吸消化系统等各组织中。中性粒细胞及炎症血管内皮细胞产生NGAL,可诱导肾脏祖细胞向肾小管上皮细胞分化,以修复、再生受损的肾小管上皮细胞。因此,当肾小管受损时,血液中NGAL水平的升高是促进肾小管修复和再生的保护性因素,又可以自由通过肾小球并稳定存在于尿液中,生物功能具有多样性[7]。NGAL主要在近端小管中表达,当肾小管上皮细胞受到损伤刺激时大量分泌,其参与炎性反应的清除,同时能够调节免疫应答[8],血NGAL浓度升高同时伴随着尿NGAL增多,尿NGAL也反映了肾脏损伤的存在。国内学者研究表明,尿NGAL水平在病理性蛋白尿出现前就已经升高,并未随着肾损伤的加重而升高,是DKD早期出现的标志物。脓毒症AKI 患者中,NGAL和KIM-1水平在24 h显著升高后,至72 h仍维持在较高水平,在血液透析治疗过程中,NGAL、KIM-1受干扰因素较小,可对AKI患者肾功能真实水平进行评估[9]。在一项缺血再灌注损伤诱发急性肾损伤模型的动物实验中,NGAL在AKI向CKD转换过程中持续升高,缺血损伤的严重程度和频率决定了缺血所致AKI的进展和结局。KIM-1和NGAL均可无创、早期发现AKI,其中NGAL更有价值[10]。
研究显示,β2-MG由体内淋巴细胞合成并广泛存在于细胞膜上物质,是由多种氨基酸残基组成的单链多肽低分子量蛋白质,可以通过肾小球滤过膜进入肾小管,绝大部分β2-MG在近曲小管分解成为氨基酸,所以在通常情况下健康人的尿液中β2-MG含量很少,当肾小球滤过功能增加或肾小管重吸收功能降低时,尿液中β2-MG水平就会升高,所以检测尿β2-MG对早期肾损伤的发现有重要意义。临床上该指标也是常用判断方法之一,DKD患者早期即有尿β2-MG水平的高表达,临床上可以此为一定依据[11]。同时国内学者研究显示,当糖尿病患者SCr、BUN正常时,尿β2-MG已经显著升高,提示早期肾脏损伤[12]。β2-MG同时也是慢性移植物肾病的一个很有前途的标记物[13]。在我国西藏地区DKD患者发病早期,BUN和UAER还未出现异常时,尿液中NGAL、 β2-MG 水平已经出现显著增加,且这种趋势随着 DKD患者 GFR 的减少而升高,NGAL和β2-MG 可作为早期诊断 T2DM 肾损伤的可靠指标[14-15],本研究结果与之相接近。
本研究结果显示,尿KIM-1、NGAL、β2-MG在病理性蛋白尿出现之前已经升高,且随着传统的肾功能指标血BUN、Cys-C、SCr水平的升高及GFR的下降而增高,尿KIM-1、NGAL、β2-MG曲线下面积分别为0.631,0.922,0.867。
综上所述,尿KIM-1、NGAL、β2-MG对识别早期DKD的发生有一定临床意义,NGAL敏感度、特异度相对更高。

