抑制沉默信息调节因子1/p53通路对同型半胱氨酸诱导的心肌纤维化的影响▲
余 平 李叶子 万少兵
(湖北省武汉市第三医院急诊科,武汉市 430060,电子邮箱:y94eay@163.com)
心肌纤维化又称心肌钙化,是由心脏代谢异常、心肌缺血以及冠状动脉硬化等多种因素引起的一种疾病,呈持续性或反复加重,可逐渐发展为心力衰竭,即慢性缺血性心脏病[1-2]。同型半胱氨酸(homocysteine,Hcy)水平升高是发生心肌纤维化的重要原因之一,其可以直接或间接导致血管内皮细胞损伤,增强血小板功能,从而促进血栓形成[3-4]。故本实验使用Hcy诱导CF以建立心肌纤维化细胞模型。沉默信息调节因子(sirtuin,SIRT)1为哺乳动物SIRT家族成员之一,可以使多个蛋白质去乙酰化而改变其活性,通过调节SIRT1可以调控细胞能量代谢、氧化应激等多种生物作用[5]。p53蛋白的主要作用包括阻滞细胞周期、促进细胞凋亡等[6]。有研究表明,SIRT1可通过将p53蛋白的第382位赖氨酸残基乙酰化,降低p53蛋白与DNA顺式元件的结合能力,从而抑制细胞凋亡[7]。本实验旨在研究抑制SIRT1/p53通路对Hcy诱导的心肌纤维化的影响。
1 材料与方法
1.1 细胞和试剂 心肌成纤维细胞(cardiac fibroblasts,CF)购于中科院上海细胞库(批号:234015);Hcy购自武汉博士德生物工程有限公司(批号:780346);SIRT1/p53通路抑制剂EX527购自北京四季青生物科技有限责任公司(批号:2220216);杜氏改良伊戈尔培养基(Dulbecco′s modified Eagle medium,DMEM)、胎牛血清、0.25%胰蛋白酶购于美国Abcam公司(批号:10247、55930、77380);细胞计数检测(cell counting kit-8,CCK-8)试剂盒购于北京鼎国科技有限公司(批号:2300089);膜联蛋白Ⅴ(Annexin Ⅴ)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)试剂盒购于天津百赛斯生物科技有限公司(批号:1113076);TRIzol试剂盒、反转录试剂盒购、SYBR Premix Ex Taq Ⅱ购于日本TaKaRa公司(批号:2340754、3476208、2502179);甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物购于上海生工生物工程股份有限公司(批号:7990376);二喹啉甲酸试剂盒、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)凝胶配置试剂盒、聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)购于上海碧云天生物技术研究所(批号:31349、20169、1154269);SIRT1抗体、乙酰化p53(acetylated p53,Ac-p53)抗体、Ⅰ型胶原α1链(collagen type Ⅰ alpha 1 chain,COL1A1)抗体、Ⅲ型胶原α1链(collagen type Ⅲ alpha 1 chain,COL3A1)抗体、肌动蛋白α2(actin alpha 2,Acta2)抗体、β-肌动蛋白(β-actin)抗体购于美国Santa Cruz公司(批号:33345670、36309270、32013452、340983457、22456983、55309718);二抗购于美国Sigma公司(批号:34075217)。
1.2 实验方法
1.2.1 细胞培养、处理和分组:采用含10%胎牛血清的DMEM培养基培养CF,培养条件为5% CO2和37℃。每2 d换一次培养液,当细胞融合度达80%~90%时,加0.25%胰蛋白酶消化传代,收集第3~5代细胞进行实验。取对数期CF接种于6孔板中(2×105个/孔),将细胞分为3组进行实验,即NC组、Hcy组、EX527+Hcy组。NC组为正常培养的CF;Hcy组的细胞长满85%以上时,换含0.5%胎牛血清的DMEM培养基继续培养24 h,加入10 μL浓度为0.5 mmol/L的Hcy刺激细胞,培养24 h后进行后续实验;EX527+Hcy组细胞在给予10 μL浓度为0.5 mmol/L浓度的Hcy刺激后立即加入10 mL的SIRT1/p53通路抑制剂EX527(1 μmol/L),继续培养24 h后进行后续实验。
1.2.2 CCK-8法检测CF增殖能力:调整CF密度至4×105个细胞/mL,接种于96孔板(2×103个细胞/孔),培养24 h后,向每个待测孔加入10 μL的CCK-8试剂,37℃孵育2 h,使用酶标仪(无锡集佳智能科技有限公司,型号:ZG-660)在490 nm波长下检测细胞的光密度值(A),计算细胞存活率,细胞存活率(%)=A实验组/A对照组×100%。每组设置3个复孔,实验重复3次。
1.2.3 流式细胞术检测CF凋亡率:收集各组CF,重悬于500 μL 1×结合缓冲液中。按照凋亡检测试剂盒依次加入5 μL Annexin V-FITC和5 μL PI,避光染色30 min。1 h内上流式细胞仪(德国Partec公司,型号:CyFlow® Space)检测细胞凋亡率。每组设置3个复孔,实验重复3次。
1.2.4 实时荧光定量PCR检测COL1A1、COL3A1、Acta2 mRNA相对表达水平:使用TRIzol试剂提取各组CF的总RNA,然后使用反转录试剂盒生成cDNA,利用SYBR Premix Ex Taq Ⅱ在荧光定量PCR仪(美国Agilenti公司,型号:Mx3005P)上进行反应。以cDNA为模板进行实时荧光定量PCR扩增。反应体系为10×PCR Buffer 2.5 μL,MgSO42.5 μL,dNTPs 2.5 μL,正反向引物各0.5 μL,cDNA 2 μL,RNase-Free ddH2O补足体系至25 μL。反应条件为95℃预变性60 s,95℃变性60 s,56℃退火30 s,72℃延伸30 s,共40次循环。COL1A1正向引物5′-CTGGTCCTGTTGGAAGTCGT-3′,反向引物5′-CAGATGCACCTGTTTCTCCA-3′; COL3A1正向引物5′-CTGGCGGCTTTTCACCATAT-3′,反向引物5′-TCTCCGCTCTTGAGTTCAGG-3′;Acta2正向引物5′-CTGTGCTATGTCGCTCTGGA-3′,反向引物5′-ATAGGTGGTTTCGTGGATGC-3′;GAPDH正向物5′-CAAGAAGGTGGTGAAGCAGG-3′,反向引物5′-CCACCCTGTTGCTGTAGCC-3′。以GAPDH为内参,采用2-ΔΔCt法计算相对表达量,其中ΔCt=Ct目的基因-Ct内参基因,ΔΔCt=ΔCt实验组-ΔCt对照组。每组设置3个复孔,实验重复3次。
1.2.5 蛋白免疫印迹实验检测COL1A1、COL3A1、Acta2、SIRT1、Ac-p53蛋白相对表达水平:使用二喹啉甲酸蛋白提取试剂盒提取各组CF的总蛋白,检测蛋白浓度后进行变性处理,取30 μg蛋白样品进行SDS-PAGE反应,转到PVDF,封闭,分别加入一抗稀释液(1 ∶1 000),4 ℃孵育24 h,TBST洗涤,分别加入二抗稀释液(1 ∶2 000),室温孵育1 h,暗室内曝光显影,应用Image J软件分析各条带灰度值。每组设置3个复孔,实验重复3次。
1.3 统计学分析 采用SPSS 22.0软件进行统计分析。计量资料以(x±s)表示, 多组间比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05表示差异具有统计学意义。
2 结 果
2.1 3组CF存活率的比较 与NC组比较,Hcy组CF存活率升高(P<0.05);与Hcy组比较,EX527+Hcy组细胞存活率降低(P<0.05)。见表1。

表1 3组CF存活率 的比较(x±s,%)
2.2 3组CF凋亡率的比较 与NC组比较,Hcy组CF凋亡率降低(P<0.05);与Hcy组比较,EX527+Hcy组细胞增殖率升高(P<0.05)。见表2和图1。

表2 3组CF凋亡率的比较(x±s,%)
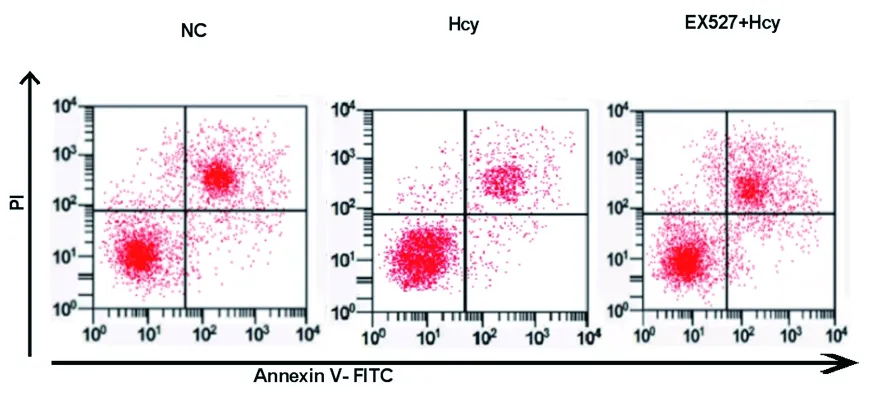
图1 各组细胞凋亡情况
2.3 3组CF中纤维化相关因子的mRNA和蛋白相对表达水平的比较 与NC组比较,Hcy组CF中COL1A1、COL3A1和Acta2 mRNA和蛋白相对表达水平均升高(均P<0.05);与Hcy组比较,EX527+Hcy组CF中COL1A1、COL3A1和Acta2 mRNA和蛋白相对表达水平均降低(均P<0.05)。见表3和图2。

表3 3组CF中纤维化相关因子mRNA和蛋白相对表达水平的比较(x±s)
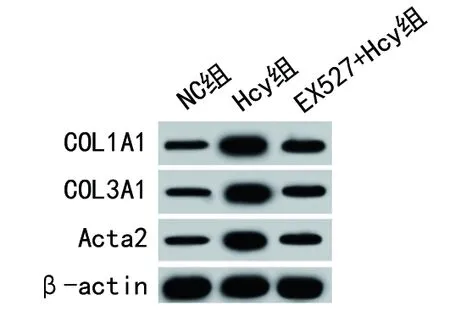
图2 3组CF中纤维化相关因子的蛋白表达情况
2.4 3组CF中SIRT1/p53通路相关蛋白相对表达水平的比较 与NC组比较,Hcy组CF细胞中SIRT1蛋白相对表达水平升高,而Ac-p53蛋白相对表达水平降低(均P<0.05);与Hcy组比较,EX527+Hcy组细胞中SIRT1蛋白相对表达水平降低,而Ac-p53蛋白相对表达水平升高(均P<0.05)。见表4和图3。

表4 3组CF中SIRT1/p53通路相关蛋白相对表达水平的比较(x±s)
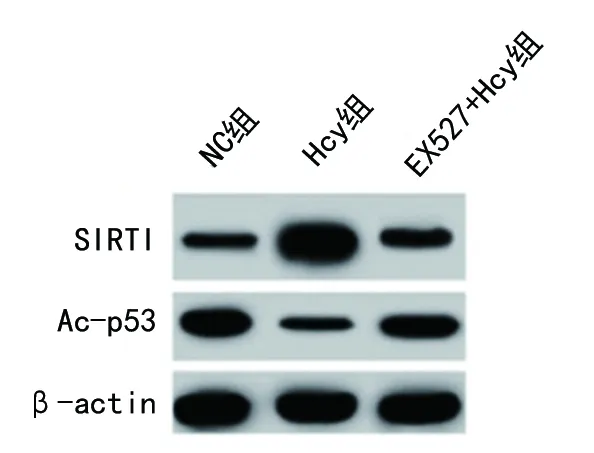
图3 3组CF中SIRT1/p53通路相关蛋白的表达情况
3 讨 论
心肌纤维化是高血压所致心肌重构的重要病理特征,是发生心律失常的基础,也是心力衰竭的潜在危险因素[8]。CF能够合成应力纤维、纤维化相关基因子COL1A1、COL3A1和Acta2的基因和蛋白,心肌纤维化是CF形成并活化的过程[9-10]。Hcy是一种含硫氨基酸,Hcy升高是造成心肌纤维化的主要原因。动物实验表明,Hcy可诱导大鼠心肌微血管内皮细胞损伤[11],而降低Hcy表达水平可以延缓酒精性心肌病大鼠的心肌纤维化[12]。王洁文[13]的研究发现,原发性高血压患者血浆Hcy水平与心肌纤维化关系密切。因此,本实验使用Hcy诱导CF以模拟心肌纤维化,并以CF中纤维化相关因子COL1A1、COL3A1和Acta2等[14]作为观察指标,结果显示,经Hcy诱导后CF的增殖率升高,而凋亡率降低,细胞中COL1A1、COL3A1和Acta2的 mRNA和蛋白相对表达水平均升高,提示成功建立心肌纤维化模型。
SIRT1与p53的相互作用可抑制细胞凋亡[7],两者对多种心血管病变均具有改善作用。庞明[15]的研究发现,SIRT1对Hcy诱导的血管内皮细胞衰老起到保护作用;邬云斌等[16]研究表明,白藜芦醇对大鼠心肌缺血再灌注损伤的保护作用与SIRT1/p53通路有关系。此外,抑制SIRT1表达水平对乳鼠CF的活性有明显的抑制作用[17]。S-腺苷同型半胱氨酸可在S-腺苷同型半胱氨酸水解酶(S-adenosine homocysteine hydrolase,SAHH)的作用下可分解为腺苷和Hcy。糖尿病心肌病的病因之一是由糖基化的胶原沉积所致心肌间质纤维化,而SAHH和Hcy水平升高可能是大鼠早期糖尿病心肌病发生和发展的重要机制,而SIRT1水平升高可抑制SAHH水平从而缓解的糖尿病心肌病[18]。本实验结果显示,给予SIRT1/p53通路抑制剂EX527干预后,EX527+Hcy组SIRT1蛋白相对表达水平降低,Ac-p53蛋白相对表达水平升高,提示EX527成功抑制SIRT1/p53通路;EX527+Hcy组CF增殖率降低,细胞凋亡率升高,细胞中的COL1A1、COL3A1和Acta2 mRNA和蛋白相对表达水平均降低(均P<0.05),这表明抑制SIRT1/p53通路可以减轻Hcy诱导的心肌纤维化程度。
综上所述,Hcy可促进CF增殖而抑制其凋亡,从而诱导心肌纤维化的发生,而抑制SIRT1/p53信号通路可以减轻Hcy诱导的心肌纤维化。

