人工肛门括约肌夹持机构的设计与优化
柴川页 ,颜国正 *,韩 玎 ,赵 凯 ,华芳芳
(1. 上海交通大学电子信息与电气工程学院,上海200240;2. 上海交通大学 医疗机器人研究院,上海 200240)
1 引 言
大便失禁指肛管和括约肌对粪便失去蓄控力,严重影响患者的生活。人工肛门括约肌(Ar⁃tificial Anal Sphincter,AAS)是可治疗大便失禁的新兴手段之一,通过原位植入腹腔代替功能缺失的括约肌实现控便与排便动作。夹持机构是AAS 的关键组成部分,通常环绕直肠肛管并与肠道外壁紧密接触,其运动学和力学特点直接影响到患者体验。
Yan 团队在AAS 动物实验中发现夹持机构被大量组织增生包裹,而且植入2 个月后机构出现严重的机械故障[1],这些现象说明夹持机构的生物相容性不足。AAS 的材料选择直接影响生物相容性,长期植入式医疗设备广泛使用的材料有医用硅橡胶、钛合金、尼龙等。Artificial Bowel Sphincter(ABS)、Soft Anal Band(SAB)和 Ger⁃many Artificial Sphincter(GAS)等就是硅橡胶环形袖套式AAS[2-6]。硅橡胶轻软、生物相容性好,但因强度不足仅用于形状简单的结构。Magnet⁃ic Anal Sphincter(MAS)是医用钛合金磁珠式AAS[7],其强度高于硅橡胶,但磁珠间被动收紧力较小导致最大控便量不足。上述AAS 采用环形肛门括约肌挤压肠道的仿生学控便机理,受夹持肠壁将形成大量褶皱,致使肠道局部高压产生血供安全隐患,80%的患者须再次手术治疗[8]。Marziale 等人通过数值模拟和实验评估了周向与钳夹式人工尿道括约肌的力学特点[9],Zan 等人也通过数值模拟的方法分析了一种夹钳式AAS的生物力学相容性[10],但仅停留在理论研究阶段而未经过工程验证。Zhou 等研发了摆臂式仿耻骨 AAS[11],Wang 等研发了恒力弹压式 AAS[12],但由于肠道的粘弹性及机构并非完全封闭,夹持肠道时常出现移位、膨出的现象,影响控便性能。
除了生物相容性,控排便响应时间也是AAS夹持机构的关键指标之一。传统AAS 响应时间较长,执行效率低下,液压驱动的ABS 耗时5~8 min[2],基于形状记忆合金的 Anal Sphincter-Shape Memory Alloy 开闭 时间约 5 min[13]。采用 电机驱动后,Doll 等设计的 GAS 响应时长达 8~9 min[3],Ke 等设计的机械式假体响应时间为 80 s[14]。
上述分析可见,现有AAS 夹持机构生物相容性较低、响应时间较长,本文在人体排便机制及其力学特点研究的基础上,提出一种新型夹持机构,并设计出由三组交错叠放的夹持臂构成的封闭式括约肌假体(Novel Closed-link Artificial Anal Sphincter,NCAAS)。基于新型假体结构,本文进行了运动学与力学理论分析,确定设计参数,并通过有限元仿真说明了机构控便有效性和安全性。样机的制作依照理论计算及仿真结果,并实施了控排便时长实验与夹持性能实验,实验结果亦验证了夹持机构的有效性及安全性。NCAAS 兼有肛门括约肌封闭式收缩与耻骨直肠肌形成肛肠角的仿生学特点,可满足人体日常所需控便量,具备良好的生物相容性,而且与传统AAS 相比较大缩短了响应时间。
2 排便机制及力学特点
2.1 排便动作特点
人体在静息控便时,随着粪便积累使直肠膨胀、直肠内壁受体对粪便量采样,判断是否需要排便。排便行为的执行取决于个体腹压、结肠动力、直肠扩张性、肛肠角以及盆底肌之间的协调[15]。耻骨直肠肌包绕直肠肛管,另一端连接于耻骨末端。如需排便,耻骨直肠肌、括约肌放松,直肠伸直,肛肠角为100°~110°,肛门打开排出粪便。待排便结束后,内括约肌、耻骨直肠肌收缩,肛门关闭,肛肠角减小至 80°~90°恢复控便[16]。文献[17]表明尽管各种哺乳动物的直肠长度在4~40 cm 内变化,但排便时间维持在12±7 s。
2.2 肠道力学性能
肠道作为生物组织因胶原特性具有非线性机械行为、明显的粘弹性。为简化肠道模型,研究中通常忽略肠道的黏膜皱襞,将其看作柱状压力管,故因粪便积累产生的压力不仅使肠道管道在圆周方向扩展,同时引起管道长轴方向伸展、径向收缩,并致使管壁变薄[18]。因此,研究中采用三维Ogden 不可压缩超弹模型对肠道组织材料建模,密度1 020 kg·m-3,应变势能为式(1):
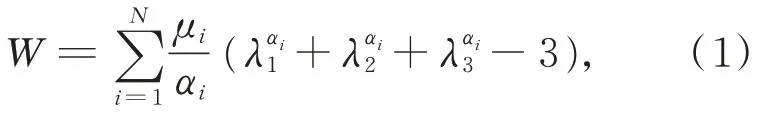
其中:λ1,λ2,λ3分别为主应变伸长率,μi,αi为材料常数,取值如下[19]:μ1=8.3 kPa,μ2=0.3 kPa,μ3=6.2 kPa,α1=7.625,α2=13.875,α3=7.625。
3 夹持机构的设计
3.1 设计要求
NCAAS 夹持机构主要包括夹持臂和传动机构,传动机构用于驱动夹持臂运动。设计夹持机构时主要考虑以下要求:
(1)AAS 长期植入性要求夹持机构在满足功能的条件下,各组件集成小型、紧凑;夹持臂材料轻便、生物相容性良好;传动机构具有自锁性,即保持某一夹持状态的能力。
(2)为顺利包绕直肠,夹持臂完全张开时的内切圆直径应不小于松弛直肠的平均直径D=20 mm;要减少夹紧肠道造成的大量褶皱,夹持臂完全闭合时的长度应不小于空瘪肠道的宽度
(3)将夹持机构设置匀速夹持,排便时间设计为哺乳动物的排便时长;否则,会损伤腹腔内生物组织或导致排便效率低下。
(4)要求能至少控制4.6 kPa的粪便量[14],夹持臂封闭夹紧肠道时肛肠角不大于 90°[16];同时,为保证肠道血供安全阈值,夹持压强不应大于10 kPa[10]。
3.2 夹持臂运动学分析
如图1 所示,力学建模中将夹持臂简化为曲柄滑块机构进行刚体运动学分析[20]。
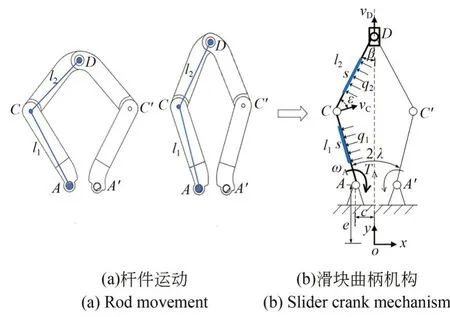
图1 运动学与力学分析Fig.1 Kinematics and mechanical analysis
模型以驱动器输出轴O为原点创建直角坐标系Oxy,定义夹持臂各铰接点坐标A(x1,y1),C(x2,y2),D(x3,y3)。建立铰接点坐标矩阵的数学模型,如式(2):
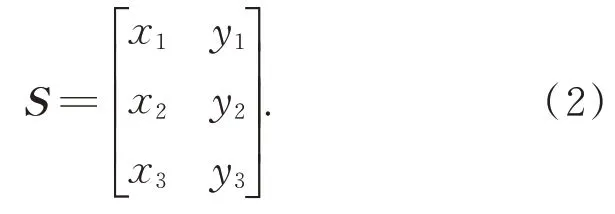
由 于D点 沿y轴 运 动 ,可 得β和λ的 关 系 ,如式(3):
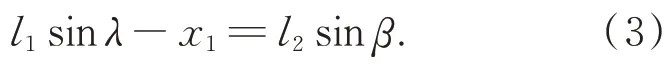
夹持臂根部A为固定点,设|x1|=c,y1=e;c,e为常数。各铰接点坐标矩阵数学模型,如式(4):
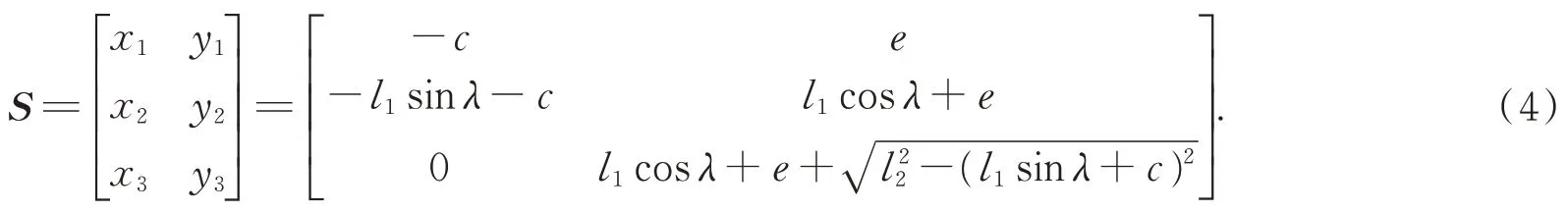
夹持臂运动时角速度ωA恒定,且与机构夹持臂张角λ满足式(5):

夹持机构长度d以及D点的速度vD和加速度aD,如式(6)~式(8):

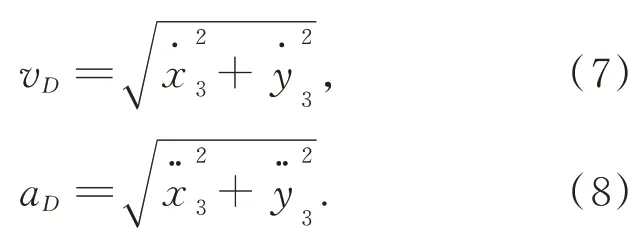
3.2.1 夹持力方程
因夹持臂运动速度平稳缓慢,故可将夹持臂夹持直肠肛管作为静力系统进行力学分析。取图1(b)中心线左侧机构为研究对象,根据虚功原理,驱动夹持臂运动的扭矩TA经微小时间增量Δt转过微小角度增量 Δθ=ωAΔt,该过程所作的虚功为WA。考虑到肠道生物组织具有柔性与粘弹性,夹持臂与肠道外壁作用时受力可视为均布载荷,并作用在位于s 区域的内。扭矩TA的虚功WA等于 杆AC 所 受 夹持 反 力q1与 杆CD 所受 夹持反力q2在Δθ内所作虚功之和W1+W2。根据虚功原理,可得式(9):
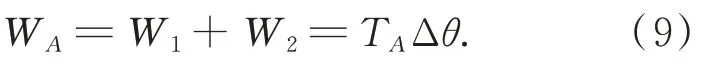
杆 AC 所作虚功W1,如式(10):
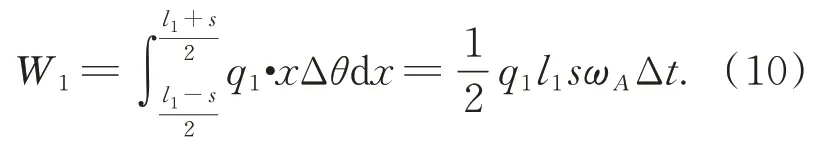
以下说明如何计算杆CD 所作的虚功W2:
将 C,D 的微位移 ΔlC,ΔlD沿平行于杆 CD 和垂直于杆CD 的方向分解,如式(11)~式(12):
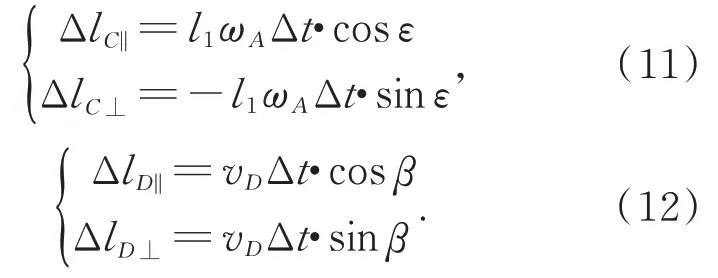
由于杆件不会被拉长,故满足式(13):

杆 CD 上任意点P的虚功 ΔWP,如式(14):
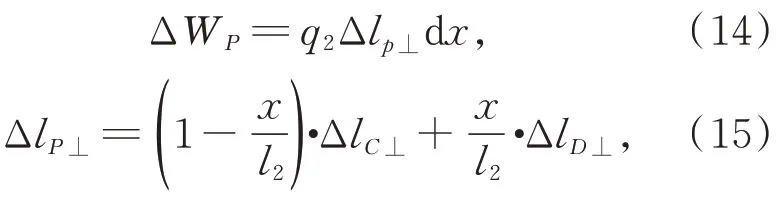
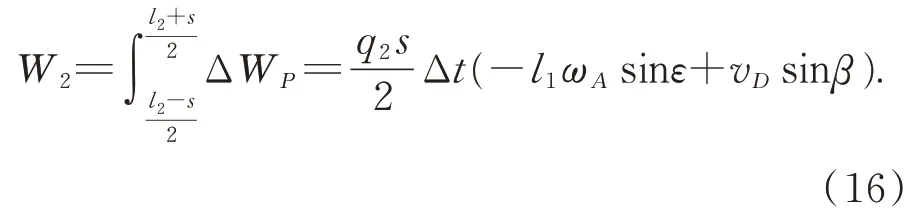
将式(16)代入虚功方程(10),有:
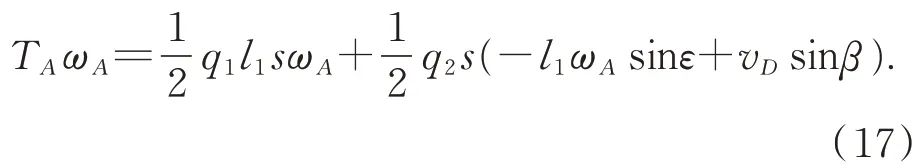
将式(17)代入(1)、(3)、(4)、(7),故夹持力载荷方程如式(18):
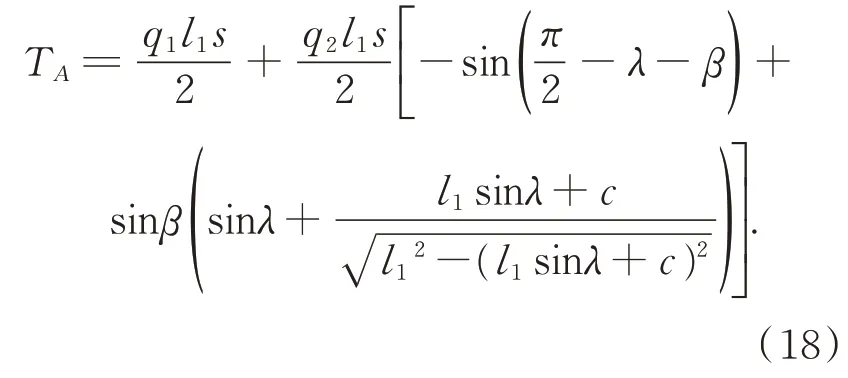
3.2.2 夹持臂有限元分析
实际上夹持臂具有一定曲度,故前文将夹持臂视为连杆机构分析夹持肠道的过程存在一定误差,因此,本节基于Ansys 有限元分析对夹持机构夹持肠道的动作做瞬时动力学仿真。医用刚性材料中钛合金密度4 500 kg·m-3是医用尼龙的4 倍,建模过程中考虑到夹持机构的轻量性,因此将夹持臂材料设置为医用尼龙PA6,密度1 130 kg·m-3,杨氏模量 2.32 GPa,泊松比 0.34,三层夹持臂间距设置为4 mm;肠道简化为外径20 mm 厚度 2 mm 的圆柱管,材料根据公式(1)设置。如图2 所示,网格划分方法为Tetrahedrons,夹持臂与肠道接触面网格单元尺寸设置为0.002 m,节点数为25 220,单元数为12 908。考虑真实情况下机构夹持肠道的方式与肠道变形情况,本文设置了6 处操作臂-肠道接触面,1 处肠道-肠道接触面,摩擦系数均设为0.1;操作臂之间通过joint 连接,在夹持臂根部设置3 处Body-Ground 转动副,余下5 处铰链设置为Body-Body转动副。固定肠道上、下两个端面,在Body-Ground 处施加 3(°)/s 的恒定角速度载荷,运动12 s 后停止,求解时间设置为15 s。夹持过程肠道和夹持臂位移云图如图3 所示,夹持机构完好,直肠变形由夹持臂控制,在t=9.09 s 时肠道基本闭合。
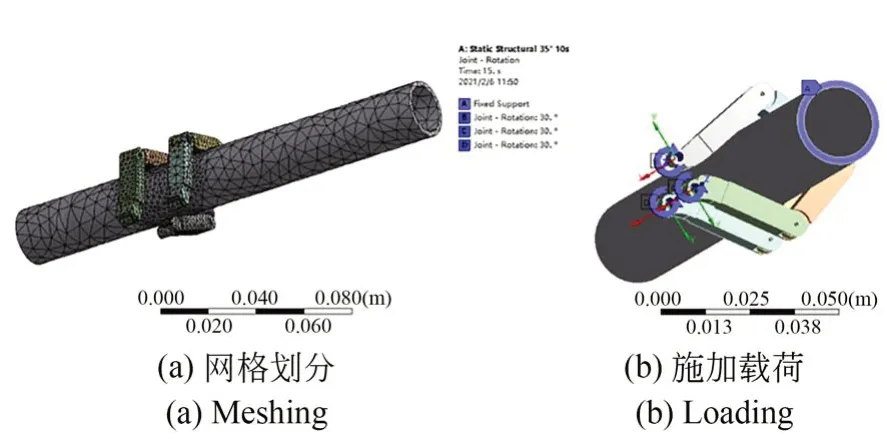
图2 网格划分与施加荷载示意图Fig.2 Schematic diagram of meshing and loading
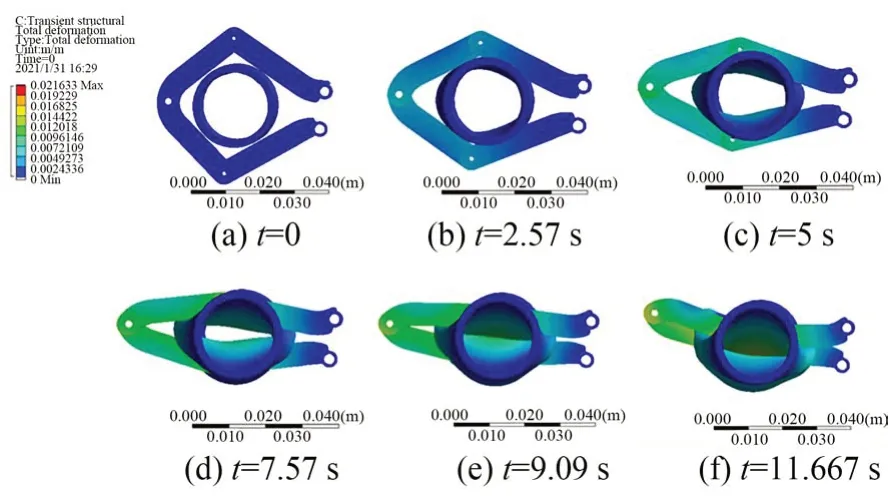
图3 夹持过程位移云图Fig.3 Displacement during clamping
为了验证张角范围内是否能满足控便性能,本文对夹持过程中肠道形成肛肠角的过程也进行了分析。如图4 所示,t=9.09 s 时,肛肠角为95.2°达到近似控便状态;t=11.667 s 时,肛肠角为62.2°,满足生理控便的要求。
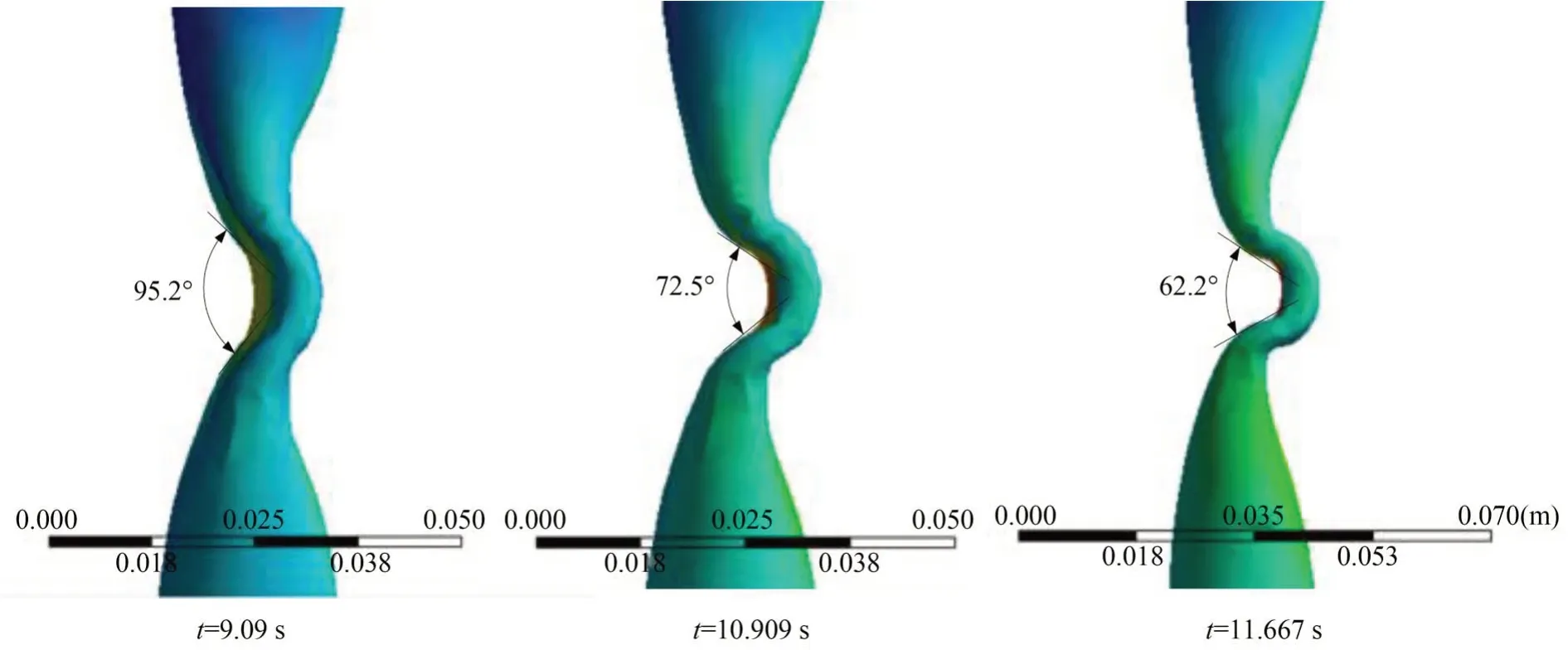
图4 仿真肛肠角Fig. 4 Simulated anorectal angle
如图5 所示,肠道处于夹紧状态时,高压区仅集中出现于肠道夹持区域两侧,肠道表面平滑。此外,如图6 所示,夹持臂与肠道的接触力随夹持过程逐渐增大,在θ=32°时存在较大抖动。原因在于此时肠道几乎为夹紧状态,而肠道组织尽管存在粘滞性,其体积在受压过程中近乎不变。仿真结果还显示,接触力在极限位置达到最大,约为1.6 N;肠道血供压强阈值10 kPa 与接触面积200 mm2之 积 为 血 供 压 力 阈 值 2 N[10],1.6 N<2 N 说明夹持机构能够保障肠道血供安全。
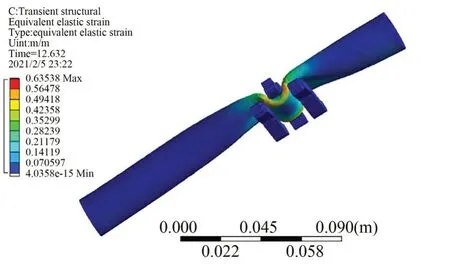
图5 肠道应变云图Fig.5 Colon strain
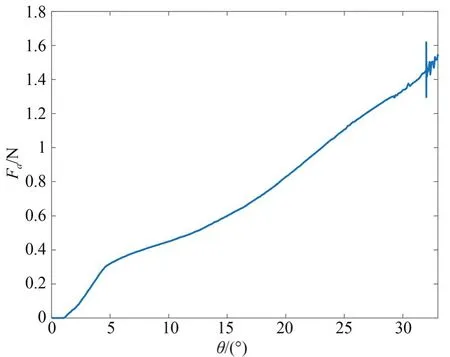
图6 操作臂-肠道接触力与摆杆转角的关系Fig.6 Relationship between arm-colon contact force and swing rod angle
已知医用尼龙PA6 的屈服强度σs=30 Mpa,设安全系数[s]=1.1,则安全应力σ[s]=σs/[s]=27.27 MPa。夹持臂应力仿真得到最大应力σmax=6.298 9 MPa<σ[s],因此,医用尼龙 PA6材料符合夹持臂安全应力强度要求。
3.2.3 传动机构设计
已知夹持臂旋转点位置固定,跟据张角范围所设计的双轴驱动传动机构包含多级行星齿轮减速器以及基于沟槽凸轮摆杆结构。为增大原始电机的输出扭矩,减速器由总传动比为3 802的5 级行星齿轮构成,每级行星齿轮有三个行星轮和一个太阳轮。此外,多级齿轮还增大了摩擦力,使反行程时驱动力不足以克服摩擦力矩,从而实现“自锁”。基于沟槽凸轮摆杆的摆动转盘是传动机构的关键:减速器输出轴与摆动转盘中心重合,圆端销在外部约束为沟槽的凸轮轮廓里滑动,通过双轴驱动两侧夹持臂相向运动。因此需要两个沟槽凸轮,且二者组合在平面摆动转盘上。
记摆杆初始摆角θ0,凸轮初始角为φ0,摆杆长度l,凸轮摆杆中心距a,凸轮升程角为φ,摆杆转角θ,可根据几何关系通过解析法计算凸轮的理论轮廓线。因机构匀速夹持,传动机构的摆杆转角θ与凸轮转角φ满足式(19),其中C为常数:

3.2.4 设计结果
表1 给出夹持机构的设计参数。由式(7)、(8)得顶点D的速度和加速度,如图 7 所示。D的速度与张角近乎呈线性从2.65 mm·s-1减少至0.15 mm·s-1,R2=0.9958;加速度aD不超过 6.3 mm·s-2,不至于损伤体内生物组织。NCAAS 夹持机构设计结构如图8 所示。

图8 夹持机构Fig.8 Clamping mechanism
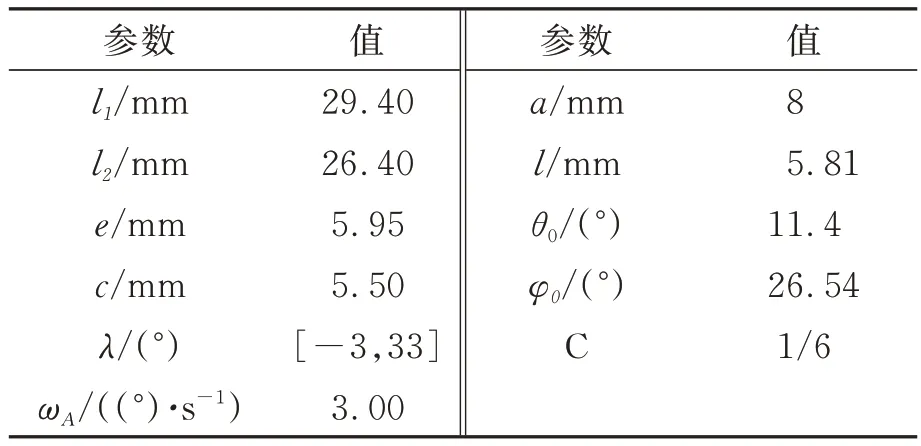
表1 设计参数表Tab.1 Design Parameters
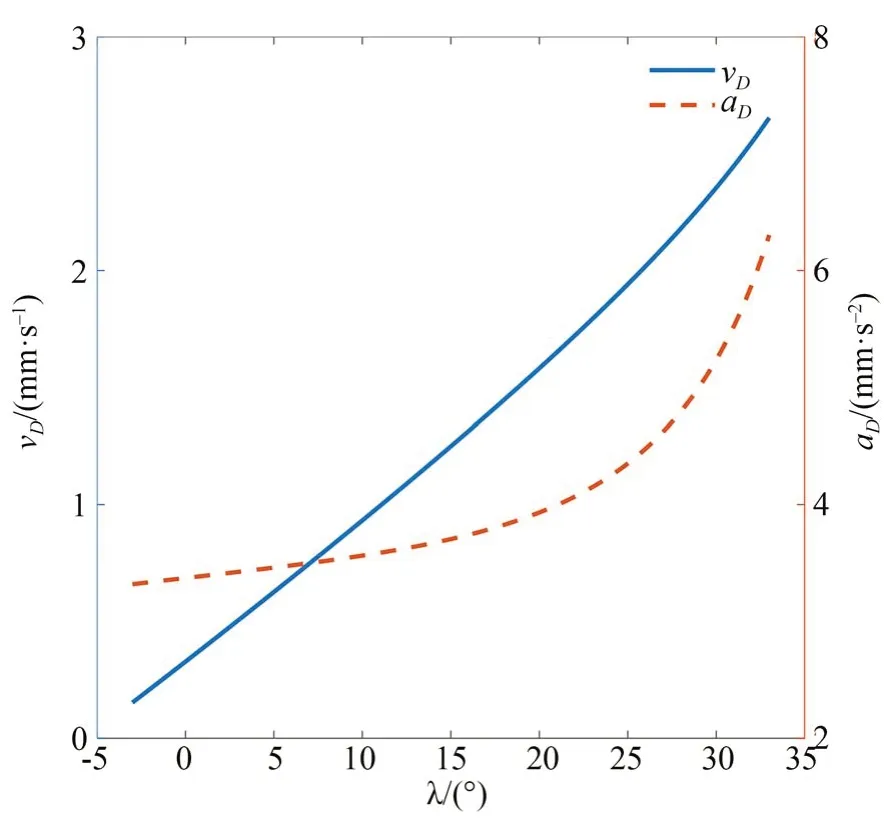
图7 顶点速度,加速度与夹持臂张角的关系Fig.7 Relationship between vertex velocity,acceleration and opening angle of the clamping arm
4 实验研究
4.1 NCAAS 样机
NCAAS 样机如图9 所示,机构主体由医用尼龙PA6 材料经3D 打印制成,高度42.7 mm,长度最大为68.2 mm,夹持臂张口内径为10.1~23.8 mm。执行机构质量为55.19 g,表面覆盖一层2 mm 厚生物相容性良好的硅胶薄膜,以减少植入体内导致的组织增生,并能提升夹持肠道的柔性,减少医用尼龙刚性材料直接接触肠道造成的损伤。

图9 NCAAS 样机Fig.9 NCAAS prototype
夹持机构由从上至下依次设置三组交错叠放的夹持臂和基于沟槽凸轮摆杆的传动机构构成,每组夹持臂包含通过钛合金螺钉铰接的两个操作臂。夹持臂近端分别固定于两根轴上,上、下层夹持臂连于同一根轴,中层夹持臂连接另一根轴并置于另侧,夹持臂间纵向间隔4 mm。为实现封闭功能,三组夹持臂远端通过医用钛合金螺钉一并铰接。经实验验证,NCAAS 机构只能由凸轮驱动摆杆,无法反向驱动;此外,与仅依靠齿轮传动的方法[21]相比,其受力面、受力强度更大。
4.2 控排便时长实验
使用秒表记录3 次执行机构的控便、排便时长,二者分别对应夹持机构的夹持、张开时间,结果如表2 所示,控排便平均时间为7.25 s。
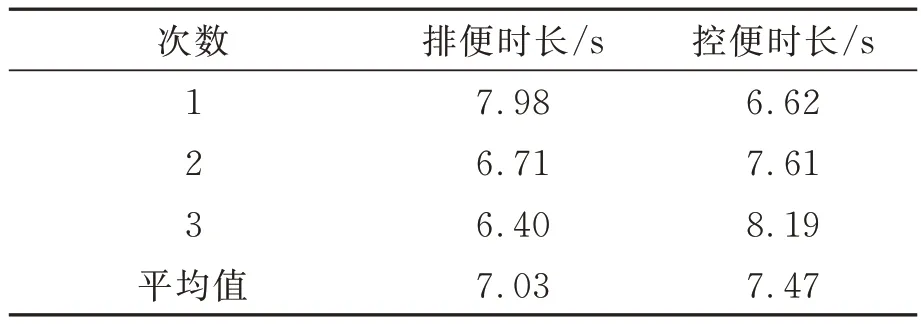
表2 排便和控便时长记录表Tab.2 Defecation and defecation control time record
4.3 夹持性能实验
为验证NCAAS 的夹持性能,本文实施了机构夹持猪大肠的离体实验。考虑到人体直肠肛管的特征,离体实验装置如图10(a)所示,将一段直径约20 mm、厚度3 mm、长度200 mm 的新鲜猪大肠的上端套入波纹管并用扎口带密封,波纹管竖直固定在铁架台上,铁架台下方有一块中间有圆孔的支撑台。NCAAS 样机放置于圆孔上方,夹持猪大肠下端保持夹紧控便的状态。实验时,向波纹管顶注入自来水使肠腔膨胀、增压以模拟粪便积累,粪便量以100 g 为间隔通过注水量模拟,等待肠道及机构状态稳定时记录注水量与液体渗漏情况。

图10 夹持性能实验图Fig. 10 Clamping performance experimental
文献[14]表明粪便积累到 110 g、肠腔压力约2.5 kPa 时人体将产生便意;而当粪便增至220g、肠压增至4.6 kPa 时内括约肌将失去协助控便能力,人体必须排便。表3 结果表明NCAAS 样机在粪便量达700 g 时发生少量渗漏,因此最大控便量约为700 g,满足人体日常生理需求。如图10(b)所示,NCAAS 样机闭合时肠道表面保持平滑、无明显褶皱,该现象说明夹持机构尺寸选择合理、安全;如图 10(c)所示,NCAAS 控便时形成的肛肠角不大于90°。
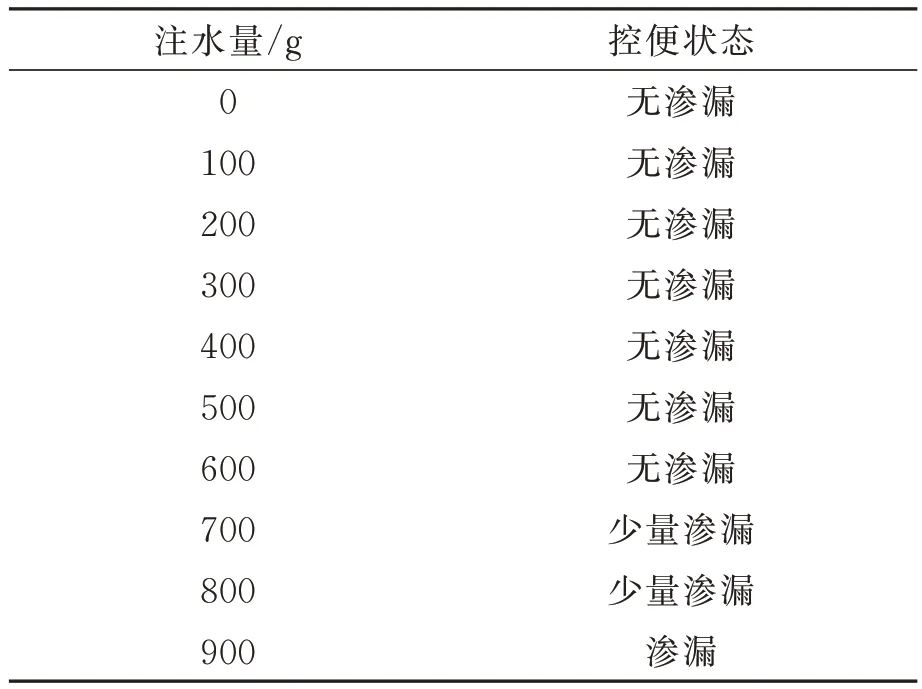
表3 夹持性能实验记录表Tab.3 Clamping performance test record
5 结 论
本文提出了一种AAS 夹持机构优化设计的方法:首先建立夹持机构的几何模型和数学模型,对相关力学性能进行理论推导;然后通过有限元分析对机构优化设计,验证理论分析可行性;最后通过实验测试机构的有效性。该方法对机械结构的设计与优化具有普适性。
基于该方法,本文设计了一种能封闭包绕直肠和肛管的NCAAS 夹持机构,机构由基于沟槽凸轮摆杆传动的三层医用尼龙夹持臂组成,表面覆一层医用硅胶膜,具有较好的生物相容性和较短的响应时间。夹持肠道过程中,本文基于虚功原理推导了夹持力方程,基于有限元进行瞬时动力学仿真,仿真结果显示近似控便状态时肛肠角为95.2°,夹紧时肛肠角为62.2°,说明了该夹持机构控便的可行性;而且夹持臂在肠道上的作用力1.6 N 小于肠道破裂压力,具备一定生物力学相容性。质量55.19 g 的NCAAS 样机高度42.7 mm,长度不超过68.2 mm,控排便平均时长7.25 s,较大缩短了AAS 的响应时间。离体实验结果表明NCAAS 控便量达700 g,肛肠角小于90°,肠道夹持区域平滑,因此能够满足人体控便要求,达到了设计优化的目的。
但本文所述NCAAS 样机所实施的离体实验采用自来水模拟粪便,而实际粪便多为半固态。实验过程中,夹持力数据收集不足,因此实验结果具有一定局限性。NCAAS 最终将原位植入于潮湿、复杂的体内环境,今后工作将聚焦于动物实验从而验证机构长期植入的有效性。

